Thulium thulium
(lat. Thulium), chemický prvok III. skupiny periodickej tabuľky, patrí medzi lantanoidy. Pomenovaný z gréckeho Thúlē - Thule. Kovové. Hustota 9,318 g/cm3; t pl 1545 °C. Umelo vyrobený rádioaktívny izotop 170 Tm je zdrojom mäkkého röntgenového žiarenia.
THULIUMTHULIUM (lat. Thulium, medzi starovekými geografmi Thule - krajný sever sveta), Tm (čítaj „thulium“), chemický prvok s atómovým číslom 69, atómová hmotnosť 168,93421, predtým bola chemická značka Tu. V prírode sa vyskytuje jeden stabilný izotop, 169 Tm. Konfigurácia troch vonkajších elektronických vrstiev je 4s 2 p 6 d 10 f 13 5 s 2 p 6 d 0 6s 2. Oxidačné stavy +3, +2 (valencia III, II).
Nachádza sa v skupine IIIB v období 6 periodickej tabuľky prvkov. Lantanoid (cm. LANTANOIDY).
Atómový polomer 0,174 nm, iónový polomer (koordinačné číslo 6) Tu 3+ - 0,102 nm, Tu 2 + - 0,117 nm. Postupné ionizačné energie sú 6,181, 12,05, 23,7, 42,7 eV. Elektronegativita podľa Paulinga (cm. PAULING Linus) 1,1.
História objavovania
Objavil ho v roku 1879 švédsky chemik P. T. Kleve (cm. KLEVE Pierre Theodore), ktorý izoloval oxid nového prvku z minerálu gadolinitu. Po identifikácii prvku spektrálnou metódou ho Kleve pomenoval po svojej vlasti.
Byť v prírode
Obsah v zemskej kôre je 2,7·10 -5%. Obsahuje minerály: bastnäsite (cm. BASTNESIT), monazit (cm. MONAZIT), loparit (cm. LOPARIT),
orthitis (cm. ORTI),
xenotime (cm. XENOTIM).
Potvrdenie
Thulium je koncentrované yterbiom (cm. YTTERBIUM) a lutécium (cm. LUTETIUM). Separácia a čistenie sa uskutočňuje pomocou iónovej chromatografie alebo extrakčných metód.
Kovové thúlium sa získava metalotermickou redukciou TmF3 pomocou vápnika (cm. VÁPNIK):
2TmF3+3Ca=3CaF2+2Tm
alebo redukcia Tm203 kovovým lantánom (cm. LANTHANUM):
Tm203+La=La203+Tm
Fyzikálne a chemické vlastnosti
Thulium je mäkký strieborno-šedý kov. Existuje v jednej modifikácii s hexagonálnou kryštálovou mriežkou typu Mg, A= 0,35375 nm, c = 0,55546 nm. Teplota topenia 1545°C, teplota varu 1947°C, hustota 9,318 kg/dm3.
Compact Tm je stabilný na vzduchu. S halogénmi (cm. HALOGÉN) pri zahrievaní reaguje za vzniku TmF3 a TmCl3. Thulium reaguje s minerálnymi kyselinami za vzniku solí thulium(III). So silnými redukčnými činidlami sa Tm 3+ zníži na Tm 2+.
Kalcináciou dusičnanu Tm(NO 3) 3, oxalátu Tm 2 (C 2 O 4) 3, síranu Tm 2 (SO 4) 3 a iných zlúčenín Tm (III) na vzduchu pri 800-900 °C, oxid thulitý Tu 2 O 3 sa vytvorí.
Aplikácia
Thulium sa používa ako aktivátor niektorých fosforových a laserových materiálov a používa sa pri syntéze umelých granátov.
encyklopedický slovník. 2009 .
Synonymá:Pozrite sa, čo je „thulium“ v iných slovníkoch:
- (Tulium), Tm, chemický prvok skupiny III periodickej tabuľky, atómové číslo 69, atómová hmotnosť 168,9342; patrí k prvkom vzácnych zemín; kov. Objavil ho švédsky chemik P. Kleve v roku 1879... Moderná encyklopédia
- (lat. Thulium) Tm, chemický prvok III. skupiny periodickej tabuľky, atómové číslo 69, atómová hmotnosť 168,9342, patrí medzi lantanoidy. Názov z gréčtiny. Thule Thule. Kovové. Hustota 9,318 g/cm3, teplota topenia 1545 °C. Umelo získané...... Veľký encyklopedický slovník
- (z gr. Thule Thule, podľa antických geografov krajná severná hranica sveta; lat. tulium * a. thulium; n. Thulium; f. thulium; i. tulio), Tm, chem. prvok skupiny III periodický. Mendelejevov systém, at.sci. 69, o. m. 168,9342, odkazuje na... ... Geologická encyklopédia
- (lat. Tulium), Tm, chemický. prvok skupiny III periodický. sústav prvkov, at. číslo 69, o. hmotnosť 168,9342; patrí medzi lantanoidy. V prírode sa vyskytuje stabilne 169 Tm. Externá konfigurácia elektrónové obaly Energia sekvenčná. ionizácia...... Fyzická encyklopédia
Podstatné meno, počet synoným: 3 lantanoid (15) kov (86) prvok (159) ASIS Slovník synonym ... Slovník synonym
Thulium- (Tulium), Tm, chemický prvok skupiny III periodickej tabuľky, atómové číslo 69, atómová hmotnosť 168,9342; patrí k prvkom vzácnych zemín; kov. Objavil ho švédsky chemik P. Kleve v roku 1879. ... Ilustrovaný encyklopedický slovník
69 Erbium ← Thulium → Ytterbium ... Wikipedia
- (lat. Thulium), chemický. prvok III gr. periodické systému, patrí medzi lantanoidy. názov z gréčtiny Thule (staroveký názov) extrémny sever krajín Kovové. Hustota 9,318 g/cm3; tnl 1545 °C. Umelý rádioaktívny nuklid 170Tm zdroj mäkkého... ... Prírodná veda. encyklopedický slovník
- (lat. thule pololegendárna krajina, v staroveku považovaná za severný cíp zeme) chemická látka. prvok z čeľade lantanoidov, symbol Tm (lat. thulium), kov. Nový slovník cudzích slov. od EdwART, 2009. thulium i, množné číslo. Žiadne M. (… Slovník cudzích slov ruského jazyka
Thulium- Pozri Thulium (Tm) ... Encyklopedický slovník hutníctva
knihy
- Moral Reflections (kožená väzba, zlatý okraj), Cicero Marcus Tullius. Marcus Tullius Cicero, vynikajúci rímsky právnik a štátnik, bol zvolený za konzula, senátom bol vyhlásený za otca vlasti a vojaci jemu zverenej provincie za cisára. Avšak…
Elektrónová konfigurácia atómu je vzorec znázorňujúci usporiadanie elektrónov v atóme podľa úrovní a podúrovní. Po preštudovaní článku sa dozviete, kde a ako sa nachádzajú elektróny, zoznámite sa s kvantovými číslami a budete vedieť zostrojiť elektrónovú konfiguráciu atómu podľa jeho čísla, na konci článku je tabuľka prvkov.
Prečo študovať elektronickú konfiguráciu prvkov?
Atómy sú ako stavebnica: existuje určitý počet častí, líšia sa od seba, ale dve časti rovnakého typu sú úplne rovnaké. Táto stavebnica je však oveľa zaujímavejšia ako plastová a tu je dôvod. Konfigurácia sa mení v závislosti od toho, kto je v blízkosti. Napríklad kyslík vedľa vodíka Možno premení na vodu, keď sa v blízkosti sodíka zmení na plyn, a keď sa priblíži k železu, úplne ho premení na hrdzu. Aby sme odpovedali na otázku, prečo sa to deje a predpovedali správanie atómu vedľa druhého, je potrebné študovať elektronickú konfiguráciu, o ktorej sa bude diskutovať nižšie.
Koľko elektrónov je v atóme?
Atóm pozostáva z jadra a okolo neho rotujúcich elektrónov; jadro pozostáva z protónov a neutrónov. V neutrálnom stave má každý atóm počet elektrónov rovný počtu protónov v jeho jadre. Počet protónov je určený atómovým číslom prvku, napríklad síra má 16 protónov - 16. prvok periodickej tabuľky. Zlato má 79 protónov - 79. prvok periodickej tabuľky. Podľa toho má síra v neutrálnom stave 16 elektrónov a zlato má 79 elektrónov.
Kde hľadať elektrón?
Pozorovaním správania elektrónu boli odvodené určité vzorce, ktoré sú popísané kvantovými číslami, celkovo sú štyri:
- Hlavné kvantové číslo
- Orbitálne kvantové číslo
- Magnetické kvantové číslo
- Spin kvantové číslo
Orbitálny
Ďalej namiesto slova orbita budeme používať termín „orbital“; orbital je vlnová funkcia elektrónu; zhruba je to oblasť, v ktorej elektrón trávi 90% svojho času.
N - úroveň
L - škrupina
M l - orbitálne číslo
M s - prvý alebo druhý elektrón v orbitáli
Orbitálne kvantové číslo l
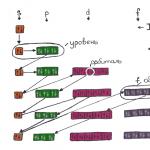
Ako výsledok štúdia elektrónového oblaku zistili, že v závislosti od energetickej úrovne má oblak štyri hlavné formy: guľu, činky a dve ďalšie, zložitejšie. V poradí zvyšovania energie sa tieto formy nazývajú s-, p-, d- a f-obal. Každý z týchto obalov môže mať 1 (na s), 3 (na p), 5 (na d) a 7 (na f) orbitály. Orbitálne kvantové číslo je obal, v ktorom sa nachádzajú orbitály. Orbitálne kvantové číslo pre orbitály s, p, d a f má hodnoty 0, 1, 2 alebo 3.
Na s-plášte je jeden orbitál (L=0) - dva elektróny
Na obale p sú tri orbitály (L=1) - šesť elektrónov
Na obale d je päť orbitálov (L=2) - desať elektrónov
Na f-plášte je sedem orbitálov (L=3) - štrnásť elektrónov
Magnetické kvantové číslo m l
Na obale p sú tri orbitály, sú označené číslami od -L do +L, to znamená, že pre obal p (L=1) sú orbitály "-1", "0" a "1" . Magnetické kvantové číslo označujeme písmenom m l.
Vo vnútri obalu je jednoduchšie, aby sa elektróny nachádzali v rôznych orbitáloch, takže prvé elektróny vyplnia jeden v každom orbitále a potom sa ku každému pridá pár elektrónov.
Zvážte d-shell:
d-plášť zodpovedá hodnote L=2, čiže piatim orbitálom (-2,-1,0,1 a 2), prvých päť elektrónov vypĺňa škrupinu s hodnotami M l =-2, M l = -1, M, = 0, M, = 1, M, = 2.
Spinové kvantové číslo m s
Spin je smer otáčania elektrónu okolo svojej osi, existujú dva smery, takže kvantové číslo spinu má dve hodnoty: +1/2 a -1/2. Jedna energetická podúroveň môže obsahovať iba dva elektróny s opačnými spinmi. Spinové kvantové číslo sa označuje m s
Hlavné kvantové číslo n
Hlavným kvantovým číslom je energetická hladina, v súčasnosti je známych sedem energetických úrovní, každá je označená arabskou číslicou: 1,2,3,...7. Počet škrupín na každej úrovni sa rovná číslu úrovne: na prvej úrovni je jedna škrupina, na druhej dve atď.
Elektrónové číslo

Každý elektrón teda možno opísať štyrmi kvantovými číslami, kombinácia týchto čísel je jedinečná pre každú polohu elektrónu, vezmite si prvý elektrón, najnižšia energetická hladina je N = 1, na prvej úrovni je jeden obal, tzv. prvá škrupina na ľubovoľnej úrovni má tvar gule (s -shell), t.j. L=0, magnetické kvantové číslo môže nadobúdať iba jednu hodnotu, M l = 0 a spin bude rovný +1/2. Ak vezmeme piaty elektrón (v akomkoľvek atóme), potom jeho hlavné kvantové čísla budú: N=2, L=1, M=-1, spin 1/2.
Thulium - 69
Thulium (Tm) - prvok vzácnych zemín, atómové číslo 69, atómová hmotnosť 168,93, teplota topenia 1545 °C, hustota 9,346 g/cm3.
Thulium dostalo svoje meno na počesť legendárnej krajiny „Thule“, ktorú starovekí geografi považovali za najsevernejšiu zem, ktorá v súčasnosti zodpovedá geografickej polohe Škandinávskemu polostrovu. Thulium bolo objavené v roku 1879 spektroskopiou. Thulium je jedným z bezvýznamne najbežnejších lantanoidov v prírode, navyše bolo veľmi ťažké ho izolovať zo zmesi s inými kovmi vzácnych zemín. Trvalo niekoľko rokov, kým sa získal dvadsaťpercentný koncentrát thúlia a potom sa v ňom zvýšil obsah thúlia na 99%. Chromatografická metóda používaná na separáciu kovov vzácnych zemín v súčasnosti výrazne zjednodušila a urýchlila výrobu oxidov thúlia a následne výrobu čistého kovu. Vo svojej čistej forme sa thulium získalo v roku 1911.
Thulium je jedným z najťažších lantanoidov, jeho hustota je blízka medi a niklu.

Thulium — strieborno-biele mäkké
Thulium — strieborno-biele mäkké, kujný, viskózny kov, na vzduchu neoxiduje, ale pri zahrievaní na vlhkom vzduchu oxiduje mierne. Reaguje s minerálnymi kyselinami za vzniku solí thúlia. Pri zahrievaní reaguje s halogénmi a dusíkom. V prírode je thulium prítomné v mineráloch ako xenotim, euxenit, monazit a loparit. Obsah v zemskej kôre je 2,7x10-5% z celkovej hmotnosti. V prírodných a umelých druhoch surovín je oxid tulium obsiahnutý extrémne zriedkavo - v eudialyte - 0,3% a v iných mineráloch - ešte menej. Z thúlia sa získalo 32 umelých rádioaktívnych izotopov s rôznym polčasom rozpadu. Len jeden sa vyskytuje prirodzene, thulium-169.
PRÍJEM.
Po obohatení o prírodné minerály sa výsledné koncentráty zo zmesi kovov vzácnych zemín spracujú, v dôsledku čoho sa thulium skoncentruje s ťažkými lantanoidmi - ytterbiom a lutécium. Separácia a rafinácia sa vykonáva extrakčnou alebo iónomeničovou chromatografiou pomocou komplexónov (organické látky, ktoré tvoria komplexné zlúčeniny s kovovými iónmi). Kovové thúlium sa získava tepelnou redukciou fluoridu thulnatého pomocou TmF3-vápnika alebo oxidu thulnatého s Tm2O3-lantánom. Thulium sa získava aj zahrievaním dusičnanov, síranov a šťavelanov tulia na vzduchu na 800-900°C.
APLIKÁCIA.
Napriek nízkej prevalencii v prírode a vysokým nákladom sa thulium v našej dobe začalo pomerne široko používať vo vede a priemysle.
Liek. Izotop thulium, thulium-170, ktorý má mäkké gama žiarenie, sa používa na vytváranie diagnostických prístrojov, najmä pre oblasti ľudského tela, ktoré sú ťažko dostupné bežným röntgenovým prístrojom. Tieto rádioprenosové zariadenia s rádioaktívnym thúliom sú jednoduché a ľahko použiteľné v lekárskej praxi.
Laserové materiály. Ióny thúlia sa používajú na generovanie infračerveného laserového žiarenia. Kovové pary thúlia sa používajú na excitáciu laserového žiarenia s premenlivou frekvenciou (vlnová dĺžka). Thulium sa používa na výrobu laserových materiálov, ako aj na výrobu syntetických granátov.
Magnetické médiá. Kovové thúlium sa používa na výrobu ferogranátov na vytváranie médií na ukladanie informácií.
Materiály ThermoEMF. Thulium monotellurid má vysokú úroveň termoEMF s vysokou účinnosťou tepelných konvertorov, avšak rozšírenému použitiu tulia ako termoprvkov bránia jeho vysoké náklady.
Polovodiče. Telurid thúlia sa používa ako modifikátor na reguláciu polovodičových vlastností teluridu olovnatého.
Jadrová energia. Thulium boritan sa používa ako prísada do špeciálnych emailov na ochranu pred neutrónovým žiarením.
Supravodiče. Zlúčeniny tulia sú súčasťou vysokoteplotných supravodivých materiálov.
Výroba skla. Thulium je zložkou rôznych oxidových materiálov pri výrobe skla a keramiky pre katódové trubice.
-
V roku 1879 švédsky chemik Per Theodor Kleve izoloval ďalšie dve „zeme“ z Marignacovho „erbia“, ktoré nazval holmium a thulium (Thule je starorímsky názov pre Škandináviu). Spektrá ukázali, že thulium obsahuje zatiaľ neznámy chemický prvok. Neskôr sa Kleve podarilo získať niektoré soli tohto prvku, čo ukazuje, že majú svetlozelenú farbu. Tak bol objavený jeden z najvzácnejších prvkov, ktorému bol priradený názov Thulium a symbol Tm.
V roku 1911 T. W. Richards prvok izoloval a určil jeho atómovú hmotnosť.Byť v prírode, prijímať:
Thulium je stopový prvok, jeho obsah v zemskej kôre je 2,7·10 -5 % hm. Je súčasťou týchto minerálov: monazit (Ce, La...)PO 4, bastnäsit (Ce, La, Pr)CO 3 F a iné. Thulium sa izoluje zo zmesi prvkov vzácnych zemín pomocou iónovej chromatografie alebo extrakcie, prevedie sa na oxid a potom na fluorid. Kovové thúlium sa získava redukciou TmF3 vápnikom alebo Tm203 lantánom
Fyzikálne vlastnosti:
Je to striebornosivý kov, je kujný, tvárny a pomerne mäkký. Hustota 9,321 g/cm 3, t tav. = 1545 °C, teplota varu = 1950 °C. Prirodzené thulium je monoizotopický prvok (thulium-169), umelo získané izotopy thulium majú krátke polčasy (najdlhšie thulium-170 je 128,6 dňa).
Chemické vlastnosti:
Túlium je celkom stabilné na suchom vzduchu, pri zahriatí kovové thúlium reaguje s halogénmi, dusíkom a vodíkom. Odolné voči fluoridom. Reaguje s vriacou vodou za vzniku hydroxidu Tm(OH) 3 a vodíka. Thulium reaguje s minerálnymi kyselinami (okrem HF) za vzniku solí tulia (III).
V zlúčeninách vykazuje prevažne oxidačný stav +3. Väčšina z nich sa vyznačuje zelenkastou farbou rôznych odtieňov.Najdôležitejšie spojenia:
Oxid thulitý (III)., Tm 2 O 3, možno získať opatrnou dehydratáciou hydroxidu Tm(OH) 3, rozkladom dusičnanu alebo šťavelanu thulnatého. Svetlozelené kryštály, nerozpustné vo vode.
Hydroxid thulitý, Tm(OH) 3, amorfná látka nerozpustná vo vode. Môže sa získať výmennou reakciou z rozpustných solí thulnatého (III). S kyselinami tvorí thulium(III) soli.
Fluorid thulitý (III)., TmF 3 - bezfarebné kryštály, nerozpustné, získané výmennými reakciami alebo pôsobením plynného HF na oxid thulitý
Chlorid thulitý, TmСl 3 - žlté kryštály, rozpustné, tvorí kryštalický hydrát TmСl 3 * 7H 2 O - zelenkasté kryštály. Zahrievanie kryštalického hydrátu je sprevádzané hydrolýzou s tvorbou oxochloridu thulium TmOCl. Silné redukčné činidlá (alkalické kovy) sa môžu premeniť na chlorid thulitý, ktorý sa ľahko oxiduje vodou a kyslíkom.
Dusičnan thulitý (III)., Tm(NO 3) 3, zelenkasté kryštály, dobre rozpustné vo vode, tvorí kryštalický hydrát so zložením Tm(NO 3) 3 5H 2 O.
Bezvodá soľ sa pripravuje pôsobením oxidu dusnatého (IV) na oxid thulitý (III) alebo kovové thulium:
Tm + 2N204 = Tm(N03)3 + 3NO
Síran thulitý Tm 2 (SO 4) 3, zelené kryštály. Rozpúšťa sa vo vode a tvorí kryštalický hydrát so zložením Tm 2 (SO 4) 3 9H 2 O.Aplikácia:
Thulium sa používa ako aktivátor niektorých fosforových a laserových materiálov a používa sa pri syntéze umelých granátov. Obmedzené použitie pri výrobe termoelektrických a magnetických materiálov.
Rádioaktívny izotop thulium-170 sa používa ako zdroj žiarenia v prenosných röntgenových prístrojoch (mäkké gama žiarenie) a defektoskopoch. Pracovnou látkou v nich je oxid thulitý.Pramene: 1. Objav prvkov a pôvod ich názvov. Thulium
2. Populárna knižnica chemických prvkov Vydavateľstvo „Nauka“, 1977.
Detekcia kazov. Rádioaktívny izotop thulium-170 sa používa na detekciu chýb ľahkých neželezných kovov a ich zliatin, ako aj tenkých oceľových plátov s hrúbkou do 2 mm. Hliníkové výrobky s hrúbkou až 70 mm je možné ľahko skenovať izotopom thulium-170, čo umožňuje odhaliť v nich najmenšie chyby. V tomto prípade sa používa fotoelektrické zariadenie, ktoré využíva žiarenie thulium gama a vytvára vysoko kontrastný obraz skúmaného objektu. Thulium-170 sa pripravuje ožiarením oxidu thulnatého neutrónmi, ktorý sa vloží do hliníkovej ampulky a následne sa s ňou použije.