Barium on toisen ryhmän pääalaryhmän, D. I. Mendelejevin kemiallisten alkuaineiden jaksollisen järjestelmän kuudennen jakson alkuaine, atominumerolla 56. Se on merkitty symbolilla Ba (lat. barium). Yksinkertainen aine on pehmeä, sitkeä hopeanvalkoinen maa-alkalimetalli. Sillä on korkea kemiallinen aktiivisuus.
Bariumin löytämisen historiaKarl Scheele löysi bariumin BaO-oksidin muodossa vuonna 1774. Vuonna 1808 englantilainen kemisti Humphrey Davy valmisti bariumamalgaamin kosteaa bariumhydroksidia elektrolyysillä elohopeakatodilla; haihdutettuaan elohopean kuumentamalla, hän eristi bariummetallin.
Vuonna 1774 ruotsalainen kemisti Carl Wilhelm Scheele ja hänen ystävänsä Johan Gottlieb Hahn tutkivat yhtä raskaimmista mineraaleista, raskasta BaSO 4 :a. He onnistuivat eristämään aiemmin tuntemattoman "raskasmaan", jota myöhemmin kutsuttiin bariitiksi (kreikan kielestä βαρυς - raskas). Ja 34 vuoden kuluttua Humphry Davy, joka oli altistanut märän bariittimaan elektrolyysin, sai siitä uuden alkuaineen - bariumin. On huomattava, että samana vuonna 1808, hieman Davya aikaisemmin, Jene Jacob Berzelius ja hänen työtoverinsa saivat kalsiumin, strontiumin ja bariumin amalgaameja. Näin syntyi elementti barium.
Muinaiset alkemistit kalsinoivat BaSO 4:a puulla tai hiilellä ja saivat fosforoivia "bologneselaisia helmiä". Mutta kemiallisesti nämä jalokivet eivät ole BaO, vaan bariumsulfidi BaS.
nimen alkuperä
Se sai nimensä kreikkalaisista barysista - "raskas", koska sen oksidilla (BaO) on luonnehdittu olevan epätavallisen suuri tiheys tällaisille aineille.
Bariumin löytäminen luonnostaMaankuoressa on 0,05 % bariumia. Tämä on melko paljon - paljon enemmän kuin esimerkiksi lyijyä, tinaa, kuparia tai elohopeaa. Puhtaassa muodossaan sitä ei ole maaperässä: barium on aktiivinen, se kuuluu maa-alkalimetallien alaryhmään ja on luonnollisesti melko lujasti sitoutunut mineraaleihin.
Bariumin päämineraaleja ovat jo mainittu raskas sparra BaSO 4 (useammin bariitiksi kutsuttu) ja witeriitti BaCO3, jotka on nimetty englantilaisen William Witheringin (1741 ... 1799) mukaan, joka löysi tämän mineraalin vuonna 1782. Bariumsuoloja löytyy pieni pitoisuus monissa kivennäisvesissä ja merivedessä. Alhainen pitoisuus tässä tapauksessa on plus, ei miinus, koska kaikki bariumsuolat, paitsi sulfaatti, ovat myrkyllisiä.
Bariumesiintymien tyypitMineraaliyhdistelmien mukaan bariittimalmit jaetaan monomineraalisiin ja kompleksisiin. Monimutkaiset kompleksit jaetaan bariittisulfidi (sisältää lyijyä, sinkkiä, joskus kupari- ja rautapyriittisulfideja, harvemmin Sn, Ni, Au, Ag), bariitti-kalsiitti (sisältää jopa 75 % kalsiittia), rauta-bariitti (sisältää magnetiittia) , hematiitti ja götiitti ja hydrogoetiitti ylävyöhykkeillä) ja bariitti-fluoriitti (paitsi bariitti ja fluoriitti, ne sisältävät yleensä kvartsia ja kalsiittia, ja sinkki-, lyijy-, kupari- ja elohopeasulfideja esiintyy joskus pieninä epäpuhtauksina).
Käytännön näkökulmasta eniten kiinnostavat hydrotermiset suonen monomineraali-, bariittisulfidi- ja bariitti-fluoriittiesiintymät. Jotkut metasomaattiset arkkikerrostumat ja eluviaaliset sijoittimet ovat myös teollisesti tärkeitä. Sedimenttiesiintymät, jotka ovat tyypillisiä vesialtaiden kemiallisia sedimenttejä, ovat harvinaisia ja niillä ei ole merkittävää roolia.
Bariittimalmit sisältävät pääsääntöisesti muita hyödyllisiä komponentteja (fluoriitti, galenia, sfaleriitti, kupari, kulta teollisissa pitoisuuksissa), joten niitä käytetään yhdessä.
Bariumin isotoopitLuonnollinen barium koostuu seitsemän stabiilin isotoopin seoksesta: 130 Ba, 132 Ba, 134 Ba, 135 Ba, 136 Ba, 137 Ba, 138 Ba. Jälkimmäinen on yleisin (71,66 %). Tunnetaan myös bariumin radioaktiivisia isotooppeja, joista tärkein on 140 Ba. Se muodostuu uraanin, toriumin ja plutoniumin hajoamisen aikana.
Bariumin saaminenMetallia voidaan saada eri tavoin, erityisesti elektrolyysillä bariumkloridin ja kalsiumkloridin sulasta seoksesta. Bariumia on mahdollista saada palauttamalla se oksidista aluminotermisellä menetelmällä. Tätä varten witeriitti poltetaan hiilellä ja bariumoksidia saadaan:
BaCO 3 + C → BaO + 2CO.
Sitten BaO:n seos alumiinijauheen kanssa kuumennetaan tyhjiössä 1250 °C:seen. Pelkistetyn bariumin höyryt kondensoituvat putken kylmiin osiin, joissa reaktio tapahtuu:
3BaO + 2Al → Al 2O 3 + 3Ba.
On mielenkiintoista, että bariumperoksidia BaO 2 sisältyy usein aluminotermiaan tarkoitettujen sytytysseosten koostumukseen.
Bariumoksidin saaminen yksinkertaisella witeriitin kalsinaatiolla on vaikeaa: witeriitti hajoaa vain yli 1800 °C:n lämpötiloissa. BaO:ta on helpompi saada kalsinoimalla bariumnitraattia Ba (NO 3) 2:
2Ba (NO 3) 2 → 2BaO + 4NO 2 + O 2.
Sekä elektrolyysi että alumiinin pelkistys tuottavat pehmeän (kovempi kuin lyijy, mutta pehmeämpi kuin sinkki) kiiltävän valkoisen metallin. Se sulaa 710 °C:ssa, kiehuu 1638 °C:ssa, sen tiheys on 3,76 g/cm3. Kaikki tämä vastaa täysin bariumin asemaa maa-alkalimetallien alaryhmässä.
Bariumilla on seitsemän luonnollista isotooppia. Yleisin näistä on barium-138; se on yli 70 %.
Barium on erittäin aktiivinen. Se syttyy itsestään iskun vaikutuksesta, hajottaa helposti vettä muodostaen liukoisen bariumoksidihydraatin:
Ba + 2H 2O → Ba (OH) 2 + H2.
Bariumhydroksidin vesiliuosta kutsutaan bariittivedeksi. Tätä "vettä" käytetään analyyttisessä kemiassa CO 2:n määrittämiseen kaasuseoksissa. Mutta tämä on jo tarinasta bariumyhdisteiden käytöstä. Metallinen barium ei juuri löydä käytännön sovellusta. Erittäin pieninä määrinä sitä lisätään laakereihin ja painoseoksiin. Radioputkissa käytetään bariumin ja nikkelin seosta, puhdasta bariumia käytetään vain tyhjiötekniikassa sitojana (getterina).
Bariummetalli saadaan oksidista pelkistämällä alumiinia tyhjiössä 1200-1250°C:ssa:
4BaO + 2Al \u003d 3Ba + BaAl 2 O 4.
Barium puhdistetaan tyhjötislauksella tai vyöhykesulatuksella.
Bariumtitaanin valmistus. Sen saaminen on suhteellisen helppoa. Witherite BaCO 3 lämpötilassa 700 ... 800 ° C reagoi titaanidioksidin TYu 2 kanssa, mikä osoittautuu juuri tarvitsemasi:
BaCO 3 + TiO 2 → BaTiO 3 + CO 2.
Main tanssiaiset. menetelmä metallisen bariumin saamiseksi BaO:sta on sen pelkistys A1-jauheella: 4BaO + 2A1 -> 3Ba + BaO * A1 2 O 3. Prosessi suoritetaan reaktorissa 1100-1200°C:ssa Ar-atmosfäärissä tai tyhjiössä (jälkimmäinen menetelmä on edullinen). BaO:A1-moolisuhde on (1,5-2:1). Reaktori sijoitetaan uuniin siten, että sen "kylmän osan" lämpötila (muodostuneet bariumhöyryt tiivistyvät siihen) on noin 520 °C. Tyhjiötislaamalla barium puhdistetaan alle 10 ~ 4 epäpuhtauspitoisuuteen. paino-% ja vyöhykesulatusta käytettäessä - jopa 10 ~ 6%.
Pieniä määriä bariumia saadaan myös pelkistämällä BaBeO 2 [syntetisoituu fuusioimalla Ba (OH) 2 ja Be (OH) 2] 1300 °C:ssa titaanin kanssa sekä hajoamalla 120 °C:ssa Ba (N 3) 2, muodostuu bariumsuolojen p-kationien vaihdon aikana NaN 3:n kanssa.
Asetaatti Ba (OOCHN 3), - väritön. kiteet; sp. 490 °C (hajoaa); tiheä 2,47 g/cm3; sol. vedessä (58,8 g / 100 g 0 °C:ssa). Alle 25 °C:ssa trihydraatti kiteytyy vesiliuoksista, 25-41 °C:ssa - monohydraatti, yli 41 °C - vedetön suola. Hanki vuorovaikutusta. Ba (OH) 2, VaCO 3 tai BaS CH 3 CO 2 H:lla. Käytetään peittausaineena villan ja sintsin värjäyksessä.
Manganaatti(VI)BaMnO 4 - vihreät kiteet; ei hajoa 1000°C asti. Saatu kalsinoimalla Ba(NO 3) 2:n seos MnO 2:n kanssa. Pigmentti (kasselin tai mangaaninvihreä), jota käytetään yleisesti freskomaalauksessa.
Kromaatti (VI) ВаСrO 4 - keltaiset kiteet; sp. 1380 °C; - 1366,8 kJ/mol; sol. inorgissa. to-max, ei sol. vedessä. Hanki vuorovaikutusta. Ba (OH) 2:n tai BaS:n vesiliuokset alkalimetallikromaateilla (VI). Pigmentti (bariitinkeltainen) keramiikkaan. MPC 0,01 mg/m3 (Cro 3:na ilmaistuna). Pirkonaatti ВаZrО 3 - väritön. kiteet; sp. ~269°С; - 1762 kJ/mol; sol. vedessä ja alkalien ja NH 4 HCO 3:n vesiliuoksissa, hajotetaan vahvalla inorg. to-tami. Hanki vuorovaikutusta. ZrO 2 BaO:lla, Ba(OH) 2:lla tai BaCO 3:lla kuumennettaessa. Bazirkonaatti sekoitettuna ВаТiO 3 -pietsosähköiseen.
Bromidi BaBr 2 - valkoiset kiteet; sp. 847 °C; tiheä 4,79 g/cm3; -757 kJ/mol; no sol. vedessä, metanolissa, pahempaa - etanolissa. Vesiliuoksista dihydraatti kiteytyy muuttuen monohydraatiksi 75 °C:ssa vedettömäksi suolaksi - yli 100 °C:ssa. Vesiliuoksissa vuorovaikutus. ilman CO 2:n ja O 2:n kanssa muodostaen VaCO 3:a ja Br 2:ta. Hanki BaBr 2 -vuorovaikutus. vesipitoinen p-ditch Ba (OH) 2 tai VaCO 3 bromivetyhapon kanssa.
Jodidi BaI 2 - väritön. kiteet; sp. 740 °C (hajoaa); tiheä 5,15 g/cm3; . -607 kJ/mol; no sol. vedessä ja etanolissa. Kuumavesiliuoksista dihydraatti kiteytyy (dehydratoitu 150 °C:ssa), alle 30 °C - heksahydraatti. Hanki VaI 2 -vuorovaikutus. vesi p-oja Ba (OH) 2 tai VaCO 3 jodihapolla.
Bariumin fysikaaliset ominaisuudetBarium on hopeanvalkoinen muokattava metalli. Se katkeaa terävällä iskun vaikutuksella. Bariumilla on kaksi allotrooppista modifikaatiota: α-Ba, jossa on kuutiomainen kappalekeskeinen hila, on stabiili 375 °C:seen asti (parametri a = 0,501 nm), β-Ba on stabiili edellä.
Kovuus mineralogisella asteikolla 1,25; Mohsin asteikolla 2.
Bariummetalli varastoidaan kerosiinissa tai parafiinikerroksen alla.
Bariumin kemialliset ominaisuudetBarium on maa-alkalimetalli. Se hapettuu intensiivisesti ilmassa muodostaen bariumoksidia BaO ja bariumnitridiä Ba 3 N 2, ja syttyy hieman kuumennettaessa. Reagoi kiivaasti veden kanssa muodostaen bariumhydroksidia Ba (OH) 2:
Ba + 2H 2O \u003d Ba (OH) 2 + H 2
Aktiivisesti vuorovaikutuksessa laimennettujen happojen kanssa. Monet bariumsuolat ovat veteen liukenemattomia tai heikosti liukenevia: bariumsulfaatti BaSO 4, bariumsulfiitti BaSO 3, bariumkarbonaatti BaCO 3, bariumfosfaatti Ba 3 (PO 4) 2. Bariumsulfidi BaS, toisin kuin kalsiumsulfidi CaS, liukenee hyvin veteen.
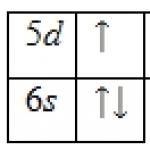
Luonnollinen bariumilla on seitsemän stabiilia isotooppia toukokuusta lähtien. kappaleet 130, 132, 134-137 ja 138 (71,66 %). Termisten neutronien sieppauksen poikkileikkaus on 1,17-10 28 m 2 . Ulkoinen konfigurointi elektronikuori 6s 2 ; hapetusaste + 2, harvoin + 1; ionisaatioenergia Ba° -> Ba + -> Ba 2+ vast. 5,21140 ja 10,0040 eV; Paulingin elektronegatiivisuus 0,9; atomisäde 0,221 nm, ionisäde Ba 2+ 0,149 nm (koordinaationumero 6).
Reagoi helposti halogeenien kanssa muodostaen halogenideja.
Vedyn kanssa kuumennettaessa se muodostaa bariumhydridiä BaH 2 , joka puolestaan muodostaa litiumhydridin LiH kanssa Li-kompleksin.
Reagoi kuumentuessaan ammoniakin kanssa:
6Ba + 2NH3 = 3BaH2 + Ba3N2
Bariumnitridi Ba 3 N 2 reagoi CO:n kanssa kuumennettaessa muodostaen syanidia:
Ba3N2 + 2CO = Ba(CN)2 + 2BaO
Nestemäisellä ammoniakilla se antaa tummansinisen liuoksen, josta voidaan eristää ammoniakkia, jolla on kultainen kiilto ja joka hajoaa helposti NH3:n eliminoituessa. Platinakatalyytin läsnä ollessa ammoniakki hajoaa muodostaen bariumamidia:
Ba (NH2)2 + 4NH3 + H2
Bariumkarbidia BaC 2 voidaan saada kuumentamalla BaO:ta hiilellä kaariuunissa.
Fosforin kanssa se muodostaa fosfidin Ba 3 P 2 .
Barium pelkistää monien metallien oksidit, halogenidit ja sulfidit vastaaviksi metalliksi.
Bariumin käyttöBariumin seos A1:n kanssa (alba-seos, 56 % Ba) on getterien (getterien) perusta. Itse getterin saamiseksi barium haihdutetaan lejeeringistä korkeataajuisella lämmityksellä laitteen tyhjennetyssä pullossa; bariumpeili (tai diffuusi pinnoite haihduttaessa typpiatmosfäärissä). Aktiivinen osa suurimmasta osasta termionisia katodeja on BaO. Bariumia käytetään myös Cu:n ja Pb:n hapettumisenestoaineena, kitkaa vähentävänä lisäaineena. metalliseokset, rauta- ja ei-rautametallit sekä seokset, joista tehdään typografisia fontteja niiden kovuuden lisäämiseksi. Ni-baariumseoksia käytetään sisäisten moottoreiden hehkutulppien elektrodien valmistukseen. poltto- ja radioputkissa. 140 Va (T 1/2 12,8 vrk) on isotooppi-indikaattori, jota käytetään bariumyhdisteiden tutkimuksessa.
Bariummetallia, usein seoksena alumiinin kanssa, käytetään sitojana korkeavakuumissa elektronisissa laitteissa.
KorroosionestomateriaaliBariumia lisätään yhdessä zirkoniumin kanssa nestemäisiin metallien jäähdytysnesteisiin (natriumin, kaliumin, rubidiumin, litiumin, cesiumin seokset) vähentämään jälkimmäisen aggressiivisuutta putkistoissa ja metallurgiassa.
Bariumfluoridia käytetään yksittäiskiteiden muodossa optiikassa (linssit, prismat).
Bariumperoksidia käytetään pyrotekniikassa ja hapettimena. Bariumnitraattia ja bariumkloraattia käytetään pyrotekniikassa liekkien värjäämiseen (vihreä tuli).
Bariumkromaattia käytetään vedyn ja hapen tuotannossa termokemiallisella menetelmällä (Oak Ridge -kierto, USA).
Bariumoksidia käytetään yhdessä kuparin ja harvinaisten maametallien oksidien kanssa suprajohtavan keramiikan syntetisoimiseen, joka toimii nestemäisen typen lämpötiloissa ja sitä korkeammissa lämpötiloissa.
Bariumoksidia käytetään erikoislasien sulattamiseen, jota käytetään uraanisauvojen päällystämiseen. Yhdellä tällaisten lasien yleisimmistä tyypeistä on seuraava koostumus - (fosforioksidi - 61%, BaO - 32%, alumiinioksidi - 1,5%, natriumoksidi - 5,5%). Ydinteollisuuden lasinvalmistuksessa käytetään myös bariumfosfaattia.
Bariumfluoridia käytetään kiinteässä olomuodossa olevissa fluoriakuissa fluoridielektrolyytin komponenttina.
Bariumoksidia käytetään tehokkaissa kuparioksidiakuissa aktiivisen massan komponenttina (bariumoksidi-kuparioksidi).
Bariumsulfaattia käytetään negatiivisen elektrodin aktiivisena massan laajentajana lyijyakkujen valmistuksessa.
Bariumkarbonaattia BaCO 3 lisätään lasimassaan lisäämään lasin taitekerrointa. Bariumsulfaattia käytetään paperiteollisuudessa täyteaineena; paperin laatu riippuu pitkälti sen painosta, bariitti BaSO 4 tekee paperista raskaampaa. Tämä suola sisältyy välttämättä kaikkiin kalliisiin paperilaatuihin. Lisäksi bariumsulfaattia käytetään laajalti valkoisen litoponimaalin valmistuksessa, joka on tuote bariumsulfidin liuosten reaktiosta sinkkisulfaatin kanssa:
BaS + ZnSO 4 → BaSO 4 + ZnS.
Molemmat suolat, joilla on valkoinen väri, saostuvat, puhdas vesi jää liuokseen.
Kun porataan syviä öljy- ja kaasukaivoja, porausnesteenä käytetään bariumsulfaatin suspensiota vedessä.
Toinen bariumsuolaa löytää tärkeitä käyttötarkoituksia. Tämä on bariumtitanaatti BaTiO 3 - yksi tärkeimmistä ferrosähköistä (ferrosähköiset polarisoituvat itsestään, ilman ulkoista kenttää. Eristeistä ne erottuvat samalla tavalla kuin ferromagneettiset materiaalit johtimien joukossa. Mahdollisuus tällaiseen polarisaatioon on Polarisoidut ferrosähköiset eroavat toisistaan korkeammalla dielektrisyysvakiolla), joita pidetään erittäin arvokkaina sähkömateriaaleina.
Vuonna 1944 tätä luokkaa täydennettiin bariumtitanaatilla, jonka ferrosähköiset ominaisuudet löysi Neuvostoliiton fyysikko B.M. Vulom. Bariumtitanaatin ominaisuus on, että se säilyttää ferrosähköiset ominaisuudet erittäin laajalla lämpötila-alueella - lähes absoluuttisesta nollasta +125 °C:seen.
Bariumia on käytetty myös lääketieteessä. Sen sulfaattisuolaa käytetään mahalaukun sairauksien diagnosoinnissa. BaSO 4 sekoitetaan veteen ja annetaan potilaan niellä. Bariumsulfaatti on läpinäkymätön röntgensäteille, ja siksi ne ruoansulatuskanavan osat, joiden läpi "bariumpuuro" kulkee, pysyvät näytöllä tummina. Joten lääkäri saa käsityksen mahalaukun ja suoliston muodosta, määrittää paikan, jossa haava voi esiintyä.
Bariumin vaikutus ihmiskehoon
Kehoon pääsyn reitit.
Barium pääsee pääasiallisesti ihmiskehoon ruoan kautta. Näin ollen jotkut meren asukkaat pystyvät keräämään bariumia ympäröivästä vedestä ja pitoisuuksina, jotka ovat 7-100 (ja joillakin meren kasveilla jopa 1000) kertaa suurempia kuin sen pitoisuus merivedessä. Jotkut kasvit (esim. soijapavut ja tomaatit) pystyvät myös keräämään bariumia maaperästä 2-20 kertaa. Kuitenkin alueilla, joilla bariumin pitoisuus vedessä on korkea, juomavesi voi myös vaikuttaa bariumin kokonaissaantiin. Bariumin saanti ilmasta on mitätön.
Terveysvaara.
WHO:n alaisuudessa tehdyissä tieteellisissä epidemiologisissa tutkimuksissa tietoja sydän- ja verisuonisairauksiin kuolleisuuden ja juomaveden bariumpitoisuuden välisestä suhteesta ei ole vahvistettu. Vapaaehtoisilla tehdyissä lyhytaikaisissa tutkimuksissa ei havaittu haitallisia vaikutuksia sydän- ja verisuonijärjestelmään bariumpitoisuuksilla 10 mg/l asti. Totta, rotilla tehdyissä kokeissa, kun jälkimmäinen kuluttivat vettä jopa pienellä bariumpitoisuudella, havaittiin systolisen verenpaineen nousu. Tämä viittaa mahdolliseen verenpaineen nousuun ihmisillä, jos bariumia sisältävää vettä käytetään pitkään (USEPAlla on tällaisia tietoja).
USEPA-tiedot viittaavat myös siihen, että jopa yksi juoma vettä, joka sisältää paljon enemmän kuin enimmäisbariumia, voi johtaa lihasheikkouteen ja vatsakipuihin. On kuitenkin otettava huomioon, että USEPA-laatustandardin asettama bariumstandardi (2,0 mg/l) ylittää merkittävästi WHO:n suositteleman arvon (0,7 mg/l). Venäjän terveysstandardit asettavat vielä tiukemman MPC-arvon bariumille vedessä - 0,1 mg/l. Vedenpoistotekniikat: ioninvaihto, käänteisosmoosi, elektrodialyysi.
Kemiallinen kaava BaSO 4 . Se on hajuton valkoinen jauhe, joka ei liukene veteen. Sen valkoisuus ja opasiteetti sekä suuri tiheys määrittelevät sen tärkeimmät sovellukset.
Nimihistoria
Barium kuuluu maa-alkalimetalleihin. Viimeksi mainitut on nimetty siksi, koska D. I. Mendelejevin mukaan niiden yhdisteet muodostavat maapallon liukenemattoman massan ja oksideilla "on maanläheinen ulkonäkö". Bariumia esiintyy luonnossa mineraalibariitin muodossa, joka on bariumsulfaattia, jossa on erilaisia epäpuhtauksia.
Ruotsalaiset kemistit Scheele ja Hahn löysivät sen ensimmäisen kerran vuonna 1774 osana niin kutsuttua raskasta sparraa. Sieltä tuli mineraalin nimi (kreikan sanasta "baris" - raskas) ja sitten itse metalli, kun Humphry Devi eristi sen puhtaassa muodossaan vuonna 1808.
Fyysiset ominaisuudet
Koska BaSO 4 on rikkihapon suola, sen fysikaaliset ominaisuudet määräytyvät osittain itse metallista, joka on pehmeä, reaktiivinen ja hopeanvalkoinen. Luonnollinen bariitti on väritöntä (joskus valkoista) ja läpinäkyvää. Kemiallisesti puhdas BaSO 4 on väriltään valkoisesta vaaleankeltaiseen, se on syttymätön, sulamispiste 1580°C.

Mikä on bariumsulfaatin massa? Sen moolimassa on 233,43 g/mol. Sillä on epätavallisen korkea ominaispaino - 4,25 - 4,50 g/cm 3 . Koska se ei liukene veteen, sen suuri tiheys tekee siitä välttämättömän vesipitoisten porausnesteiden täyteaineena.
Kemiallisia ominaisuuksia
BaSO 4 on yksi niukasti liukenevista yhdisteistä veteen. Sitä voidaan saada kahdesta erittäin liukoisesta suolasta. Ota natriumsulfaatin vesiliuos - Na 2 SO 4. Sen molekyyli hajoaa vedessä kolmeksi ioniksi: kahdeksi Na + ja yhdeksi SO 4 2- -ioniksi.
Na 2SO 4 → 2Na + + SO 4 2-

Otetaan myös bariumkloridin vesiliuos - BaCl 2, jonka molekyyli dissosioituu kolmeksi ioniksi: yhdeksi Ba 2+:ksi ja kahdeksi Cl - ioniksi.
BaCl 2 → Ba 2+ + 2Cl -
Sekoita sulfaatin vesiliuos ja kloridia sisältävä seos. Bariumsulfaatti muodostuu kahden samansuuruisen ja vastakkaisen varauksen omaavien ionien yhdistämisen seurauksena yhdeksi molekyyliksi.
Ba 2+ + SO 4 2- → BaSO 4
Alla näet tämän reaktion täydellisen yhtälön (ns. molekyyliyhtälö).
Na 2SO 4 + BaCl 2 → 2NaCl + BaSO 4

Tämän seurauksena muodostuu liukenematon bariumsulfaatin sakka.
Tavarabariitti
Käytännössä raaka-aine kaupallisen bariumsulfaatin valmistukseen, joka on tarkoitettu käytettäväksi porausnesteissä öljy- ja kaasukaivoja porattaessa, on pääsääntöisesti mineraalibariitti.
Termi "primaarinen" bariitti viittaa kaupallisiin tuotteisiin, jotka sisältävät raaka-ainetta (saatu kaivoksista ja louhoksista) sekä tuotteita, jotka on rikastettu yksinkertaisilla menetelmillä, kuten pesulla, laskeutuksella, erottelulla raskaissa väliaineissa, vaahdotuksella. Useimpien raakabariitin puhtaus ja tiheys on saatettava minimiin. Täyteaineena käytettävä mineraali murskataan ja siivilöidään tasakokoiseksi siten, että sen hiukkasista vähintään 97 % on kooltaan enintään 75 mikronia ja enintään 30 % alle 6 mikronia. Primääribariitin on myös oltava riittävän tiheää, jotta sen ominaispaino on 4,2 g/cm3 tai suurempi, mutta riittävän pehmeää, jotta se ei vahingoita laakereita.
Kemiallisesti puhtaan tuotteen saaminen
Mineraalibariitti on usein kontaminoitunut erilaisilla epäpuhtauksilla, pääasiassa rautaoksideilla, jotka värjäävät sen eri väreillä. Sitä käsitellään hiililämpöisesti (lämmitetään koksilla). Tuloksena on bariumsulfidia.
BaSO 4 + 4 C → BaS + 4 CO
Jälkimmäinen, toisin kuin sulfaatti, liukenee veteen ja reagoi helposti hapen, halogeenien ja happojen kanssa.
BaS + H 2 SO 4 → BaSO 4 + H 2 S
Rikkihappoa käytetään erittäin puhtaan lopputuotteen saamiseksi. Tällä prosessilla muodostunutta bariumsulfaattia kutsutaan usein blancfixiksi, joka tarkoittaa ranskaksi "valkoista kiinteää". Sitä löytyy usein kuluttajatuotteista, kuten maaleista.

Laboratorio-olosuhteissa bariumsulfaatti muodostuu yhdistämällä bariumioneja ja sulfaatti-ioneja liuoksessa (katso edellä). Koska sulfaatti on liukenemattomuutensa vuoksi vähiten myrkyllinen bariumin suola, muita bariumin suoloja sisältävät jätteet käsitellään joskus natriumsulfaatilla, jotta se sitoo kaiken bariumin, mikä on melko myrkyllistä.
Sulfaatista hydroksidiin ja takaisin
Bariittia on historiallisesti käytetty sokerinjalostuksessa tarvittavan bariumhydroksidin, Ba(OH) 2:n tuottamiseen. Tämä on yleensä erittäin mielenkiintoinen ja teollisuudessa laajalti käytetty yhdiste. Se liukenee hyvin veteen muodostaen liuoksen, joka tunnetaan nimellä bariittivesi. Sitä on kätevä käyttää sulfaatti-ionien sitomiseen erilaisissa koostumuksissa liukenemattoman BaS04:n muodostamisen kautta.
Näimme edellä, että kuumennettaessa koksin läsnäollessa on helppo saada vesiliukoista bariumsulfidia - BaS sulfaatista. Jälkimmäinen muodostaa hydroksidin vuorovaikutuksessa kuuman veden kanssa.
BaS + 2H 2O → Ba(OH) 2 + H2S
Liuoksissa otettu bariumhydroksidi ja natriumsulfaatti muodostavat sekoitettuna liukenemattoman bariumsulfaatin ja natriumhydroksidin sakan.
Ba(OH)2 + Na2S04 = BaSO 4 + 2NaOH

Osoittautuu, että luonnollinen bariumsulfaatti (bariitti) muunnetaan ensin teollisesti bariumhydroksidiksi, ja sitten se toimii saman sulfaatin saamiseksi puhdistettaessa erilaisia suolajärjestelmiä sulfaatti-ioneista. Samalla tavalla reaktio tapahtuu myös SO 4 2- -ionien puhdistuksen aikana kuparisulfaattiliuoksesta. Jos teet seoksen "bariumhydroksidi + kuparisulfaatti", tuloksena on kuparihydroksidi ja liukenematon bariumsulfaatti.
CuSO 4 + Ba(OH) 2 → Cu(OH) 2 + BaSO 4 ↓
Jopa reaktiossa itse rikkihapon kanssa sen sulfaatti-ionit sitoutuvat täysin bariumiin.
Käytä porausnesteissä
Noin 80 % maailman bariumsulfaatin, puhdistetun ja jauhetun bariitin, tuotannosta kulutetaan porausnesteiden komponenttina öljy- ja kaasukaivojen rakentamiseen. Sen lisääminen lisää kaivoon ruiskutetun nesteen tiheyttä vastustaakseen paremmin korkeaa säiliön painetta ja estääkseen tunkeutumisen.
Kun kaivoa porataan, terä kulkee erilaisten muodostumien läpi, joista jokaisella on omat ominaisuutensa. Mitä suurempi syvyys, sitä suurempi on bariitin prosenttiosuus liuoksen rakenteessa. Lisäetuna on se, että bariumsulfaatti on ei-magneettinen aine, joten se ei häiritse erilaisia porausreikien mittauksia elektronisilla laitteilla.
Maali- ja paperiteollisuus
Suurin osa synteettisestä BaSO 4:stä käytetään maalien valkoisen pigmentin komponenttina. Joten titaanidioksidiin (TiO 2) sekoitettua blancfixia myydään maalauksessa käytettävänä valkoisena öljymaalina.
BaSO 4:n ja ZnS:n (sinkkisulfidin) yhdistelmä tuottaa epäorgaanisen pigmentin nimeltä litoponi. Sitä käytetään tiettyjen valokuvapaperilaatujen pinnoitteena.
Viime aikoina bariumsulfaattia on käytetty mustesuihkutulostimiin tarkoitetun paperin kirkastamiseen.
Sovellukset kemianteollisuudessa ja ei-rautametallurgiassa
Polypropeenin ja polystyreenin valmistuksessa BaSO 4:a käytetään täyteaineena 70 %:iin asti. Se lisää muovien kestävyyttä happoja ja emäksiä vastaan sekä lisää niille opasiteettia.

Sitä käytetään myös muiden bariumyhdisteiden, erityisesti bariumkarbonaatin, valmistukseen, jota käytetään LED-lasien valmistukseen televisio- ja tietokonenäytöille (historiallisesti katodisädeputkissa).
Metallivalussa käytettävät muotit päällystetään usein bariumsulfaatilla estämään tarttumista sulaan metalliin. Tämä tehdään anodikuparilevyjen valmistuksessa. Ne valetaan kuparimuotteihin, jotka on päällystetty kerroksella bariumsulfaattia. Kun nestemäinen kupari jähmettyy valmiiksi anodilevyksi, se voidaan helposti poistaa muotista.
pyrotekniset laitteet
Koska bariumyhdisteet säteilevät vihreää valoa palaessaan, tämän aineen suoloja käytetään usein pyroteknisissä kaavoissa. Vaikka nitraatti ja kloraatti ovat yleisempiä kuin sulfaatti, jälkimmäistä käytetään laajalti pyroteknisten välkkyvien valojen komponenttina.
Röntgenvarjoaine
Bariumsulfaatti on säteilyä läpäisemätön aine, jota käytetään tiettyjen lääketieteellisten ongelmien diagnosoimiseen. Koska tällaiset aineet ovat läpinäkymättömiä röntgensäteille (estävät ne niiden suuren tiheyden vuoksi), kehon alueet, joissa ne sijaitsevat, näkyvät valkoisina alueina röntgenfilmillä. Tämä luo tarvittavan eron yhden (diagnosoidun) elimen ja muiden (ympäröivien) kudosten välillä. Kontrasti auttaa lääkäriä näkemään kyseisessä elimessä tai ruumiinosassa mahdollisesti esiintyvät erityisolosuhteet.

Bariumsulfaatti otetaan suun kautta tai peräsuolen kautta peräruiskeen avulla. Ensimmäisessä tapauksessa se tekee ruokatorven, mahalaukun tai ohutsuolen läpinäkymättömäksi röntgensäteille. Joten ne voidaan kuvata. Jos ainetta annetaan peräruiskeen kanssa, paksusuoli tai suolet voidaan nähdä ja kiinnittää röntgensäteillä.
Bariumsulfaatin annos on erilainen eri potilaille, kaikki riippuu testin tyypistä. Lääke on saatavana erityisen lääketieteellisen bariumsuspension muodossa tai tabletteina. Erilaiset kokeet, jotka vaativat kontrastia ja röntgenlaitteita, vaativat eri määriä suspensiota (joissain tapauksissa tarvitaan tablettimuotoista lääkettä). Varjoainetta tulee käyttää vain lääkärin suorassa valvonnassa.
BARIUMYHDISTEET, bariumin sijainnin mukaisesti Mendeleev-järjestelmän ryhmän II maa-alkaliryhmässä, niillä on kaksinkertaisesti varautunut ioni Ba ∙∙ (paitsi bariumperoksidi BaO 2). Bariumyhdisteille on ominaista korkea ominaispaino, värittömyys, jos anionit eivät ole värjätty, liekin vihreä väri ja pieni määrä monimutkaisia yhdisteitä. Teknisesti tärkeimmät ovat oksidi ja peroksidi, liukenemattomat suolat: bariumkarbonaatti, sulfaatti ja kromihappo sekä liukoiset suolat: bariumnitraatti, bariumkloridi jne. Bariumin liukenevat suolat ovat myrkyllisiä. Kvantitatiivisesti barium määritetään BaS04:n muodossa, mutta ottaen huomioon alhaisissa lämpötiloissa saatujen saostumien äärimmäisen hienouden, on välttämätöntä suorittaa saostus kiehuvasta liuoksesta, joka on hieman happamoitu kloorivetyhapolla. Jos liuoksessa on typpihappoa, osa sakasta menee liuokseen. Lisäksi BaSO 4 -sakka voi kuljettaa pois osan suoloista adsorption vuoksi. Erottaakseen strontiumista barium saostetaan BaSiF 6:na. Jos bariumyhdisteet ovat liukenemattomia, ne sulatetaan kaliumkarbonaatti-natriumin kanssa ja seoksen vedellä pesun jälkeen ne liuotetaan happoon. Bariumyhdisteitä löytyy yleisimmin mineraalibariittina; paljon harvinaisempi on witheriitti - bariumkarbonaatti.
Bariumoksidi BaO- valkoinen kiinteä aine, kiteytyy kuutioiksi, tiheys 5,72-5,32, sulamispiste 1580 °, muodostaa kiteisen hydraatin kaavan mukaan:
BaO + 9H 2 O \u003d Ba (OH) 2 ∙ 8H 2 O.
Bariumoksidi liukenee suhteellisen hyvin: 0° - 1,5 tuntia 100 tunnissa veteen; 10° - 2,2 tuntia, 15° - 2,89 tuntia, 20° - 3,48 tuntia, 50° - 11,75 tuntia, 80° - 90,77 tuntia Bariumoksidia saadaan bariumnitraatista kalsinoinnin avulla; tämä johtaa huokoiseen tuotteeseen, joka soveltuu peroksidin valmistukseen siitä. Kuumennus suoritetaan upokkaissa, muhveliuunissa, aluksi erittäin huolellisesti, jotta upokkaat eivät halkea. Typen oksidien vapautuminen alkaa 4 tunnin kuluttua, mutta niiden lopullista poistamista varten upokkaat poltetaan useita tunteja valkolämmöllä (typpihapon saamiseksi voidaan käyttää 30 % typen oksideja). Tuote on erittäin kallis, koska kallis: lähtöaine, upokkaat, jotka kelpaavat vain kerran, polttoaine jne. Bariumoksidin erottaminen witeriitistä (BaCO 3 \u003d BaO + CO 2) on paljon vaikeampaa kuin kalkin polttaminen, t to C02:n käänteinen lisäys tapahtuu erittäin helposti; siksi kivihiili sekoitetaan witheriittiin niin, että CO 2 siirtyy CO:ksi. Jos on toivottavaa saada huokoinen tuote, on välttämätöntä noudattaa tiukasti polttolämpötilaa. Sintraamisen estämiseksi lisätään usein bariumnitraattia, kivihiiltä, tervaa tai bariumkarbidia, ts.
ВаСО 3 + Ba(NO 3) 2 + 2С = 2ВаО + 2NO 2 + 3СО
ЗВаСО 3 + ВаС 2 = 4ВаО + 5СО.
Lisäksi tuote on suojattava mahdollisimman paljon sintrautumiselta upokkaan seinämien kanssa ja kuumien kaasujen vaikutukselta. Kuiluuuneissa tapahtuva kalsinointi antaa erittäin puhtaan tuotteen (95%), jos uuni on rakennettu korkealaatuisesta materiaalista ja lämmitys tapahtuu generaattorikaasulla, mikä mahdollistaa tarkan lämpötilan säädön. Italiassa käytetään lämmitystä sähköuuneissa, mutta ilmeisesti tämä tuottaa "oksikarbidia" ja "bariumia", jotka 80-85% bariumoksidin lisäksi sisältävät 10-12% karbidia ja 3-5% bariumsyanidia.
Vesipitoinen bariumoksidi, kaustinen bariitti Ba (OH) 2 , muodostaa läpinäkyviä monokliinisiä kiteitä
Va (OH) 2 ∙ 8H 2 0,
menettää viimeisen vesimolekyylin vain tummanpunaisessa lämmössä; vaaleanpunaisella lämmöllä saadaan BaO, ja ilmavirrassa hehkuvalla saadaan bariumperoksidia. Liuos emäksistä bariumia - vahvaa alkalia - imee hiilidioksidia ilmasta muodostaen liukenematonta CaCO 3:a. 100 g liuosta sisältää: 0 ° - 1,48 g BaO:ta, 10 ° - 2,17, 15 ° - 2,89, 20 ° - 3,36, 50 ° - 10,5, 80 ° - 4,76. Kaustista bariittia käytetään hiilidioksidin absorboimiseen, emästen erottamiseen sulfaatista, sokerin uuttamiseen melassista jne. Kaustista bariittia voidaan saada kalsinoimalla witheriittia vesihöyryn kautta, mutta BaCO 3:a on helpompi polttaa ja BaO:hen vaikuttaa vedellä; tai 60 % BaO:n ja 40 % BaS:n seos, joka saadaan kalsinoimalla BaSO 4 hiilellä, liuotetaan veteen ja Ba (OH) 2 saadaan paitsi BaO:sta, myös merkittävästä osasta BaS:ää hydrolyysin seurauksena:
2BaS + 2HOH = Ba(OH)2 + Ba(SH)2.
Kiteytynyt aine sisältää vain 1 % epäpuhtauksia. Vanhoja menetelmiä raudan tai sinkkioksidin lisäämiseksi BaS:ään ei enää käytetä. On myös ehdotettu, että emäksistä bariittia saadaan elektrolyysillä bariumkloridista tai bariumkloraatista ja perkloraatista BaC03-saostuman läsnä ollessa, jonka anodilla muodostunut happo liuottaa.
Bariumperoksidi BaO 2 - Pienimpien kiteiden valkoiset helmiäiset, hyvin heikosti veteen liukenevat (vain 0,168 tuntia 100 tunnissa vedessä). Peroksidin saamiseksi bariumoksidia kuumennetaan kaltevissa putkissa tai erityisissä muhveleissa, jotka voidaan pitää tarkasti halutussa lämpötilassa (500-600 °), ja sisään puhalletaan CO 2:sta ja kosteudesta puhdistettua ilmaa. Puhtain peroksidi saadaan BaO 2 ∙ 8H 2 O:n neliömäisten kiteiden muodossa, joita varten tekninen peroksidi trituroidaan ensin vedellä, siirretään liuokseen lisäämällä heikkoa kloorivetyhappoa ja saostetaan emäksisellä bariittiliuoksella tai yksinkertaisesti lisätään 10 kertaa enemmän 8 % bariittiliuosta. Puhtain peroksidi on harmahtavan vihertävä sintrattu massa, joka ei liukene veteen, mutta on vuorovaikutuksessa hiilihappoanhydridin kanssa. Kuumennettaessa BaO 2 hajoaa BaO:ksi ja hapeksi. Hapen kimmoisuus BaO 2:n yli 555 ° - 25 mm:ssä, 790 ° - 670 mm:ssä. Peroksidijauhe voi sytyttää kuitumateriaaleja. Myynnissä on: paras laatu - 90% BaO 2:lla ja keskiarvo - 80-85%, pääepäpuhtaus on BaO. BaO 2 -pitoisuus määritetään titraamalla BaO 2:n 1/10 N KMnO 4 -liuoksella erittäin heikolla kylmässä suolahapossa (ominaispaino 1,01-1,05), jossa on aiemmin saostettu barium-ioneja heikolla rikkihapolla. On myös mahdollista titrata kaliumjodidista eristetty bariumperoksidi natriumjodidisulfaatilla. Bariumperoksidia käytetään vetyperoksidin valmistukseen (ja samalla vahvemman "blancfixin" valkaisuun) ja desinfiointiaineiden valmistukseen.
Bariumnitriitti Ba (NO 2) 2 ∙ H 2 O - kuusikulmainen väritön kuusikulmainen prisma, sulamispiste 220°. 0 °:ssa 100 tunnissa veteen liukenee 58 tuntia, lämpötilassa 35 ° - 97 tuntia. Se saadaan lisäämällä natriumnitriittiliuosta (360 tuntia 96 % NaNO 2 1000 tunnissa vedessä) seokseen, jossa on 360 tuntia NaN02:ta ja 610 tuntia BaCl2:ta. Korkeassa lämpötilassa NaCl kiteytyy edelleen jäähtyessään - Ba (NO 2) 2.
Bariumnitraatti Ba (NO 3) 2 - värittömät läpinäkyvät oktaedrit, sulavat 375°:ssa; 100 tuntia vettä liukenee lämpötilassa 10 ° - 7 tuntia, 20 ° - 9,2 tuntia, 100 ° - 32,2 tuntia Kuumennettaessa se liukenee ensin bariumnitriitiksi ja sitten bariumoksidiksi. Sitä käytetään: 1) bariumperoksidin valmistukseen, 2) ilotulitteiden vihreisiin valoihin, 3) joihinkin räjähteisiin. Sitä tuotetaan: 1) vaihtohajoamalla, kun teoreettinen määrä natriumnitraattia lisätään kuumaan bariumkloridiliuokseen (30 °V) ja sen jälkeen uudelleenkiteytetään, 2) witeriitin tai bariumsulfidin vuorovaikutuksessa typpihapon kanssa, 3) kuumentamalla kalsiumnitraattia teknisellä bariumkarbonaatilla.
Bariumpermanganaatti - mangaanivihannekset, Kasselin vihreät, rosenstiel-vihreät. BaMnO 4 - kestävä vihreä maali, joka soveltuu freskomaalaukseen; saatu kalsinoimalla bariumyhdisteiden (emäksinen bariitti, bariumnitraatti tai bariumperoksidi) ja mangaanin (dioksidi tai oksidi) seosta.
Bariumsulfidi BaS - harmahtava huokoinen massa, helposti hapettuva ja vetää puoleensa hiilihappoanhydridiä ja vettä; hajoaa veden kanssa. Sitä käytetään useimpien bariumyhdisteiden valmistukseen (litopon, vahva kalkki jne.), sokerin uuttamiseen melassista ja villan leikkaamiseen vuodista (depilatorium). Kaivostoiminnassa he käyttävät raskaan hiilen ja hiilen seoksen kalsinointia 600-800 °:ssa:
BaS04 + 2C = 2CO 2 + BaS,
korkeammassa lämpötilassa tuhlataan kaksi kertaa enemmän hiiltä. Pääedellytys on hiilen ja hiilen tiivis kosketus, joka saavutetaan jauhamalla 30-37 % hiiltä ja vettä pyörivissä myllyissä. Uunit poltetaan kiertouuneissa, kuten sementin tai soodan valmistukseen käytettävissä uuneissa, joissa lyhyiden uunien takana on pölyinen kammio savun ja noen keräämiseksi. Tuloksena oleva tuote sisältää 60-70 % veteen liukenevia aineita, 20-25 % happoihin liukenevia aineita ja 5 % jäännöstä. Saatu tuote heitetään kuumana veteen tai 1-2-prosenttiseen NaOH-vesiliuokseen (36 °B), josta puolet menee vesipitoiseksi oksidiksi Ba (OH) 2 ja toinen rikkivetyksi Ba (SH) 2:ksi. Tätä liuosta käytetään suoraan bariumyhdisteiden valmistukseen (litoponi jne.) tai sokerin uuttamiseen. Kun jäännös reagoi kloorivetyhapon kanssa, saadaan bariumkloridia. Vanhoissa tehtaissa kalsinointi suoritetaan fireclay-retorteissa, jotka on tasaisesti peitetty liekillä. Hyvin kuivatut kivihiilen ja veteen sekoitettu laatat ladataan retortteihin. Heti kun palavan hiilimonoksidin liekit häviävät, levyt poistetaan niin, että ne putoavat hermeettisesti suljettuihin rautalaatikoihin.
Bariumsulfaatti BaS 2 O 3 ∙ H 2 O Se muodostuu bariumsulfidista: 1) ilman vapaa pääsy ja 2) vaihtohajoaminen natriumsulfaatin kanssa. Sitä käytetään tiitterien määrittämiseen jodometrian aikana.
Bariumsulfaatti BaSO 4 , raskas spar ("vahva", "mineraali", "uusi" jne. kalkki), puhtaan valkoinen, maanläheinen, erittäin raskas jauhe, käytännössä liukenematon veteen ja happoihin (liukoisuus: 18 ° 1 litrassa vettä - 2 . 3 mg). Luonnollinen jauhaa suoraan. Parhaat värittömät lajikkeet ovat nimeltään "kukka"; Ultramariinia lisätään kellertäväksi ja vaaleanpunaiseksi. Joskus raskas salpa jauhetaan ja kuumennetaan kloorivetyhapolla raudan poistamiseksi; tai sparva sulatetaan Na 2 SO 4:n kanssa ja erotetaan lejeeringistä veden vaikutuksesta. Keinotekoisesti sitä saadaan: 1) jätteenä vetyperoksidin valmistuksessa; 2) bariumkloridista vuorovaikutuksella: a) rikkihapon kanssa, joka antaa nopeasti saostuvan sakan, b) natriumsulfidin Na 2 SO 4:n tai magnesiumsulfidisuolan MgSO 4 kanssa, joka antaa hitaasti putoavan ja peittävän jauheen; tuotannon aikana on tärkeää puhdistaa rikkihappo puhtaaksi; 3) witeriitistä; jos se on erittäin puhdasta, se voidaan jauhaa suoraan H2S04:n vaikutuksesta, mutta lisäämällä 2 % HCl:a; jos witheriitti sisältää epäpuhtauksia, se liuotetaan ensin suolahappoon ja saostetaan sitten. Bariumsulfaattia käyttää Ch. arr. tapettien värjäämiseen väripaperille, pahville ja erityisesti valokuvapapereille, kevyille öljymaaleille ja hiilen lakkamaaleille, keinotekoisen norsunluun ja kumin valmistukseen, sekoitukseen vatsaan radiografian aikana syötettyyn ruokaan.
Bariumkarbonaatti BaCO 3 - mineraaliviteriitti (rombiset kiteet) tai keinotekoisesti saatu pienimmän sedimentin muodossa (ominaispaino 4.3); vaikeampi dissosioitua kalsinoinnin yhteydessä kuin CaC03; 1100°:ssa CO 2 -paine on vain 20 mm. Sitä käytetään muiden bariumyhdisteiden uuttamiseen, tiilien ja terrakotan, posliinin, keinomarmorin ja bariittikiteiden valmistukseen. Se valmistetaan keinotekoisesti: 1) bariumsulfidin raakaliuoksesta ruiskuttamalla hiilihappoanhydridiä; 2) lämmitetään bariumsulfaattia potaskan kanssa 5 atm:n paineessa; 3) bariumsakkaraattia hajottaessa hiilihappoanhydridillä.
Bariumasetaatti Ba (C 2 H 3 O 2) 2 ∙ H 2 O - värjäyksessä käytettävät helposti liukenevat kiteet; syntyvät natriumsulfidin tai -karbonaatin vuorovaikutuksesta etikkahapon kanssa.
Bariumfluoridi BaF 2 - valkoinen jauhe, liukenee heikosti veteen, sulaa 1280°:ssa, saatu liuottamalla bariumkarbonaattia tai emäksistä HF:ään tai keittämällä kryoliittia bariumoksidin vesiliuoksella.
Bariumkloridi l 2∙ 2Н 2O- värittömät litteät rombiset levyt (ominaispaino 3,05), stabiileja ilmassa, hapan makuisia, myrkyllisiä; kuumennettaessa on suhteellisen helppoa menettää ensimmäinen vesihiukkanen ja paljon vaikeampaa menettää toinen; vedetön BaCl 2 oikea. järjestelmä sulaa 962°:ssa. 100 tuntia liuosta sisältää vedetöntä suolaa:
ВаСl 2:ta käytetään "kestävän" valkoisen valmistukseen ja keraamisten tuotteiden sisältämän vitriolin muuntamiseen liukenemattomaksi BaSO 4:ksi; se uutetaan bariitista kalsinoimalla se hiilellä ja kalsiumkloridilla sooda-uuneissa 900-1000 °:ssa pelkistävässä liekissä, ja voidaan käyttää myös 70-prosenttista kalsiumkloridiliuosta, mutta kiinteä kalsiumkloridi on parempi:
BaSO 4 + 4C \u003d BaS + 4CO;
BaS + SaSl 2 \u003d SINÄl 2 + CaS.
Oikein valmistettuna saadaan lähes musta huokoinen tuote, jossa on 50-56 % BaCl2:ta. Systemaattisen uuton jälkeen suolaa kiteytetään (aiemmin hiilihappoanhydridisuihku johdetaan läpi), kunnes rikkivety on kokonaan poistettu ja haihdutettu sisältä lakatuissa astioissa. Kiteet erotetaan sentrifugoimalla. Jos vedetöntä BaCl2:ta tarvitaan, suolaa kuumennetaan astioissa sekoittimilla, jolloin saadaan hyvin pieniä kiteitä, jotka sitten kalsinoidaan ja saadaan 95 % BaCl2:ta. BaCl 2:ta on mahdollista saada lisäämällä BaS-jauhetta suolahappoon suljetuissa astioissa, joista vapautunut rikkivety on poistettava tehtaan putkeen tai poltettava rikkihapon avulla SO 2:ksi. Tietenkin on paljon edullisempaa toimia kloorivetyhapolla BaC03:n kanssa.
Bariumkloraatti Ba (C lO 3) 2 ∙ H 2O- Monokliiniset prismat, liukenevat hyvin kylmään ja vielä paremmin kuumaan veteen. Räjähtää helposti kuumennettaessa ja iskussa, jos se sekoitetaan palavan aineen kanssa. Sitä käytetään vihreiden liekkien pyrotekniikassa. Se valmistetaan elektrolyysillä 75°:ssa kyllästetystä BaCl 2 -liuoksesta platinaanodilla ja grafiittikatodilla.
BARIUM (latinalainen barium), Ba, jaksollisen järjestelmän lyhyen muodon ryhmän II (pitkän muodon ryhmä 2) kemiallinen alkuaine; viittaa maa-alkalimetalleihin; atomiluku 56, atomimassa 137,327. Luonnossa on 7 stabiilia nuklidia, joista 138 Ba vallitsee (71,7 %); noin 30 nuklidia saatiin keinotekoisesti.
Historiallinen viittaus. Bariumin oksidin muodossa löysi vuonna 1774 K. Scheele, joka löysi aiemmin tuntemattoman "maan", jota myöhemmin kutsuttiin "raskaaksi maaksi" - bariitiksi (kreikan kielestä βαρ?ς - raskas). Vuonna 1808 G. Davy sai metallista bariumia amalgaamin muodossa sulaiden suolojen elektrolyysillä.
Jakautuminen luonnossa. Bariumin pitoisuus maankuoressa on 5,10 -2 painoprosenttia. Korkean kemiallisen aktiivisuutensa vuoksi sitä ei esiinny vapaassa muodossa. Tärkeimmät mineraalit ovat bariitti BaSO 4 ja witheriitti BaSO 3 . Maailmanlaajuinen BaSO 4 -tuotanto on noin 6 miljoonaa tonnia vuodessa.
Ominaisuudet. Bariumatomin ulomman elektronikuoren konfiguraatio on 6s 2 ; yhdisteissä sen hapetusaste on +2, harvoin +1; Paulingin elektronegatiivisuus 0,89; atomisäde on 217,3 nm, Ba 2+ -ionin säde on 149 pm (koordinaationumero 6). Ionisaatioenergia Ba 0 → Ba + → Ba 2+ 502,8 ja 965,1 kJ / mol. Ba 2+ / Ba -parin standardielektrodipotentiaali vesiliuoksessa on -2,906 V.
Barium on hopeanvalkoinen muokattava metalli; t pl 729 °С, t ΚИΠ 1637 °С. Normaalissa paineessa bariumin kidehila on ruumiinkeskeinen kuutio; 19 °C:ssa ja 5530 MPa:ssa muodostuu kuusikulmainen modifikaatio. 293 K:ssa bariumin tiheys on 3594 kg/m 3, lämmönjohtavuus 18,4 W/(m·K), sähkövastus 5·10 -7 ohm·m. Barium on paramagneettinen; magneettinen ominaissusseptibiliteetti 1,9·10 -9 m 3 /kg.
Bariummetalli hapettuu nopeasti ilmassa; se varastoidaan kerosiinissa tai parafiinikerroksen alla. Barium reagoi tavallisessa lämpötilassa hapen kanssa muodostaen bariumoksidia BaO ja halogeenien kanssa muodostaen halogenideja. Kalsinoimalla BaO happi- tai ilmavirrassa 500 °C:ssa saadaan peroksidi BaO 2 (hajoaa BaO:ksi 800 °C:ssa). Reaktiot typen ja vedyn kanssa vaativat kuumennusta, reaktiotuotteet ovat Ba 3 N 2 -nitridi ja BaH 2 -hydridi. Barium reagoi vesihöyryn kanssa jopa kylmässä; liukenee voimakkaasti veteen, jolloin saadaan hydroksidia Ba (OH) 2, jolla on alkalien ominaisuuksia. Barium muodostaa suoloja laimeiden happojen kanssa. Yleisimmin käytetyistä veteen liukenevista bariumsuoloista: kloridi BaCl 2 ja muut halogenidit, nitraatti Ba (NO 3) 2, kloraatti Ba (ClO 3) 2, asetaatti Ba (OOCH 3) 2, sulfidi BaS; huonosti liukeneva - sulfaatti BaS0 4, karbonaatti BaCO 3, kromaatti BaCrO 4. Barium pelkistää monien metallien oksidit, halogenidit ja sulfidit vastaaviksi metalliksi. Barium muodostaa seoksia useimpien metallien kanssa, joskus seokset sisältävät metallien välisiä yhdisteitä. Siten BaAl, BaAl 2, BaAl 4 löydettiin Ba-Al-järjestelmästä.
Liukoiset bariumsuolat ovat myrkyllisiä; käytännöllisesti katsoen myrkytöntä BaSO 4 .
Kuitti. Bariumin valmistuksen pääraaka-aine on bariittirikaste (80-95 %) BaSO 4 , joka pelkistetään hiilellä, koksilla tai palavalla luonnonkaasulla; tuloksena oleva bariumsulfidi prosessoidaan tämän alkuaineen muiksi suoloiksi. Kalsinoimalla bariumyhdisteitä saadaan BaO:ta. Kaupallisesti puhdasta metallibariumia (96-98 paino-%) saadaan termisellä pelkistämällä BaO-oksidia Al-jauheella. Tyhjiötislaamalla barium puhdistetaan epäpuhtauspitoisuuteen alle 10-4%, vyöhykesulatuksella - jopa 10-6%. Toinen menetelmä bariumin saamiseksi BaO:sta on oksidisulan elektrolyysi. Pieniä määriä bariumia saadaan pelkistämällä beryllaatti BaBeO 2 1300 °C:ssa titaanilla.
Sovellus. Bariumia käytetään kuparin ja lyijyn hapettumisenestoaineena, kitkaa vähentävien metalliseosten, rauta- ja ei-rautametallien lisäaineena sekä typografisten kirjasimien valmistuksessa käytettävien metalliseosten kovuuden lisäämiseksi. Barium-nikkeliseoksia käytetään sytytystulppien elektrodien valmistukseen polttomoottoreissa ja radioputkissa. Bariumin seos alumiinin kanssa - alba, joka sisältää 56% Ba:ta, getterien perusta. Bariummetalli - materiaali kemiallisten virtalähteiden anodeihin. Useimpien termisten katodien aktiivinen osa on bariumoksidi. Bariumperoksidia käytetään hapettimena, valkaisuaineena, pyrotekniikassa; aiemmin sitä käytettiin hapen regenerointiin CO 2 :sta. Bariumheksaferriitti BaFe 12 O 19 on lupaava materiaali käytettäväksi tiedontallennuslaitteissa; BaFe 12 O 19:ää käytetään kestomagneettien valmistukseen. BaSO 4 lisätään porausnesteisiin öljyn ja kaasun tuotannon aikana. Bariumtitanaatti BaTiO 3 on yksi tärkeimmistä ferrosähköisistä aineista. Nuklidi 140 Va (β-emitteri, T 1/2 12,8 vrk) on isotooppimerkkiaine, jota käytetään bariumyhdisteiden tutkimiseen. Koska bariumyhdisteet imevät hyvin röntgensäteitä ja y-säteilyä, niitä lisätään röntgenlaitosten ja ydinreaktorien suojamateriaalien koostumukseen. BaSO 4:ää käytetään varjoaineena maha-suolikanavan röntgentutkimuksissa.
Lit. : Akhmetov TG Bariumyhdisteiden kemia ja tekniikka. M., 1974; Tretjakov Yu.D. jne. Epäorgaaninen kemia. M., 2001.
D. D. Zaitsev, Yu. D. Tretjakov.
Vuonna 1808 Davy Humphrey sai bariumia amalgaamin muodossa sen yhdisteiden elektrolyysillä.
Kuitti:
Luonnossa se muodostaa mineraaleja bariittia BaSO 4 :tä ja kuihtumista BaCO 3 . Saatu aluminotermialla tai atsidin hajottamalla:
3BaO+2Al=Al203+3Ba
Ba(N 3) 2 \u003d Ba + 3N 2
Fyysiset ominaisuudet:
Hopeanhohtoinen valkoinen metalli, jolla on korkeampi sulamis- ja kiehumispiste ja suurempi tiheys kuin alkalimetalleilla. Hyvin pehmeä. Tm = 727 °C.
Kemiallisia ominaisuuksia:
Barium on vahvin pelkistävä aine. Ilmassa se peittyy nopeasti oksidi-, peroksidi- ja bariumnitridikalvolla, syttyy kuumennettaessa tai yksinkertaisesti murskattaessa. Voimakkaasti vuorovaikutuksessa halogeenien kanssa, kun sitä kuumennetaan vedyn ja rikin kanssa.
Barium reagoi voimakkaasti veden ja happojen kanssa. Säilytä, kuten alkalimetallit, kerosiinissa.
Yhdisteissä sen hapetusaste on +2.
Tärkeimmät liitännät:
bariumoksidi. Kiinteä aine, joka reagoi voimakkaasti veden kanssa muodostaen hydroksidia. Imee hiilidioksidia ja muuttuu karbonaatiksi. Kuumennettaessa 500 °C:seen se reagoi hapen kanssa muodostaen peroksidia
bariumperoksidi BaO 2, valkoinen aine, huonosti liukeneva, hapettava aine. Käytetään pyrotekniikassa vetyperoksidin, valkaisuaineen valmistukseen.
bariumhydroksidi Ba(OH)2, Ba(OH)2-oktahydraatti *8H20, väritön. kristalli, alkali. Käytetään sulfaatti- ja karbonaatti-ionien havaitsemiseen, kasvi- ja eläinrasvojen puhdistamiseen.
bariumsuolat värittömiä kiteitä. aineet. Liukoiset suolat ovat erittäin myrkyllisiä.
Kloridi bariumia saadaan vuorovaikuttamalla bariumsulfaatti hiilen ja kalsiumkloridin kanssa 800 - 1100 °C:ssa. Reagenssi sulfaatti-ioneille. käytetään nahkateollisuudessa.
Nitraatti barium, bariumnitraatti, vihreiden pyroteknisten koostumusten komponentti. Kuumennettaessa se hajoaa muodostaen bariumoksidia.
Sulfaatti barium on käytännössä liukenematon veteen ja happoihin, joten se on lievästi myrkyllistä. käytetään paperin valkaisuun, fluoroskopiaan, bariittibetonitäyteaine (suoja radioaktiiviselta säteilyltä).
Sovellus:
Bariummetallia käytetään useiden metalliseosten komponenttina, hapettumisenestoaineena kuparin ja lyijyn tuotannossa. Liukoiset bariumsuolat ovat myrkyllisiä, MPC 0,5 mg/m 3 . Katso myös:
SI. Venetsky Harvinaisista ja hajallaan olevista. Metallitarinoita.