Lantaani (Lanthanum, La) on kemiallinen alkuaine numero 57 jaksollisessa taulukossa.
Erityinen paikka kemiallisten alkuaineiden joukossa on tällä "perheellä", jota yhdistää poikkeuksellinen ominaisuuksien samankaltaisuus. Niiden vanhentunut nimi on harvinaiset maametallit (REE). Kiinnostus niitä kohtaan kasvoi merkittävästi, kun ensimmäiset atomireaktorit käynnistettiin, joiden toiminnan aikana näitä alkuaineita muodostuu sivutuotteina.
Tämä elementti oli pitkään piilossa uteliailta kemistiltä, minkä vuoksi se sai nimen lantaani ("lantano" kreikaksi "piilotan", "piilotettu"). Sen löysi ruotsalainen kemisti Mozander vuonna 1839. Lantaani on ollut yli sadan vuoden ajan vaikeasti tavoitettavissa oleva alkuaine paitsi teollisuudessa, myös kemian laboratoriossa. Puhtaassa muodossaan lantaani (ja sen yhdisteet) saatiin vasta sen jälkeen, kun venäläisen tiedemiehen M. S. Tsvetin vuonna 1903 kehittämä niin kutsuttu kromatografinen analyysi tuli lujasti laboratorioiden ja teollisuusyritysten käytäntöön.
Tämän menetelmän olemus yleisimmillä termeillä on seuraava. Testiliuos johdetaan putken läpi, joka on täytetty värittömällä jauheella tai hienojakoisella aineella, joka pystyy pidättämään (adsorboimaan) pinnallaan muiden aineiden hiukkasia.
Seokseen sisältyvät aineet, riippuen niiden adsorptioasteesta absorboijan (adsorbentin) pinnalle, sijaitsevat sen korkeuden eri tasoilla putkessa (pylväs). Jos liuos koostuu värillisten aineiden seoksesta (MS Tsvet työskenteli tällaisten liuosten kanssa kerralla), ne jäävät niiden erilaisen adsorboituvuuden vuoksi adsorptioaineen eri osiin värjäämällä sen annettua ainetta vastaavaksi väriksi. .
Siten seoksen aineosat erotetaan. Adsorbentin massalla koko pituudeltaan putkessa, pidättyneen aineen värin mukaan, on eri värejä tai saman värin eri sävyjä (riippuen seoksen aineosien väreistä). Tuloksena olevaa värillisen adsorbentin pylvästä kutsutaan kromatogrammiksi (kreikan sanasta "kromi" - maali, väri ja "grafo" - kirjoitan). Seoksen komponenttien eristämiseksi adsorptiokolonni poistetaan varovasti putkesta ja jaetaan värivyöhykkeisiin. Kunkin värillisen vyöhykkeen koostumus määritetään tavanomaisilla kemiallisen analyysin menetelmillä. On aivan selvää, että analyysi ei aiheuta vaikeuksia, kun kullakin vyöhykkeellä on vain yksi aine. Useimmissa tapauksissa värillisen adsorbentin vyöhykkeet eivät kuitenkaan eroa toisistaan niin jyrkästi, että ne olisi helppo erottaa mekaanisesti. Yleensä vyöhykkeet yhdistetään ja siirtyvät vähitellen toisiinsa. Näissä tapauksissa adsorbenttia sisältävä putki ja siihen jääneet aineet pestään erityisesti valitulla liuottimella, joka liittyy eri tavalla seoksen adsorboituihin ainesosiin. Tätä menetelmää adsorboituneen aineen uuttamiseksi adsorptioaineesta kutsutaan eluutioksi (latinan sanasta "elutio" - pesu). Eluointi mahdollistaa paitsi seoksen aineosien adsorboivuuden, myös niiden liukoisuuden eron hyödyntämisen.
Lantaani ja sen yhdisteet ovat hyvin samankaltaisia useiden muiden lantaanin kanssa hyvin samankaltaisten alkuaineiden kanssa.
Lantaanin "sukulaisten" lukumäärä tunnetaan. Niitä on 14. Lantaanista, tutkituimpana, ne kaikki yhdistetään yhdeksi ryhmäksi, yhdeksi Mendeleev-järjestelmän soluksi lantanidiperheen nimellä.
Lantanidien kemiallisten ominaisuuksien suuri samankaltaisuus liittyy näiden alkuaineiden atomien elektronikuorten erityiseen rakenteeseen lantaanista lutetiumiin mukaan lukien. Tämä erityinen rakenne johtaa siihen, että kun elementin järjestysluku kasvaa, atomisäde ei kasva (lantanidipuristus). Tämä ilmiö selittää kaikkien lantanidien suuren kemiallisen samankaltaisuuden.
Sen jälkeen kun puhtaat lantaanisuolat eristettiin, itse lantaanin saaminen ei ollut enää vaikeaa. Esimerkiksi lantaanimetallia saatiin elektrolyysillä lantaanikloridista, joka kemialliselta käyttäytymiseltään muistuttaa kalsiummetallia. Lantaani on kovuudeltaan samanlainen kuin tina (tiheys 6,2), sen sulamispiste on vain 915-925°C, mutta kiehumispiste on yllättävän korkea (4515°C). Kuten monet aktiiviset metallit, se hajottaa vettä, reagoi hyvin happojen kanssa ja kuumennettaessa voimakkaasti kloorin, rikin ja muiden metalloidien kanssa, eli se osoittaa tyypillisen metallin ominaisuuksia.
Lantaani on "itsesuojaava" metalli: kuivassa ilmassa se on peitetty ohuella oksidikalvolla, joka suojaa sitä hapettumiselta. Mutta tällainen "suojaus" tapahtuu vain kuivassa ilmassa, kosteus yhdistyy tähän kalvoon ja muodostaa vahvan pohjan.
Olemme toistuvasti maininneet niin tärkeän metallin kuin alumiinin ja korostaneet erityisesti sen kykyä palaa suuren lämpömäärän vapautuessa. Monet erilaiset prosessit perustuvat tähän reaktioon. Lantaanissa yhdistelmän reaktiolämpö hapen kanssa on vielä suurempi. Heti kun he oppivat saamaan lantaania suuria määriä, se alkoi kilpailla alumiinin kanssa metallurgiassa. Hapen poistamiseksi nestemäisestä teräksestä siihen ei usein lisätä alumiinia, vaan lantaania. Terästonnia kohden tarvitaan vain yksi kilogramma tätä "hapetuksenpoistoainetta", kuten tekniikassa kutsutaan aineita, jotka vapauttavat teräksen hapesta. Tällä tavalla on jo käsitelty miljoonia tonneja terästä ja he sanovat, että tämä on erinomainen tapa parantaa sen laatua.
Lantaania saatiin seoksessa ceriumin kanssa, joka on toinen lantanidiperheen jäsen, noin 1:1 suhteessa. Sulattamalla näiden metallien seos raudan kanssa he saivat ... "piikiviä", jota käytettiin laajalti taskusytyttimissä. Tietenkin rauta-serium-lantaani "pivilla" ei ole mitään tekemistä luonnollisen piikiven - piiyhdisteen - kanssa. Tämä nimi annettiin metalliseokselle sen kyvystä "kimaltaa", kun siihen hierotaan rosoista teräspyörää. Tätä kykyä käytettiin paitsi vaarattomissa sytyttimissä, myös tykistökuorissa. Varustattuamme ammuksen suuttimella tästä "sekoitetallisesta metallista", saimme mahdollisuuden tarkkailla ammusta lennossa. "Mixed metal" kipinöitä lentäessään ilmassa. Tässä tapauksessa sytyttimen pyörän roolia hoitaa itse ilma, joka hankaa metallia vasten.
Lantaaniyhdisteitä käytetään lasin valmistuksessa parhaiden kameralinssien ja erikoissuojalasien valmistukseen. Magnesiumia sisältävässä seoksessa lantaania käytetään lentokoneiden moottorien osien valmistukseen.
On uteliasta, että tuttu mustikkakasvi on eräänlainen lantaanin "esiintymä", jonka tuhka sisältää jopa 0,17% lantaanioksidia. Alamittaisten karjalankoivujen tuhkassa on paljon lantaania.
MÄÄRITELMÄ
Lantaani sijaitsee jaksollisen järjestelmän pää- (A) alaryhmän III ryhmän kuudennessa jaksossa.
kuuluu perheeseen f-elementtejä. Metalli. Nimitys - La. Järjestysluku - 57. Suhteellinen atomimassa - 138,906 a.m.u. Lantaani on harvinainen maametalli. Kaikilla niillä on samanlainen rakenne, joten ne on erotettu erilliseksi alkuaineryhmäksi, jota kutsutaan lantanideiksi.
Lantaaniatomin elektroninen rakenne
Lantaaniatomi koostuu positiivisesti varautuneesta ytimestä (+57), jonka sisällä on 57 protonia ja 82 neutronia ja 57 elektronia liikkuu kuudella kiertoradalla.
Kuva 1. Lantaaniatomin kaavamainen rakenne.
Elektronien jakautuminen kiertoradalla on seuraava:
57La) 2) 8) 18) 18) 9) 2;
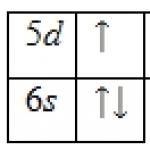
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 0 5s 2 5p 6 5d 1 6s 2 .
Lantaaniatomin ulkoinen energiataso sisältää 3 elektronia, jotka ovat valenssia. Perustilan energiakaavio on seuraavanlainen:

Lantaaniatomin valenssielektroneja voidaan luonnehtia neljän kvanttiluvun joukolla: n(pääkvantti), l(kiertorata), m l(magneettinen) ja s(pyörittää):
|
alataso |
||||
Esimerkkejä ongelmanratkaisusta
ESIMERKKI 1
Merkittävin asia elementissä #57 on epäilemättä se, että se johtaa 14 lantanidin joukossa - elementtejä, joilla on erittäin samanlaiset ominaisuudet. Lantaani ja lantanidit ovat aina yhdessä: mineraaleissa, ymmärtääksemme, metallissa. Pariisin maailmannäyttelyssä vuonna 1900 esiteltiin ensimmäistä kertaa näytteitä joistakin oletettavasti puhtaista lantanideista. Mutta ei ole epäilystäkään siitä, että jokaisessa näytteessä, etiketistä riippumatta, oli lantaania, ceriumia, neodyymiä praseodyymin kanssa ja harvinaisimpia lantanideja - tuliumia, holmiumia, lutetiumia. Harvinaisin, paitsi "sukupuuttoon kuollut" ja ydinreaktioissa uudelleen luotu alkuaine nro 61 - prometium. Jos prometiumilla olisi kuitenkin stabiileja isotooppeja, sitä olisi myös missä tahansa harvinaisen maametallin näytteessä.
Vasta viime vuosikymmeninä tieteen ja teknologian kehitys on saavuttanut tason, jolla ihmiskunta on voinut asettaa palvelukseensa jokaisen (tai lähes jokaisen) lantanidien yksilölliset ominaisuudet, vaikkakin, kuten ennenkin, yksi suosituimmista ja suosituimmista edullisimmat harvinaisten maametallien tuotteet pysyvät sekametallina - lantaanin ja lantanidien "luonnollisena metalliseoksena"... Siksi olisi loogista omistaa vain puolet tästä tarinasta suoraan elementille nro 57 ja toinen puoli harvinaisten maametallien "tiimille" kokonainen *. Tietenkin jokainen lantanideista - kemiallisena yksilönä - ansaitsee itsenäisen tarinan; täällä - heidän "johtajastaan" ja siitä, mikä on yhteistä heille kaikille.
* Lantaanin ja lantanidien lisäksi harvinaisia maametallien alkuaineita ovat skandium ja yttrium.
Lantaani ilman lantanideja
Ei ole väliä kuinka surullista sen tajuaminen on, tarinamme sankari on täysin tavallinen ihminen. Tämä on tavallinen metalli ulkonäöltään (hopeavalkoinen, peitetty harmahtavalla oksidikalvolla) ja fysikaalisista ominaisuuksista: sulamispiste 920, kiehumispiste 3469 °C; Lujuuden, kovuuden, sähkönjohtavuuden ja muiden ominaisuuksien osalta lantaanimetalli päätyy aina taulukoiden keskelle. Lantaani on myös yleinen kemiallisissa ominaisuuksissa. Kuivassa ilmassa se ei muutu - oksidikalvo suojaa luotettavasti hapettumiselta irtotavarana. Mutta jos ilma on kosteaa (ja tavallisissa maanpäällisissä olosuhteissa se on lähes aina kosteaa), metallilantaani hapettuu vähitellen hydroksidiksi. La(OH)3 on keskivahva emäs, mikä on jälleen tyypillistä "keskimetallille".
Mitä muuta voidaan sanoa lantaanin kemiallisista ominaisuuksista? Hapessa, kun se kuumennetaan 450 ° C:seen, se palaa kirkkaalla liekillä (tässä tapauksessa vapautuu melko paljon lämpöä). Jos se kalsinoidaan typpiatmosfäärissä, muodostuu mustaa nitridia. Kloorissa lantaani syttyy huoneenlämpötilassa, kun taas se reagoi bromin ja jodin kanssa vain kuumennettaessa. Se liukenee hyvin mineraalihappoihin, ei reagoi alkaliliuosten kanssa. Kaikissa yhdisteissä lantaanin valenssi on 3+. Sanalla sanoen metalli on kuin metalli - sekä fysikaalisten että kemiallisten ominaisuuksien suhteen.
Ehkä ainoa lantaanin erottava piirre on sen vuorovaikutuksen luonne vedyn kanssa. Niiden välinen reaktio alkaa jo huoneenlämpötilassa ja jatkuu lämmön vapautuessa. Muodostuu vaihtelevan koostumuksen hydridejä, koska samalla lantaani imee vetyä - mitä intensiivisemmin, sitä korkeampi lämpötila.
Lantanidit ovat myös vuorovaikutuksessa vedyn kanssa. Yhtä niistä, ceriumia, käytetään jopa kaasun absorboijana sähkötyhjiöteollisuudessa ja metallurgiassa.
Tässä päästään yhteen tarinamme tärkeistä osista, aiheeseen "Lantaani ja cerium", ja sen yhteydessä - lantaanin historiaan.
Lantaani on luonnossa esiintyvyyden, tuotannon mittakaavan ja käyttölaajuuden osalta huonompi kuin lähin analoginsa, ensimmäinen lantanideista. "Esi-isä" ja - ikuisesti toinen, sellainen on lantaanin asema hänen perheessään. Ja kun harvinaiset maametallit jaettiin kahteen alaryhmään niiden ominaisuuksien kokonaisuuden mukaan, lantaani sijoitettiin alaryhmään, jonka nimi annettiin ceriumin kunniaksi... Ja lantaani löydettiin ceriumin jälkeen, seoksena seriumiin, vuonna mineraali seriitti. Tämä on tarina, opettajien ja oppilaiden tarina.
Vuonna 1803 24-vuotias ruotsalainen kemisti Jene Jacob Berzelius tutki yhdessä opettajansa Hisingerin kanssa mineraalia, joka tunnetaan nykyään seriittinä. Gadolin löysi tämän mineraalin vuonna 1794, yttriummaa ja toinen harvinainen maa, joka on hyvin samanlainen kuin yttrium. He kutsuivat sitä ceriumiksi. Melkein samanaikaisesti Berzeliuksen kanssa kuuluisa saksalainen kemisti Martin Klaproth löysi ceriummaan.
Berzelius palasi työskentelemään tämän aineen parissa monta vuotta myöhemmin, jo arvostettu tiedemies. Vuonna 1826 Karl Mozander, opiskelija, assistentti ja yksi Berzeliuksen läheisistä ystävistä, tutki ceriummaata ja totesi sen olevan heterogeeninen, että se sisältää ceriumin lisäksi vielä yhden ja ehkä useammankin uuden alkuaineen. Mutta tämän oletuksen testaamiseksi tarvittiin paljon seriittiä. Mozander onnistui todistamaan ceriummaan monimutkaisuuden vasta vuonna 1839.
Mielenkiintoista on, että vuotta aiemmin kemistien keskuudessa tuntematon opiskelija Erdmann löysi Norjasta uuden mineraalin ja nimesi sen opettajansa Mozanderin mukaan - mosanderiitti. Tästä mineraalista eristettiin myös kaksi harvinaista maametallia, cerium ja nova.
Ceriitistä ja mosanderiitista löydetty uusi alkuaine nimettiin lantaaniksi Berzeliuksen ehdotuksesta. Nimi vihjeellä: se tulee kreikan sanasta λανθανειν - piiloutua, unohdettu. Seriitin sisältämä lantaani on onnistuneesti piilotettu kemistiltä 36 vuoden ajan!
Pitkään uskottiin, että lantaani on kaksiarvoinen, että se on kalsiumin ja muiden maa-alkalimetallien analogi ja sen atomipaino on 90...94. Näiden lukujen oikeellisuudesta ei ollut epäilystäkään vuoteen 1869 asti. Mendelejev näki, että jaksollisen järjestelmän ryhmässä II ei ollut sijaa harvinaisten maametallien alkuaineille ja laittoi ne ryhmään III ja katsoi lantaanin atomipainon 138...139. Mutta tällaisen liikkeen oikeutus oli vielä todistettava. Mendelejev tutki lantaanin lämpökapasiteettia. Hänen saamansa arvo osoitti suoraan, että tämän elementin on oltava kolmiarvoinen ...
Metallisen lantaanin, luonnollisesti kaukana puhtaasta, hankittiin ensin Mosander kuumentamalla lantaanikloridia kaliumilla.
Nykyään teollisessa mittakaavassa lantaanin puhtaus on yli 99 %. Seuraamme kuinka tämä tehdään, mutta ensin tutustumme lantaanin tärkeimpiin mineraaleihin ja monimutkaisimman harvinaisten maametallien erottamisprosessin ensimmäisiin vaiheisiin.
On jo mainittu, että mineraaleissa lantaani ja lantanidit seuraavat aina toisiaan. On selektiivisiä mineraaleja, joissa yhden tai toisen harvinaisen maametallin osuus on tavallista suurempi. Mutta ei ole olemassa puhtaasti lantaania tai puhtaasti ceriummineraaleja, muista lantanideista puhumattakaan. Esimerkki valikoivasta lantaanimineraalista on davidiitti, jossa jopa 8,3 % La 2 O 3 ja vain 1,3 % ceriumoksidia. Mutta lantaania saadaan pääasiassa monatsiitista ja bastnäsiitistä sekä ceriumista ja kaikista muista cerium-alaryhmän alkuaineista.
Monatsiitti on raskas, kiiltävä mineraali, yleensä kellanruskea, mutta joskus muita värejä, koska se ei eroa koostumuksensa pysyvyydestä. Tarkemmin sen koostumusta kuvaa tällainen outo kaava: (REE)PO 4 . Se tarkoittaa, että monatsiitti on harvinaisten maametallien fosfaatti (REE). Yleensä monatsiitti sisältää 50...68 % REE-oksideja ja 22...31,5 % P 2 O 5 . Ja se sisältää myös jopa 7 % zirkoniumdioksidia, 10 % (keskimäärin) toriumdioksidia ja 0,1...0,3 % uraania. Nämä luvut osoittavat selvästi, miksi harvinaisten maametallien ja ydinteollisuuden polut ovat niin tiiviisti kietoutuneet toisiinsa.
Harvinaisten maametallien sekametalli - mischmetal - ja niiden oksidien seos otettiin käyttöön viime vuosisadan lopulla, ja tämän vuosisadan alussa niiden yhteydessä esiteltiin erinomainen esimerkki kansainvälisestä varkaudesta. Saksalaiset alukset, jotka toimittivat rahtia Brasiliaan, täyttivät ruumat hiekalla tämän maan Atlantin rannikon rannoilta ja tietyistä paikoista. Kapteenit väittivät, että hiekka oli vain painolastia, jota tarvittiin laivan vakauttamiseksi. Todellisuudessa he varastivat saksalaisten teollisuusmiesten tilauksia täyttäessään arvokkaita mineraaliraaka-aineita - Espirito Santon osavaltion rannikkohiekkaa, jossa on runsaasti monatsiittia ...
Monatsiittia levitetään jokien, järvien ja merien rannoille kaikilla mantereilla. Vuosisadan alussa (tiedot vuodelta 1909) 92 % maailman harvinaisten maametallien raaka-aineiden ja pääasiassa monatsiittituotannosta tuli Brasiliaan. Kymmenen vuotta myöhemmin painopiste on siirtynyt tuhansia kilometrejä itään (tai länteen, riippuen kuinka lasket) - Intiaan. Vuoden 1950 jälkeen Yhdysvalloista tuli ydinteollisuuden kehityksen yhteydessä kapitalististen maiden hegemoni harvinaisten maametallien raaka-aineiden louhinnassa ja käsittelyssä.
Tietysti maamme ja muiden sosialistisen yhteisön maiden oli kehitettävä oma harvinaisten maametallien teollisuus ja löydettävä omat raaka-aineet.
Seuratkaamme yleisesti polkua monatsiittihiekasta lantaaniin.
Vaikka hiekkaa kutsutaan monatsiittiksi, siinä ei ole paljon monatsiittia - prosentin murto-osa. Esimerkiksi Idahon (USA) tunnetuissa monatsiittisijoituksissa tonni hiekkaa sisältää vain 330 g monatsiittia. Siksi ensinnäkin saadaan monatsiittikonsentraatti.
Ensimmäinen keskittymisvaihe tapahtuu jo ruoppaamalla. Monatsiitin tiheys on 4,9 ... 5,3 ja tavallisen hiekan - keskimäärin 2,7 g / cm 3. Tällaisella painoerolla gravitaatioerottaminen ei ole vaikeaa. Mutta monatsiitin lisäksi samoissa hiekoissa on muita raskaita mineraaleja. Siksi monatsiittikonsentraatin saamiseksi, jonka puhtaus on 92...96 %, käytetään kompleksia gravitaatio-, magneetti- ja sähköstaattisia rikastusmenetelmiä. Tämän seurauksena matkan varrella saadaan ilmeniittiä, rutiilia, zirkonia ja muita arvokkaita rikasteita.
Kuten mikä tahansa mineraali, monatsiitti on "avattava". Useimmiten monatsiittikonsentraattia käsitellään tätä varten väkevällä rikkihapolla *. Syntyvät harvinaisten maametallien sulfaatit ja torium liuotetaan puhtaalla vedellä. Liukenemisen jälkeen piidioksidi ja osa zirkonista, joka ei eronnut edellisissä vaiheissa, jää sedimenttiin.
* Alkalinen menetelmä monatsiitin avaamiseksi on myös yleinen.
Seuraavassa erotusvaiheessa uutetaan lyhytikäinen mesotorium (radium-228) ja sitten itse torium, joskus yhdessä ceriumin kanssa, joskus erikseen. Ceriumin erottaminen lantaanista ja lantanidien seoksesta ei ole erityisen vaikeaa: päinvastoin kuin ne, se pystyy osoittamaan 4+ valenssia ja saostumaan Ce(OH) 4 -hydroksidin muodossa, kun taas sen kolmiarvoiset analogit jäävät liuokseen . Huomaamme vain, että ceriumin erottaminen, samoin kuin aiemmat, suoritetaan toistuvasti - kalliin harvinaisen maametallin rikasteen "puristamiseksi" mahdollisimman täydellisesti.
Ceriumin eristämisen jälkeen liuos sisältää eniten lantaania (La(NO 3) 3 -nitraatin muodossa, koska yhdessä välivaiheessa rikkihappo korvattiin typpihapolla lisäerotuksen helpottamiseksi). Tästä liuoksesta saadaan lantaania lisäämällä ammoniakkia, ammonium- ja kadmiumnitraatteja. Cd(NO 3) 2:n läsnä ollessa erottuminen on täydellisempää. Näiden aineiden avulla kaikki lantanidit siirtyvät sakkaan, kun taas suodokseen jää vain kadmium ja lantaani. Kadmium saostetaan rikkivedyllä, sakka erotetaan ja lantaaninitraattiliuos puhdistetaan vielä useita kertoja fraktiokiteytyksellä lantanidiepäpuhtauksista.
Lopulta yleensä saadaan lantaanikloridi LaCl3. Sulan kloridin elektrolyysi tuottaa lantaanin puhtaana jopa 99,5 %. Vielä enemmän puhdasta lantaania (99,79 % ja enemmän) saadaan kalsiumlämpömenetelmällä. Tämä on klassinen perinteinen tekniikka.
Kuten näet, alkuainelantaanin saaminen on monimutkainen asia.
Lantanidien erottaminen - praseodyymistä lutetiumiin - vaatii vielä enemmän vaivaa ja rahaa ja tietysti aikaa. Siksi kemistit ja teknikot monissa maailman maissa ovat viime vuosikymmeninä pyrkineet luomaan uusia, edistyneempiä menetelmiä näiden alkuaineiden erottamiseksi. Tällaisia menetelmiä - uutto ja ioninvaihto - luotiin ja otettiin käyttöön teollisuudessa. Jo 1960-luvun alussa ioninvaihtoperiaatteella toimivat laitokset saavuttivat 95 % harvinaisten maametallien tuoton puhtaudeltaan jopa 99,9 %.
Vuoteen 1965 mennessä maamme ulkomaankaupan järjestöt saattoivat tarjota ostajille kaikki lantanidit metallien muodossa, joiden puhtaus oli yli 99%. Prometiumin lisäksi tietysti, vaikka tämän alkuaineen radioaktiiviset valmisteet - uraanin ydinhajoamistuotteet - ovat myös tulleet melko saataville.
Techsnabexportin luettelot sisälsivät myös noin 300 kemiallisesti puhdasta ja erittäin puhdasta lantaanin ja lantanidien yhdistettä. Tämä on todiste Neuvostoliiton harvinaisten maametallien teollisuuden korkeasta kehitystasosta.
Mutta takaisin lantaaniin.
Lyhyesti lantaanin ja sen yhdisteiden käytöstä
Puhdasta lantaania ei juuri koskaan käytetä seosmetallina, vaan tähän käytetään halvempaa ja helpompaa ceriumia tai mischmetallia - lantaanin ja lantanidien seosvaikutus on lähes sama.
Edellä mainittiin, että joskus lantaani uutetaan seoksesta uuttamalla käyttämällä joidenkin harvinaisten maametallien (enimmäkseen monimutkaisten) yhdisteiden erilaista liukoisuutta orgaanisiin liuottimiin. Mutta tapahtuu, että itse elementtiä nro 57 käytetään uuttoaineena. Sulaa lantaania käytetään plutoniumin erottamiseen nestemäisestä uraanista. Tässä on toinen kosketuspiste ydin- ja harvinaisten maametallien teollisuuden välillä.
Lantaanioksidia La 2 O 3 käytetään paljon laajemmin. Tästä valkoisesta amorfisesta jauheesta, joka ei liukene veteen, mutta liukenee happoihin, on tullut tärkeä komponentti optisissa laseissa. Kuuluisan Kodak-yhtiön valokuvalinssit sisältävät 20 - 40 % La 2 O 3 . Lantaanin lisäyksen ansiosta oli mahdollista pienentää objektiivin kokoa samalla aukolla ja parantaa huomattavasti värikuvauksen laatua. Tiedetään, että toisen maailmansodan aikana lantaanilaseja käytettiin kenttäoptisissa instrumenteissa. Parhaat kotimaiset valokuvausobjektiivit, esimerkiksi Industar-61LZ, ovat myös lantaanilasista, ja yksi parhaista amatöörielokuvakameroistamme on Lanthanum... Lantaanilasia on viime aikoina käytetty myös laboratoriolasien valmistukseen. Lantaanioksidi antaa lasille paitsi arvokkaita optisia ominaisuuksia, myös paremman lämmön- ja haponkestävyyden.
Se on ehkä tärkein asia, joka voidaan sanoa lantaanista ilman lantanideja, vaikka joissain paikoissa oli mahdotonta olla poikkeamatta "ilman" -periaatteesta ...
Lanthan ja hänen tiiminsä
Lantaanin ja lantanidien vertaaminen urheilujoukkueeseen saattaa joillekin tuntua kaukaa haetulta. Tämä vertailu ei kuitenkaan ole sen myrskyisempi kuin sellaiset hyvin tunnetut määritelmät kuin "lantanidiperhe" tai "kemialliset kaksoset". Tuomari itse: lantaanilla ja hänen tiimillään on yksi univormu (hopeavalkoinen) ja jääkiekkopelaajien tapaan heillä kaikilla on suojaammuksia (oksidikalvoista). Kaikki vapautuvat luonnosta suunnilleen yhtä paljon (samankaltaisuus on äärimmäisen suuri), mutta kuten urheilussa, eri syistä "kyvyt" toteutuvat eri tavalla: toiset "pelaavat" paremmin, toiset huonommin... Tietenkin jokainen tämän jäsen käskee suosikki "temppujaan" - esimerkiksi gadoliniumin ferromagnetismia.
Ja kemiallisten ominaisuuksien suhteen lantanidit eivät vieläkään ole kaksoset - muuten niitä ei olisi mahdollista erottaa. Kuten hyvässä urheilujoukkueessa, he ovat yhtenäisiä pääpiirteissään ja erityisesti yksilöllisesti. Osallistujamäärän osalta pelaajien määrä eri peleissä on erilainen, 14 on normaalin rajoissa...
Totta, oli aika, jolloin tähän "tiimiin" suositeltiin lähes viittäkymmentä ehdokasta. Löydettyjen lantaanin kaltaisten alkuaineiden määrä kasvoi katastrofaalista vauhtia. Teoksen on koonnut professori N.A. Figurovin luettelo väärin löydetyistä alkuaineista sisältää eniten vääriä lantanideja. Jopa suuret tiedemiehet eivät välttäneet virheitä - Mozander, Lecoq de Boisbaudran, Auer von Welsbach, Crookes, Urbain.
Lantaanin ja sen tiimin ominaisuuksien epäjaksoisuus, joka putoaa jaksollisen järjestelmän tiukasta järjestyksestä, aiheutti Mendelejeville ongelmia. Mutta ajan myötä kaikki ratkesi. Se oli Prahan yliopiston professori Bohuslav Frantsevich Brauner, joka ehdotti ensimmäisenä lantanidien poistamista pöydän pääosasta.
"Sinun täytyy olla "harvinaisten maametallien" asiantuntija kuin B.F. Brauner, ymmärtääkseen tätä monimutkaista, vaikeaa ja vielä tuskin loppuun suoritettua aihetta, jonka tarkistaminen on vaikeaa paitsi monien alkusuhteiden omaperäisyyden ja samankaltaisuuden vuoksi, myös itse luonnonmateriaalin saamisen vaikeuksien vuoksi, Mendelejev kirjoitti 1902.
"Mitä tulee harvinaisten maametallien alkuaineiden systematiikkaan ja niiden paikkaan jaksollisessa taulukossa, niin nyt on turvallista olettaa, että skandium, yttrium ja lantaani ovat ryhmän III parillisilla riveillä, mikä seuraa niiden atomipainoista ja tilavuudesta. niiden oksideista ... Muut harvinaisten maametallien alkuaineet muodostavat luultavasti jaksojen välisen ryhmän tai solmun järjestelmässä, jossa ne seuraavat toisiaan atomipainojen suhteen. Nämä ovat Braunerin sanat artikkelista "Elements of Rare Earths", joka on kirjoitettu Mendelejevin kemian perusteiden toiseksi viimeistä (1903) elinikäistä painosta varten.
"Järjestelmän solmu" oli vihdoin mahdollista purkaa vasta sen jälkeen, kun jaksollisen taulukon perustalle asetettiin uusi, fyysisesti tarkempi kriteeri - atomin ytimen varaus. Sitten kävi selväksi, että vain 15 alkuainetta mahtui lantaanin ja tantaalin väliin, ja jälkimmäisen pitäisi olla zirkoniumin analogi. Coster ja Hevosi löysivät tämän alkuaineen, hafniumin, vuonna 1923.
Viimeinen (atomiluvun mukaan) lantanidi, lutetium, löydettiin aiemmin, vuonna 1907.
Lantaanin ja lantanidien yhteisille ominaisuuksille on luonnollista etsiä syitä niiden atomien elektronikuorten rakenteesta.
Kvanttimekaniikan lakien mukaan elektronit voivat kiertää ytimien ympärillä, jotka eivät ole millään kiertoradalla. Ne näyttävät jakautuneen kerroksille - kuorille. Näiden kuorien kapasiteetti, niissä olevien elektronien enimmäismäärä, määräytyy kaavan mukaan ei = 2N 2, missä ei on elektronien lukumäärä, a N on kuoren numero ytimestä laskettuna. Tästä seuraa, että ensimmäisessä kuoressa voi olla vain kaksi elektronia, toisessa - kahdeksan, kolmannessa - kahdeksantoista, neljännessä - kolmekymmentäkaksi ja niin edelleen.
Jo jaksollisen järjestelmän neljännellä jaksolla, skandiumista alkaen, "seuraavat" elektronit eivät putoa ulompaan neljänteen kerrokseen, vaan edelliseen. Tästä syystä alkioiden, joiden atomiluku on 12-30, ominaisuuksien ero ei ole yhtä terävä kuin kevyempien elementtien. Samanlainen kuva on havaittavissa viidennellä jaksolla. Ja täällä yttriumista alkaen uudet elektronit eivät täytä viidettä, vaan toiseksi viimeistä, neljättä kuorta - muodostuu toinen sarja niin kutsuttuja siirtymämetalleja.
Riisi. 3. Harvinaisten maametallien atomitilavuuksien käyrä. Siinä on kaksi maksimia, jotka muodostuvat elementeistä, joilla on valenssi 2+; Sitä vastoin elementeillä, jotka voivat olla neliarvoisia, on minimaaliset atomitilavuudet
Siirretään tämä analogia kuudenteen jaksoon, olisi loogista olettaa, että lantaanista alkaen (se on skandiumin ja yttriumin analogi), sama tapahtuu täällä. Elektronit, logiikkamme huomioimatta, eivät kuitenkaan täytä toiseksi viimeistä, vaan kolmannen kuoren ulkopuolelta, koska siinä on vapaita paikkoja. Kaavan mukaan ei = 2N 2, tässä kuoressa - neljännessä ytimestä - voi olla 32 elektronia. Sieltä, harvoja poikkeuksia lukuun ottamatta, seuraavien lantanidien "uudet" elektronit pääsevät. Ja koska elementin kemialliset ominaisuudet määräytyvät ensisijaisesti ulkoisten elektronikuorten rakenteen perusteella, lantanidien ominaisuudet osoittautuvat vielä läheisemmiksi kuin siirtymämetallien.
Kuten ryhmän III alkuaineille kuuluu, lantanidit ovat yleensä kolmiarvoisia. Mutta jotkut niistä voivat myös osoittaa toisen valenssin: cerium, praseodyymi ja terbium - 4+; samarium, europium ja ytterbium - 2+.
Lantanidien epänormaalit valenssit tutki ja selitti saksalainen kemisti Wilhelm Klemm. Röntgenspektreistä hän määritti niiden kiteiden pääparametrit ja atomitilavuudet. Atomitilavuuskäyrällä näkyy selvästi maksimit (europium, ytterbium) ja vähemmän jyrkästi minimit (cerium, terbium). Praseodyymi ja samarium putoavat myös, joskaan ei niin paljon, tasaisesti laskevan käyrän määrittelemästä sarjasta. Siksi ensimmäinen "painottuu" pienimääräiseen ceriumiin ja terbiumiin ja toinen - suuriin europiumiin ja ytterbiumiin. Alkuaineet, joilla on suurempi atomitilavuus, pitävät elektroneja tiukemmin ja ovat siksi vain kolmi- tai jopa kaksiarvoisia. Päinvastoin "pienen tilavuuden" atomeissa yksi "sisäisistä" elektroneista ei ole tiukasti suljettu kuoreen - siksi ceriumin, praseodyymin ja terbiumin atomit voivat olla neliarvoisia.
Klemmin teoksissa annettiin myös fyysinen perustelu harvinaisten maametallien pitkään jatkuneelle jakamiselle kahteen alaryhmään - ceriumiin ja yttriumiin. Ensimmäinen sisältää lantaanin ja lantanidit ceriumista gadoliniumiin, toinen sisältää yttriumin ja lantanidit terbiumista lutetiumiin. Ero näiden kahden ryhmän elementtien välillä on lantanidien neljännen pääkuoren täyttävien elektronien spinien suunta.
Spinit - oikeat elektronien liikemomentit - sillä ensimmäisillä on sama merkki; jälkimmäisessä puolella elektroneista on yhden ja puolella toisen merkin spinit.
Mutta tarpeeksi niistä poikkeavuuksista, jotka voidaan selittää vain kvanttimekaniikan avulla - palataanpa kuvioihin.
Lantanidien osalta myös kuviot näyttävät joskus epäloogisilta. Esimerkki tästä on lantanidin supistuminen.
Lantanidipuristus on norjalaisen geokemistin Goldschmidtin löytämä nimitys harvinaisten maametallien kolmiarvoisten ionien koon luonnolliselle pienenemiselle lantaanista lutetiumiin. Näyttäisi siltä, että kaiken pitäisi olla päinvastoin: ceriumatomin ytimessä on yksi protoni enemmän kuin lantaaniatomin ytimessä; praseodyymiydin on suurempi kuin ceriumydin ja niin edelleen. Vastaavasti myös ytimen ympärillä pyörivien elektronien määrä kasvaa. Ja jos kuvittelemme atomin sellaisena kuin se yleensä piirretään kaavioihin - pienen levyn muodossa, jota ympäröivät näkymättömien elektronien pitkänomaiset kiertoradat, erikokoiset kiertoradat, niin elektronien tuoton pitäisi ilmeisesti kasvattaa atomin kokoa. kokonainen. Tai jos hylkäämme ulkoiset elektronit, joiden lukumäärä ei välttämättä ole sama, sama säännöllisyys tulisi havaita lantaanin ja sen ryhmän kolmiarvoisten ionien kooissa.
Asian todellista tilaa kuvaa lantanidin puristuskaavio. Kolmiarvoisen lantaani-ionin säde on 1,22 Å ja saman lutetiumionin säde on vain 0,99 Å. Kaikki ei ole loogista, vaan päinvastoin. Lantanidipuristusilmiön fyysisen merkityksen ytimeen ei kuitenkaan ole vaikea päästä ilman kvanttimekaniikkaakaan, riittää, kun muistaa sähkömagnetismin peruslait.
Ytimen varaus ja sitä ympäröivien elektronien määrä kasvavat rinnakkain. Myös vastakkaisten varausten välinen vetovoima kasvaa; raskaampi ydin vetää puoleensa elektroneja voimakkaammin, lyhentää niiden kiertorataa. Ja koska lantanidiatomien syvät kiertoradat ovat eniten kyllästyneitä elektroneilla, sähköisellä vetovoimalla on vieläkin vahvempi vaikutus.
Ionisäteiden läheisyys ja kemiallisten ominaisuuksien yhteisyys ovat tärkeimmät syyt lantanidien yhteiselle esiintymiselle mineraaleissa.
Tietoja harvinaisista maametallien mineraaleista
Pääasiallinen niistä - monatsiitti - on kuvattu edellä. Toiseksi tärkein harvinaisten maametallien mineraali, bastnäsiitti, on monella tapaa samanlainen. Bastnäsiitti on myös painava, myös kiiltävä, ei myöskään väriltään vakio (useimmiten vaaleankeltainen). Mutta kemiallisesti se liittyy monatsiittiin vain suurella lantaani- ja lantanidien pitoisuudella. Jos monatsiitti on fosfaatti, niin bastnäsiitti on harvinaisten maametallien fluorikarbonaatti, jonka koostumus kirjoitetaan yleensä seuraavasti: (La, Ce)FCO 3 . Mutta kuten usein tapahtuu, mineraalikaava ei heijasta täysin sen koostumusta. Tässä tapauksessa se osoittaa vain pääkomponentit: bastnäsiitissä 36,9 ... 40,5 % ceriumoksidia ja lähes samat (yhteensä) lantaanin, praseodyymin ja neodyymin oksidit. Mutta tietysti se sisältää myös muita lantanideja.
Bastnasiitin ja monatsiitin lisäksi käytännössä käytetään useita muita harvinaisia maametallimineraaleja, vaikkakin rajoitetusti, erityisesti gadoliniittia, jossa on jopa 32 % cerium-alaryhmän REE-oksideja ja 22...50 % yttriumia. Joissakin maissa harvinaisia maametalleja uutetaan lopariitin ja apatiitin monimutkaisen käsittelyn aikana.

Riisi. 4. Lantanidien suhteellinen pitoisuus maankuoressa. Malli: Parilliset luvut ovat yleisempiä kuin parittomat luvut
Yhteensä tunnetaan noin 70 varsinaista harvinaista maametallia ja noin 200 muuta mineraalia, joissa nämä alkuaineet ovat mukana epäpuhtauksina. Tämä osoittaa, että "harvinaiset" maametallit eivät ole ollenkaan niin harvinaisia, ja tämä skandiumin, yttriumin ja lantaanin vanha yleinen nimi lantanidiyhdisteiden kanssa ei ole muuta kuin kunnianosoitus menneisyydelle. Ne eivät ole harvinaisia - maassa on enemmän ceriumia kuin lyijyä, ja harvinaisimmat harvinaiset maametallit ovat paljon yleisempiä maankuoressa kuin elohopea. Kyse on näiden elementtien hajaantumisesta ja vaikeudesta erottaa ne toisistaan. Mutta tietenkään lantanidit eivät ole jakautuneet tasaisesti luonnossa. Elementit, joilla on parillinen atomiluku, ovat paljon yleisempiä kuin niiden parittomat naapurit. Tämä seikka tietysti vaikuttaa harvinaisten maametallien tuotannon laajuuteen ja hintoihin. Kaikkein saavuttamattomissa olevat lantanidit - terbium, tulium, lutetium (huomaa, että nämä ovat kaikki lantanideja, joilla on parittomat atomiluvut) - ovat kalliimpia kuin kulta ja platina. Ja yli 99% puhtauden ceriumin hinta on vain 55 ruplaa kilogrammalta (tiedot vuodelta 1970). Vertailun vuoksi huomautamme, että kilogramma mischmetalia maksaa 6 ... 7 ruplaa ja ferroserium (10% rautaa, 90% harvinaisia maaelementtejä, pääasiassa ceriumia) - vain viisi. Harvinaisten maametallien käyttöaste on pääsääntöisesti verrannollinen hintoihin...
Lantanidit käytännössä
Syksyllä 1970 Neuvostoliiton tiedeakatemian harvinaisten elementtien mineralogian, geokemian ja kristallikemian instituutin tieteellinen neuvosto kokoontui laajennettuun kokoukseen, jolla oli melko epätavallinen asialista. Harvinaisten maametallien mahdollisuuksista keskusteltiin "maatalouden ongelmien valossa".
Kysymys näiden alkuaineiden vaikutuksesta eläviin organismeihin ei syntynyt sattumalta. Toisaalta tiedetään, että harvinaiset maametallit sisältyvät usein epäpuhtauksina maatalouskemian tärkeimpien mineraalien - fosforiittien ja apatiitin - koostumukseen. Toisaalta on tunnistettu kasveja, jotka voivat toimia lantaanin ja sen analogien biokemiallisina indikaattoreina. Joten esimerkiksi eteläisen hikkorisaksanpähkinän lehtien tuhkassa jopa 2,5% harvinaisia maaelementtejä. Näiden alkuaineiden lisääntynyt pitoisuus havaittiin myös sokerijuurikkaasta ja lupiinista. Harvinaisten maametallien pitoisuus tundran maaperässä on lähes 0,5%.
On epätodennäköistä, että nämä yhteiset elementit eivät vaikuta kasvien ja mahdollisesti evoluutioportaiden muiden asteiden organismien kehitykseen. Vielä 1930-luvun puolivälissä Neuvostoliiton tiedemies A.A. Drobkov tutki harvinaisten maametallien vaikutusta erilaisiin kasveihin. Hän kokeili herneitä, naurisia ja muita viljelykasveja, esitteli harvinaisia maametallia boorin kanssa tai ilman, mangaania. Kokeiden tulokset sanoivat, että harvinaisia maametallia tarvitaan kasvien normaaliin kehitykseen... Mutta kului neljäsosa vuosisataa ennen kuin nämä elementit tulivat suhteellisen saataville. Lopullista vastausta kysymykseen lantaanin ja hänen tiiminsä biologisesta roolista ei ole vielä annettu.
Tässä mielessä metallurgit ovat selvästi ohittaneet agrokemistit. Yksi viime vuosikymmenien merkittävimmistä rauta- ja terästeollisuuden tapahtumista liittyy lantaaniin ja hänen tiimiinsä.
Pallorautaa saatiin yleensä modifioimalla sitä magnesiumilla. Tämän lisäaineen fysikaalinen merkitys tulee selväksi, jos muistamme, että valurauta sisältää 2 ... 4,5% hiiltä hiutalegrafiitin muodossa, mikä antaa valuraudalle sen pääasiallisen teknisen haittapuolen - haurauden. Magnesiumin lisääminen saa grafiitin muuttumaan pallomaiseen tai pallomaiseen muotoon, joka jakautuu tasaisemmin metalliin. Tämän seurauksena rakenne paranee merkittävästi ja sen myötä valuraudan mekaaniset ominaisuudet. Valuraudan seostaminen magnesiumin kanssa vaatii kuitenkin lisäkustannuksia: reaktio on erittäin raju, sula metalli roiskuu kaikkiin suuntiin, ja siksi tätä prosessia varten oli tarpeen rakentaa erityiset kammiot.
Harvinaiset maametallit vaikuttavat valurautaan samalla tavalla: ne "poistavat" oksidiepäpuhtauksia, sitovat ja poistavat rikkiä ja edistävät grafiitin siirtymistä pallomaiseen muotoon. Ja samaan aikaan ne eivät vaadi erityisiä kammioita - reaktio etenee rauhallisesti. Ja tulos?
Vain 4 kg (0,4 %) ferroserium-magnesiumseosta lisätään valurautatonnia kohden, ja valuraudan lujuus kaksinkertaistuu! Tällaista valurautaa voidaan monissa tapauksissa käyttää teräksen sijasta, erityisesti kampiakselien valmistuksessa. Paitsi että pallografiittivalurauta on 20...25 % halvempi kuin teräsvalut ja 3...4 kertaa halvempi kuin teräs takeet. Valurautaisten akselitappien kulutuskestävyys osoittautui 2–3 kertaa teräksiseen verrattuna. Pallorautakampiakseleita käytetään jo dieselvetureissa ja muissa raskaissa koneissa.
Harvinaisia maametallia (mischmetalin ja ferroseriumin muodossa) lisätään myös eri laatuisiin teräksiin. Kaikissa tapauksissa tämä lisäaine toimii vahvana hapettimena, erinomaisena kaasun- ja rikinpoistoaineena. Joissakin tapauksissa harvinaiset maametallit ovat seostettua ... seostettua terästä. Nikkeli-kromiteräksiä on vaikea valssata - vain 0,03 % mischmetallia, joka on lisätty sellaiseen teräkseen, lisää huomattavasti sen taipuisuutta. Tämä helpottaa valssausta, takeiden valmistusta ja metallin leikkaamista.
Kevyiden metalliseosten koostumukseen lisätään myös harvinaisia maametallien elementtejä. Tunnetaan esimerkiksi lämmönkestävä alumiiniseos, jossa on 11 % mischmetalia. Lantaanin, ceriumin, neodyymin ja praseodyymin lisäaineet mahdollistivat magnesiumseosten pehmenemispisteen nostamisen yli kolme kertaa ja samalla niiden korroosionkestävyyden lisäämisen. Sen jälkeen harvinaisten maametallien sisältämiä magnesiumseoksia alettiin käyttää yliäänikoneiden osien ja keinotekoisten maasatelliittien kuorien valmistukseen.
Harvinaisten maametallien lisäaineet parantavat muiden tärkeiden metallien - kuparin, kromin, vanadiinin, titaanin - ominaisuuksia... Ei ole yllättävää, että metallurgit käyttävät harvinaisia maametalleja yhä enemmän joka vuosi.
Lantaani ja sen analogit ovat löytäneet sovelluksen muilla modernin tekniikan aloilla. Kemian- ja öljyteollisuudessa ne (ja niiden yhdisteet) toimivat tehokkaina katalyytteinä, lasiteollisuudessa väriaineina ja aineina, jotka antavat lasille ominaisia ominaisuuksia. Lantanidien käyttö ydintekniikassa ja siihen liittyvillä teollisuudenaloilla on monipuolista. Mutta siitä lisää myöhemmin, kullekin lantanideille omistetuissa osioissa. Korostamme vain, että jopa keinotekoisesti luotu prometium on löytänyt sovellusta: prometium-147:n hajoamisenergiaa käytetään atomisähköakuissa. Sanalla sanoen harvinaisten maametallien työttömyyden aika päättyi kauan sitten ja peruuttamattomasti.
Ei kuitenkaan pidä olettaa, että kaikki jaksollisen järjestelmän "solmuun" liittyvät ongelmat olisi jo ratkaistu. Nykyään Dmitri Ivanovitš Mendelejevin sanat "harvinaisista maametallista" ovat erityisen tärkeitä: "Täällä on viime vuosina kertynyt paljon uutta" ... Kuitenkin vain amatöörit voivat ajatella, että kaikki ja kaikki on tiedetty, että harvinaiset maan subjekti on uupunut itsensä. Asiantuntijat päinvastoin ovat varmoja, että lantaanin ja sen tiimin tuntemus on vasta alussa, että nämä elementit yllättävät tiedemaailman useammin kuin kerran. Eikä ehkä pelkästään tieteellistä.
reaktorin myrkkyä
Luonnollinen lantaani koostuu kahdesta isotoopista, joiden massaluvut ovat 138 ja 139, ja ensimmäinen (sen osuus on vain 0,089 %) on radioaktiivinen. Se hajoaa K-kaappauksen vaikutuksesta puoliintumisajalla 3,2·10 11 vuotta. Isotooppi lantaani-139 on vakaa. Muuten, se muodostuu ydinreaktoreissa uraanin hajoamisen aikana (6,3% kaikkien fragmenttien massasta). Tätä isotooppia pidetään reaktorin myrkkynä, koska se vangitsee termisiä neutroneja melko aktiivisesti, mikä on ominaista myös lantanideille. Lantaanin keinotekoisista isotoopeista kiinnostavin on lantaani-140, jonka puoliintumisaika on 40,22 tuntia. Tätä isotooppia käytetään radioaktiivisena merkkiaineena lantaanin ja lantanidien erotusprosesseja tutkittaessa.
Mikä näistä kolmesta?
Lantaanin jälkeisiä alkuaineita kutsutaan harvinaisiksi maametalliksi tai lantanideiksi tai lantanideiksi. Mikä näistä nimistä on sopivin? Termi "harvinaiset maametallit" ilmestyi 1700-luvulla. Nyt se johtuu skandiumin, yttriumin, lantaanin ja sen analogien oksideista; alunperin termillä oli laajempi merkitys. "Maalla" kutsutaan yleisesti kaikkia tulenkestäviä metallien oksideja. Mitä tulee alkuaineisiin, joiden atominumerot ovat 57-71, tämä on totta: La 2 O 3:n sulamispiste on noin 2600 °C. Puhtaassa muodossaan monet näistä "maista" ovat harvinaisia tähän päivään asti. Mutta ei tarvitse puhua harvinaisten maametallien elementtien harvinaisuudesta maankuoressa ...
Termi "lantanidit" otettiin käyttöön osoittamaan, että seuraavat neljätoista alkuainetta tulevat lantaanin jälkeen. Mutta sitten yhtä menestyksekkäästi fluoria voidaan kutsua hapetukseksi (tai oksidiksi) - se seuraa myös happea ja klooria - sulfidia ... Mutta kemia on pitkään investoinut käsitteisiin "sulfidi", "fosfidi", "hydridi", kloridi ja niin edelleen eri merkitys. Siksi useimmat tutkijat pitävät termiä "lantanidit" epäonnistuneena, ja sitä käytetään yhä vähemmän.
"Lanthanides" - enemmän perusteltua. Pääte "oid" osoittaa samankaltaisuuden. "Lanthanides" tarkoittaa "lantaanin kaltaista". Ilmeisesti tätä termiä tulisi käyttää osoittamaan 14 elementtiä - lantaanin analogeja.
"Uusi tarina"
Lantaanin ja lantanidien historiassa voidaan erottaa kaksi ajanjaksoa, jotka ovat erityisen runsaasti löytöjä ja kiistoja. Ensimmäinen niistä juontaa juurensa 1800-luvun lopulle, jolloin lantanideja löydettiin ja "suljettiin" niin usein, että siitä ei lopulta tullut edes kiinnostavaa... Toinen myrskyisä ajanjakso oli 1900-luvun 50-luku, jolloin ydinteknologian kehittäminen auttoi saamaan suuria määriä harvinaisten maametallien raaka-aineita ja vauhditti uutta tutkimusta tällä alalla. Silloin oli taipumus hankkia ja käyttää harvinaisten maametallien alkuaineita ei seoksena, vaan kutakin erikseen, käyttämällä niiden erityisiä ominaisuuksia. Ei ole sattumaa, että 15 vuoden aikana (1944–1958) lantanideille omistettujen tieteellisten julkaisujen määrä kasvoi 7,6-kertaiseksi ja joidenkin yksittäisten alkuaineiden osalta jopa enemmän: esimerkiksi holmiumin osalta 24 ja tuliumin osalta 45 kertaa. !
Naamioitunut tärkkelykseksi
Yksi lantaanin yhdisteistä, sen emäksinen asetaatti, käyttäytyy kuten tärkkelys, kun siihen lisätään jodia. Valkoinen geeli saa kirkkaan sinisen värin. Analyytikot käyttävät joskus tätä ominaisuutta löytääkseen lantaania seoksissa ja liuoksissa.
Kaksiarvoinen vain muodollisesti
On osoitettu, että kaikissa yhdisteissä lantaanilla on sama valenssi - 3+. Mutta kuinka sitten selittää harmaanmustan dihydridin LaH2 ja keltaisen sulfidin LaS olemassaolo? Havaittiin, että LaH2 on suhteellisen stabiili LaH3:n muodostusreaktion välituote ja että lantaani on kolmiarvoinen molemmissa hydrideissä. Dihydridimolekyyli sisältää La-La-metallisidoksen. Sulfidin kanssa kaikki selitetään vielä yksinkertaisemmin. Tällä aineella on korkea sähkönjohtavuus, mikä viittaa siihen, että siinä on La 3+ -ioneja ja vapaita elektroneja. Muuten, LaH 2 johtaa myös virtaa hyvin, kun taas LaH 3 on puolijohde.
Lantaani - 57
Lantaani (La) harvinainen maametalli, atominumero 57, atomimassa 138,91, sulamispiste 920 °C ja tiheys 6,16 g/cm3.
He eivät voineet avata sitä pitkään aikaan, minkä vuoksi se sai nimensä ("lantan", kreikaksi "olen piilossa"). Lantaania oli pitkään vaikea saada laboratoriossa ja lisäksi teollisuudessa. Puhtaassa muodossaan hän ja hänen yhdisteensä saatiin vasta vuonna 1903 kromatografiaa käyttäen. Ensin eristettiin lantaanisuolat ja sitten itse lantaani puhtaassa muodossaan. Metallilantaani on hyvin samanlainen kuin metallikalsium. Sen kovuus on verrattavissa tinaan, se hajottaa vettä, reagoi happojen ja kuumennettaessa kloorin ja rikin kanssa. Kuivassa ulkoilmassa se hapettuu ja ohut oksidikalvo suojaa metallirunkoa hapettumiselta.
LANTAANIN SAAMINEN.

harvinainen maametalli - lantaani
Luonnossa lantaania löytyy pääasiassa mineraaleista, joita kutsutaan monatsiitiksi ja bastnäsiitiksi. Sitä on myös mineraaleissa lopariitti ja apatiitti. Nämä mineraalit sisältävät myös muita REM-yhdisteitä, mikä vaikeuttaa puhtaan lantaanin eristämistä. Teollisuudessa kaupallisena tuotteena lantaania valmistetaan jopa 99 %:n puhtaudella, jonka puhtausaste on sitten korkeampi.
Monatsiitti on raskas mineraali, jota esiintyy luonnossa useissa eri väreissä sen vaihtelevan kemiallisen koostumuksen vuoksi. Se sisältää jopa 68 % erilaisten REM-oksidien oksideja, jopa 7 % zirkoniumia, jopa 10 % toriumdioksidia ja prosenttiosia uraania. Monatsiittia, yleensä paikkojen muodossa, löytyy eri mantereiden merien, järvien ja jokien rannoilta. Mineraalien uuttamisen jälkeen on tarpeen saada konsentraatti, jonka puhtaus on jopa 92-96%. Tätä varten käytetään karkeamurskaus-, hienomurskaus- ja sitten rikastusprosessia painovoiman, magneettisten ja sähköstaattisten menetelmien avulla. Tässä tapauksessa saadaan myös muita konsentraatteja (ilmeniitti, rutiili, zirkonium).
Sitten saatua monatsiittikonsentraattia käsitellään rikkihapolla (joskus alkalilla). Syntyvät REM-sulfaatit liuotetaan vedellä, ne liukenevat ja piidioksidi ja osa zirkonia jää sakka. Seuraavassa käsittelyvaiheessa radium 228 ja torium ceriumin kanssa erotetaan. Ceriumin erotuksen jälkeen lantaani jää liuokseen LaCl3-kloridin muodossa. Sitten se altistetaan elektrolyysille sulassa, jossa se eristetään puhtaudella jopa 99,5 %. Puhtaamman lantaanin saamiseksi 99,8 %:iin asti käytetään kalsiumtermistä käsittelymenetelmää. On olemassa muita harvinaisten maametallien erotusmenetelmiä - uuttaminen ja ioninvaihto, joiden käytöllä saavutetaan saadun lantaanin puhtaus jopa 99,9%.
Viime aikoina lantaania saatiin yhdessä ceriumin kanssa. Tässä seoksessa ne olivat suhteessa 1:1, ja tällä seoksella oli pyroforisia ominaisuuksia, joita käytettiin merkkiammusten valmistuksessa. Lantaania voidaan saada superfosfaattien ja apatiittien tuotannossa, joiden varat maassamme ovat ehtymättömät.
LANTAANIN KÄYTTÖ.
Uusia materiaaleja luotaessa nykymaailmassa on vaikea yliarvioida harvinaisten maametallien, mukaan lukien lantaanin, merkitystä.
Energiaa. Ydinvoima kuluttaa suuren määrän lantaania ydinpolttoaineen lisäaineena. Sitä käytetään myös plutoniumin valmistukseen. Tuulivoimateollisuus käyttää voimakkaita lantaanilla valmistettuja magneetteja tuuliturbiinigeneraattoreihin.
Öljyteollisuus. Lantaania käytetään katalyyttinä öljyn krakkausprosessissa.
Fosforit. Lantaania käytetään loistelamppujen valmistuksessa, litteiden näyttöjen ja näyttöjen valmistuksessa sekä katodisädeputkien laitteissa. Tällä hetkellä loisteaineiden tuotannosta on tulossa maailman suurin teollisuus REM:n ja lantaanin kulutuksessa, erityisesti erittäin puhdistetun metallin ja monimutkaisten yhdisteiden, kuten LaCeT, LaP, muodossa.
Elektroniikka. Mikrosirujen ja muistilaitteiden valmistus tietokoneisiin, LED-näyttöjen valmistus.
Seokset ja keramiikka. Metallurgian metalliseosten seostamiseen ja jalostukseen, ns. sekametalli (serium, 45-50 %, lantaani 22-35 %, neodyymi 15-17 % ja muut REM:t, joissa on enintään 5 % rautaa ja piitä 0,1-0,3 %), erittäin tärkeä komponentti puhtaiden metallien saamiseksi, kuten ligatuurit lämmönkestävien ja kemikaalien kestävien metalliseosten saamiseksi. Lantaanin ja ceriumin seos, joka on lisätty kromi-nikkeliterästen koostumukseen, lisää merkittävästi niiden taipuisuutta, mikä helpottaa valssausta kymmenkertaiseksi ja vähentää merkittävästi metallihäviöitä. Erittäin puhtaiden tulenkestävien metallien saaminen on mahdotonta ilman lantaanin ja sen seoksen lisäämistä seriumiin niiden seoksiin. Lantaanin ja sen seoksen seriumin lisääminen alumiiniin ja magnesiumiin lisäävät merkittävästi niiden mekaanisia ja kemiallisia ominaisuuksia. Lantaania käyttävän sähkö- ja elektroniikkakeramiikan tuotannosta on tulossa tärkeä toimiala kehittyneiden teollisuusmaiden markkinoilla.
Avaruus ja ilmailu. Satelliittien ja avaruusalusten runkojen rakennemateriaalien valmistus. Nämä materiaalit kestävät valtavia kuormituksia, lämpötilan ja paineen pudotuksia. Lentokoneiden kaasuturbiinimoottoreissa käytetään mikroseostusta REM-seoksilla, jotka sisältävät lantaania.
Autoteollisuus Polttoainekatalyyttien valmistus, uuden sukupolven akkujen valmistus, moottoreiden valmistus hybridiautoihin.
Laserit ja optoelektroniikka. Optisten linssien valmistus.
muut. Diagnostisten laitteiden luominen lääketieteessä, uudentyyppisten lannoitteiden luominen maatalouteen. Suodattimien luominen ympäristöystävällisille teollisuudenaloille.
Johdanto
1. Kuitti
2. Ominaisuudet
3. Sovellus
4. Biologinen rooli
Johtopäätös
Johdanto
Lantaania kemiallisena alkuaineena ei voitu löytää 36 vuoteen. Vuonna 1803 24-vuotias ruotsalainen kemisti Jöns Jakob Berzelius tutki mineraalia, joka tunnetaan nykyään seriittinä. Tästä mineraalista löytyi yttriummaa ja toinen harvinainen maa, joka on hyvin samanlainen kuin yttrium. He kutsuivat sitä ceriumiksi. Vuonna 1826 Carl Mozander tutki ceriummaata ja totesi sen olevan heterogeeninen ja että se sisältää ceriumin lisäksi vielä yhden uuden alkuaineen. Mozander onnistui todistamaan ceriummaan monimutkaisuuden vasta vuonna 1839. Hän onnistui eristämään uuden alkuaineen, kun hänellä oli käytössään suurempi määrä seriittiä.
1. Kuitti
Metallisen lantaanin, luonnollisesti kaukana puhtaasta, hankittiin ensin Mosander kuumentamalla lantaanikloridia kaliumilla. Nykyään teollisessa mittakaavassa lantaanin puhtaus on yli 99 %; pääasiassa monatsiitista ja bastnäsiitistä sekä ceriumista ja kaikista muista cerium-alaryhmän alkuaineista.
Mosaniitti on raskas, kiiltävä mineraali, yleensä kellanruskea, mutta joskus myös muita värejä, koska se ei eroa koostumuksestaan. Tarkemmin sen koostumusta kuvaa tällainen outo kaava: (REE)RO4: tämä tarkoittaa, että monatsiitti on harvinaisten maametallien fosfaatti (REE). Yleensä monaliitissa 50-68 % REE-oksideja ja 22-31,5 % P2O5:a. Ja se sisältää myös jopa 7 % zirkoniumdioksidia, 10 % (keskimäärin) toriumdioksidia ja 0,1-0,3 % uraania. Nämä luvut osoittavat selvästi, miksi meidän aikanamme harvinaisten maametallien ja ydinteollisuuden polut ovat tiiviisti kietoutuneet toisiinsa. Monatsiittia levitetään jokien, järvien ja merien rannoille kaikilla mantereilla. Vuosisadan alussa (tiedot vuodelta 1909) 92 % maailman harvinaisten maametallien, pääasiassa monatsiittien, tuotannosta tuli Brasiliasta. Vuoden 1950 jälkeen Yhdysvalloista tuli ydinteollisuuden kehityksen yhteydessä kapitalististen maiden hegemoni harvinaisten maametallien raaka-aineiden louhinnassa ja käsittelyssä.
Monatsiittikonsentraatin saamiseksi, jonka puhtaus on 92 - 96%, käytetään gravitaatio-, magneetti- ja sähköstaattisten rikastusmenetelmien kompleksia. Tämän seurauksena matkan varrella saadaan ilmeniittiä, rutiilia, zirkonia ja muita arvokkaita rikasteita.
Kuten mikä tahansa mineraali, monatsiitti on "avattava". Useimmiten monatsiittikonsentraattia käsitellään tätä varten väkevällä rikkihapolla (myös emäksinen menetelmä monatsiitin avaamiseksi on yleistynyt). Syntyvät harvinaisten maametallien sulfaatit ja torium liuotetaan kylmällä vedellä. Liukenemisen jälkeen piidioksidi ja osa zirkonista, joka ei eronnut edellisissä vaiheissa, jää sedimenttiin.
Seuraavassa vaiheessa erotetaan lyhytikäinen mesotorium (radium - 228) ja sitten itse torium - joskus yhdessä ceriumin kanssa, joskus erikseen. Ceriumin eristämisen jälkeen suurin osa lantaanista jää liuokseen, joka yleensä saadaan LaCl3-kloridina. Sulan kloridin elektrolyysi tuottaa lantaania, jonka puhtaus on jopa 99,5 %. Vielä enemmän puhdasta lantaania - 99,79% ja enemmän saadaan kalsiumin lämpömenetelmällä. Tämä on klassinen, perinteinen tekniikka. Kuten näet, alkuainelantaanin saaminen on monimutkainen asia.
Lantanidien erottaminen - praseodyymistä lutetiumiin - vaatii vielä enemmän vaivaa ja rahaa ja tietysti aikaa. Siksi kemistit ja teknikot monissa maailman maissa ovat viime vuosikymmenen aikana pyrkineet luomaan uusia, edistyneempiä menetelmiä näiden alkuaineiden erottamiseksi. Tällaisia menetelmiä - uutto ja ioninvaihto - luotiin ja otettiin käyttöön teollisuudessa. Jo 1960-luvun alussa ioninvaihtoperiaatteella toimivat laitokset saavuttivat 95 % harvinaisten maametallien tuoton puhtaudeltaan jopa 99,9 %.
2. Ominaisuudet
Lantaanin fysikaaliset ominaisuudet
LANTAN (kreikaksi lanthano - piiloutuminen; lat. Lanthanum) La, chem. elementti III gr. määräajoin järjestelmät, atominumero 57, atomimassa 138,9055; kuuluu harvinaisten maametallien alkuaineisiin. Luonnonlantaani koostuu kahdesta isotoopista 139La (99,911%) ja radioaktiivisesta 138La:sta (0,089%).
|
atominumero |
||
|
Ulkomuoto |
pehmeä, muokattava, viskoosi hopeanvalkoinen metalli |
|
|
Atomin ominaisuudet |
||
|
Atomimassa (moolimassa) |
138,9055 a. e.m. (g/mol) |
|
|
Atomin säde |
||
|
Ionisaatioenergia (ensimmäinen elektroni) |
541,1 (5,61) kJ/mol (eV) |
|
|
Elektroninen konfigurointi |
||
|
Termodynaamiset ominaisuudet |
||
|
Tiheys |
||
|
Ominaislämpö |
0,197 J/(K mol) |
|
|
Lämmönjohtokyky |
13,4 W/(m K) |
|
|
Sulamislämpötila |
||
|
Sulamislämpö |
8,5 kJ/mol |
|
|
Kiehumislämpötila |
||
|
Haihtumislämpö |
402 kJ/mol |
|
|
Molaarinen tilavuus |
22,5 cm3/mol |
|
|
Kemiallisia ominaisuuksia |
||
|
kovalenttinen säde |
||
|
Ionin säde |
101.(+3e) klo 18 |
|
|
Elektronegatiivisuus |
||
|
Elektrodin potentiaali |
||
|
Hapetustilat |
7, 6, 4, 3, 2, 0, -1 |
|
|
Kristallisolu |
||
|
Hilarakenne |
kuusikulmainen |
|
|
Hilakausi |
||
|
c/a-suhde |
||
|
Debye lämpötila |
Kemiallisia ominaisuuksia
Kemiallisilta ominaisuuksiltaan lantaani on tavallista, mutta erittäin tulenkestävää. Kuivassa ilmassa se ei muutu - oksidikalvo suojaa luotettavasti hapettumiselta irtotavarana. Mutta jos ilma on kosteaa (ja tavallisissa maanpäällisissä olosuhteissa se on lähes aina kosteaa), metallilantaani hapettuu vähitellen hydroksidiksi. Hapessa, kun se kuumennetaan 450 ° C:seen, se palaa kirkkaalla liekillä (tässä tapauksessa vapautuu melko paljon lämpöä). Jos se kalsinoidaan typpiatmosfäärissä, muodostuu mustaa nitridia. Kloorissa lantaani syttyy huoneenlämpötilassa, kun taas se reagoi bromin ja jodin kanssa vain kuumennettaessa. Se liukenee hyvin mineraalihappoihin, ei reagoi alkaliliuosten kanssa. Kaikissa yhdisteissä lantaanin valenssi on 3+.
Reaktio vedyn ja lantaanin kanssa alkaa jo huoneenlämpötilassa ja etenee lämmön vapautuessa. Muodostuu vaihtelevan koostumuksen hydridejä, koska samalla lantaani imee vetyä - mitä intensiivisemmin, sitä korkeampi lämpötila.
3. Sovellus
Lasin tuotanto
Lantaanioksidia (5-40 %) käytetään optisen lasin (lantaanilasi) sulattamiseen, elokuva- ja valokuvauslaitteissa käytettävien linssien ja prismien valmistukseen sekä tähtitieteellisiin tarkoituksiin.
Keraamisten sähkölämmittimien valmistus
Lantaanikromiittia, joka on seostettu kalsiumilla, strontiumilla, magnesiumilla, käytetään korkean lämpötilan uunilämmittimien valmistukseen (sulamispiste Ї 2453 ° C, käyttölämpötila - noin 1780 astetta happiilmakehässä). Lämpötilan noustessa lantaanikromiitin sähkövastus pienenee jyrkästi. Lantaanikromiitin lämpölaajenemiskerroin on erittäin alhainen ja tämä määrää sähkölämmittimien kestävyyden.
Suprajohtavuus korkeassa lämpötilassa
Lantaanioksidia käytetään korkean lämpötilan suprajohteiden synteesiin, jotka perustuvat lantaanin, yttriumin, bariumin, strontiumin, kuparin jne. oksideihin.
Metallilämpö
Joskus lantaania käytetään metallotermiassa harvinaisten alkuaineiden vähentämiseen.
Erikoislasipinnoitteet
Lantaaniyhdisteiden pohjalta valmistetaan ikkunalasien pinnoitteita, jotka mahdollistavat huoneen lämpötilan alentamisen 5-7 astetta.
Lämpösähköiset materiaalit
Lantaanimonotelelluridilla on erittäin korkea lämpö-emf (834 μV/K) ja sitä käytetään korkean hyötysuhteen lämpösähkögeneraattoreissa.
Metallihydridivetyakkujen valmistus
Lantaaninikkelihydridiä käytetään laajalti suuren kapasiteetin vetyvarastona (metallihydridin vetyvarastoina) autoissa.
Ydinenergia
Erittäin puhdas metallilantaani on aivan poikkeuksellisen tärkeä ydinteollisuudessa ja erityisesti ydinpolttoaineen jälleenkäsittelytekniikassa plutoniumin talteenottamiseksi. Sula lantaani sekoitetaan sulaan metalliseen uraaniin, jonka epäpuhtautena on metallista plutoniumia. Sula lantaani uuttaa kokonaan plutonium-isotoopit suurimmasta osasta uraanista seokseksi ja kelluu uraanin yläpuolella sekoittumatta siihen. Tuloksena oleva seos valutetaan ja käsitellään kemiallisella tekniikalla. Voidaan väittää, että lantaani pitää "hartioillaan" ydinaseiden tuotantoa.
Elektroniikka
Viime vuosina kiinnostus lantaanimolybdaattiin, jolla on korkea johtavuus, on lisääntynyt merkittävästi.
elektronimikroskopia
LaB 6 (lantaaniheksaboridi) katodien käyttö elektronimikroskopeissa mahdollisti erottelukyvyn lisäämisen lisäämällä virrantiheyttä kertoimella 6 ja samanaikaisesti pidentää katodin käyttöikää kertoimella 5 (jopa 500 tuntia) verrattuna volframiin. katodit.
Kemialliset virtalähteet
Kiinteällä elektrolyytillä varustettujen akkujen tuotanto ja tutkimus kiinnostavat suuresti teollisuutta ja elektroniikkaa. Tällä alalla lantaanifluoridista on tullut erittäin tärkeä elektrolyytti, ja lantaanimetallin anodina katodi on yleensä vismutti-, lyijy- tai kuparifluoridi. Tällaisten virtalähteiden houkutteleva puoli on erittäin korkea ominaisenergiaintensiteetti tilavuuden suhteen, pitkä energian varastointiaika, lujuus ja kestävyys; Tässä suhteessa monet johtavat asiantuntijat pitävät niitä vaihtoehtona kaikille muuntyyppisille akuille.
4. Biologinen rooli
lantaanikloridimetallikemikaali
Neuvostoliiton tiedemies A. A. Drobkov tutki 1930-luvun puolivälissä harvinaisten maametallien vaikutusta erilaisiin kasveihin. Hän kokeili herneitä, naurisia ja muita viljelykasveja, esitteli harvinaisia maametalleja boorin kanssa tai ilman, mangaania. Kokeiden tulokset sanoivat, että harvinaisia maametalleja tarvitaan kasvien normaaliin kehitykseen. Mutta kului neljännesvuosisata, ennen kuin nämä elementit tulivat suhteellisen saataville. Lopullista vastausta kysymykseen lantaanin biologisesta roolista ei ole vielä annettu.
Lääketieteessä lantaanikarbonaattia käytetään hyperfosfatemiassa lääkkeenä, joka estää fosfaatin imeytymisen ruoasta.
Johtopäätös
Tiivistelmässäni tarkastelin lantaanin fysikaalisia ja kemiallisia ominaisuuksia sekä sitä, missä lantaania käytetään, millä teollisuudenaloilla ja lääketieteessä.
Bibliografia
1. Arefieva "Ekologinen kemia", 2006
2. Gelfman "Kemia", 2004
3. Nekrasov "Yleinen kemia", 2007
4. Knyazev "Epäorgaaninen kemia", 2004
5. http://ru.wikipedia.org/wiki/%D0%9B%D0%B0%D0%BD%D1%82%D0%B0%D0%BD
Samanlaisia asiakirjoja
Lantaanin ja lantanidien perhe, niiden fysikaaliset ja kemialliset ominaisuudet. Lantaanin ja sen yhdisteiden löytöhistoria, valmistusmenetelmät, käyttö. Lantaanin ja lantanidien atomien elektronikuorten rakenne. Lantanidien epänormaalit valenssit.
tiivistelmä, lisätty 18.1.2010
Kiinteiden aineiden ioninjohtavuuden luonne. Kiinteiden oksidielektrolyyttien tyypit, niiden käyttö erilaisissa laitteissa. Vismuttioksidin rakenne ja ominaisuudet, sen yhteinen kemiallinen saostus lantaanioksidin kanssa. Syntetisoidun kiinteän elektrolyytin analyysi.
lukukausityö, lisätty 12.06.2013
Bariummetalli ja sen runsaus luonnossa. Metallisen bariumin saaminen. Bariumkloridin elektrolyysi. Hydridin lämpöhajoaminen. Kemialliset ja fysikaaliset ominaisuudet. Sovellus. Liitännät (yleiset ominaisuudet). epäorgaaniset yhdisteet.
Akryyliamidi: fysikaaliset ja kemialliset ominaisuudet, liukoisuus. Valmistus ja määritys, akryyliamidin myrkyllisyys. Akryyliamidin ja johdannaisten käytön ominaisuudet. Akryyliamidipolymeerien käyttö ja valmistus. Polyakryyliamidin kemiallisten ominaisuuksien karakterisointi.
lukukausityö, lisätty 19.6.2010
2-metyylibutadieeni-1,3:n fysikaaliset ja kemialliset ominaisuudet. Vaarallisten vaikutusten tyyppien analyysi, myrkyllisyys, vaaraluokka. Sovellus teollisuudessa. Tuotantomenetelmät, kemia ja prosessitekniikka. Isopreenin tuotanto isobutyleeniin ja formaldehydiin.
lukukausityö, lisätty 3.9.2015
Toisen ryhmän pääalaryhmän elementti, D. I. Mendelejevin kemiallisten alkuaineiden jaksollisen järjestelmän neljäs jakso. Nimen historia ja alkuperä. Kalsiumin löytäminen luonnosta. Fysikaaliset ja kemialliset ominaisuudet. Metallisen kalsiumin käyttö.
tiivistelmä, lisätty 12.1.2012
Vetyperoksidin fysikaaliset ominaisuudet - väritön läpinäkyvä neste, jolla on lievä erikoinen haju. Aineen saaminen laboratorio- ja teollisuusolosuhteissa. Vetyperoksidin pelkistävät ja hapettavat ominaisuudet, sen bakterisidiset ominaisuudet.
esitys, lisätty 23.9.2014
Strontiumin löytämisen historia. Löytää luonnosta. Strontiumin saanti aluminotermisellä menetelmällä ja sen varastointi. fyysiset ominaisuudet. Mekaaniset ominaisuudet. Atomiominaisuudet. Kemiallisia ominaisuuksia. Tekniset ominaisuudet. Käyttöalueet.
tiivistelmä, lisätty 30.09.2008
Ferriittien fysikaaliset ja fysikaalis-kemialliset ominaisuudet. Normaalin ja käänteisen spinellin rakenne. Yleiskatsaus sintraus- ja kuumapuristusmenetelmään. Magneettisia kiteitä, joissa on kuusikulmainen rakenne. Ferriittien käyttö radioelektroniikassa ja tietotekniikassa.
lukukausityö, lisätty 12.12.2016
Kalsiumkloridi: fysikaaliset ja kemialliset ominaisuudet. sovellus ja raaka-aineet. Sulatetun kalsiumkloridin saaminen soodatuotannon tislausnesteestä. Kalsiumkloridin ja hydroksyylikloridin valmistus emäliuoksesta. Vedetön kalsium suolahaposta.