Bariul este un element al subgrupului principal al celui de-al doilea grup, a șasea perioadă a sistemului periodic de elemente chimice al lui D. I. Mendeleev, cu număr atomic 56. Este desemnat prin simbolul Ba (lat. bariu). O substanță simplă este un metal alcalino-pământos alb-argintiu moale, ductil. Are activitate chimică ridicată.
Istoria descoperirii bariuluiBariul a fost descoperit sub formă de oxid BaO în 1774 de către Karl Scheele. În 1808, chimistul englez Humphrey Davy a produs un amalgam de bariu prin electroliza hidroxidului de bariu umed cu un catod de mercur; după ce a evaporat mercurul la încălzire, a izolat bariu metal.
În 1774, chimistul suedez Carl Wilhelm Scheele și prietenul său Johan Gottlieb Hahn au investigat unul dintre cele mai grele minerale, BaSO4 greu. Ei au reușit să izoleze „pământul greu” necunoscut anterior, care mai târziu a fost numit barit (din grecescul βαρυς - greu). Și după 34 de ani, Humphry Davy, după ce a supus pământului de baritic umed la electroliză, a obținut din acesta un nou element - bariu. Trebuie menționat că în același 1808, ceva mai devreme decât Davy, Jene Jacob Berzelius și colegii săi au obținut amalgame de calciu, stronțiu și bariu. Așa s-a născut elementul bariu.
Alchimiștii antici au calcinat BaSO 4 cu lemn sau cărbune și au obținut „gemuri bologneze” fosforescente. Dar din punct de vedere chimic, aceste pietre prețioase nu sunt BaO, ci sulfură de bariu BaS.
originea numelui
Și-a primit numele de la grecescul barys - „greu”, deoarece oxidul său (BaO) a fost caracterizat ca având o densitate neobișnuit de mare pentru astfel de substanțe.
Găsirea bariului în naturăScoarța terestră conține 0,05% bariu. Acest lucru este destul de mult - mult mai mult decât, să zicem, plumb, staniu, cupru sau mercur. În forma sa pură, nu există în pământ: bariul este activ, este inclus în subgrupul metalelor alcalino-pământoase și, în mod natural, este destul de ferm legat de minerale.
Principalele minerale ale bariului sunt deja amintitele sparte grele BaSO 4 (mai des numite barita) și witherita BaCO3, numite după englezul William Withering (1741 ... 1799), care a descoperit acest mineral în 1782. Sărurile de bariu se găsesc într-un concentrație mică în multe ape minerale și apă de mare. Conținutul scăzut în acest caz este un plus, nu un minus, deoarece toate sărurile de bariu, cu excepția sulfatului, sunt otrăvitoare.
Tipuri de depozite de bariuPrin asociații minerale, minereurile de baritic sunt împărțite în monominerale și complexe. Complexele complexe sunt împărțite în barit-sulfură (conțin plumb, zinc, uneori cupru și sulfuri de pirit de fier, mai rar Sn, Ni, Au, Ag), barit-calcit (conțin până la 75% calcit), fier-barit (conțin magnetit). , hematit și goethit și hidrogoethit în zonele superioare) și barit-fluorit (cu excepția baritului și fluoritului, acestea conțin de obicei cuarț și calcit, iar sulfurile de zinc, plumb, cupru și mercur sunt uneori prezente ca impurități mici).
Din punct de vedere practic, de cel mai mare interes sunt depozitele monominerale, baritice-sulfurate si barite-fluorite de fili hidrotermale. Unele depozite de foi metasomatice și plaseri eluviali sunt, de asemenea, de importanță industrială. Depozitele sedimentare, care sunt sedimente chimice tipice ale bazinelor de apă, sunt rare și nu joacă un rol semnificativ.
De regulă, minereurile de baritic conțin și alte componente utile (fluorit, galena, sfalerit, cupru, aur în concentrații industriale), deci sunt utilizate în combinație.
Izotopi de bariuBariul natural constă dintr-un amestec de șapte izotopi stabili: 130 Ba, 132 Ba, 134 Ba, 135 Ba, 136 Ba, 137 Ba, 138 Ba. Acesta din urmă este cel mai frecvent (71,66%). Sunt cunoscuți și izotopi radioactivi ai bariului, dintre care cel mai important este 140 Ba. Se formează în timpul descompunerii uraniului, toriului și plutoniului.
Obținerea bariuluiMetalul poate fi obținut în diferite moduri, în special, prin electroliza unui amestec topit de clorură de bariu și clorură de calciu. Este posibil să se obțină bariu prin refacerea acestuia din oxid prin metoda aluminotermă. Pentru a face acest lucru, witherita este arse cu cărbune și se obține oxid de bariu:
BaCO 3 + C → BaO + 2CO.
Apoi un amestec de BaO cu pulbere de aluminiu este încălzit în vid la 1250°C. Vaporii de bariu redus se condensează în părțile reci ale tubului în care are loc reacția:
3BaO + 2Al → Al 2O 3 + 3Ba.
Este interesant că peroxidul de bariu BaO 2 este adesea inclus în compoziția amestecurilor de aprindere pentru aluminotermie.
Obținerea oxidului de bariu prin simpla calcinare a witheritei este dificilă: witherita se descompune numai la temperaturi peste 1800°C. Este mai ușor să obțineți BaO prin calcinarea azotatului de bariu Ba (NO 3) 2:
2Ba (NO 3) 2 → 2BaO + 4NO 2 + O 2.
Atât electroliza, cât și reducerea cu aluminiu produc un metal alb strălucitor moale (mai dur decât plumbul, dar mai moale decât zincul). Se topește la 710°C, fierbe la 1638°C, densitatea sa este de 3,76 g/cm 3 . Toate acestea corespund pe deplin poziției bariului în subgrupul metalelor alcalino-pământoase.
Există șapte izotopi naturali ai bariului. Cel mai comun dintre acestea este bariul-138; este mai mult de 70%.
Bariul este foarte activ. Se auto-aprinde la impact, descompune ușor apa, formând un hidrat de oxid de bariu solubil:
Ba + 2H2O → Ba (OH)2 + H2.
O soluție apoasă de hidroxid de bariu se numește apă barită. Această „apă” este folosită în chimia analitică pentru determinarea CO 2 în amestecurile de gaze. Dar aceasta este deja din povestea despre utilizarea compușilor de bariu. Bariul metalic nu găsește aproape nicio aplicație practică. În cantități extrem de mici, este introdus în aliaje de rulmenți și de imprimare. Un aliaj de bariu și nichel este utilizat în tuburile radio, bariul pur este folosit doar în tehnologia vidului ca getter (getter).
Bariul metalic se obține din oxid prin reducerea aluminiului în vid la 1200-1250°C:
4BaO + 2Al \u003d 3Ba + BaAl 2O 4.
Bariul este purificat prin distilare în vid sau topire în zonă.
Prepararea titanului de bariu. Obținerea acestuia este relativ ușor. Witherita BaCO 3 la 700 ... 800 ° C reacționează cu dioxidul de titan TYu 2, rezultă exact ceea ce aveți nevoie:
BaCO 3 + TiO 2 → BaTiO 3 + CO 2.
Principal Balul de absolvire. o metoda de obtinere a bariului metalic din BaO este reducerea acestuia cu pulbere A1: 4BaO + 2A1 -> 3Ba + BaO * A1 2 O 3. Procesul se desfășoară într-un reactor la 1100-1200°C în atmosferă de Ar sau în vid (aceasta din urmă metodă este de preferat). Raportul molar BaO:A1 este (1,5-2):1. Reactorul este plasat într-un cuptor astfel încât temperatura „părții sale reci” (vaporii de bariu formați se condensează în ea) să fie de aproximativ 520 ° C. Prin distilare în vid, bariul este purificat până la un conținut de impurități mai mic de 10 ~ 4 % din greutate, iar atunci când se utilizează topirea zonei - până la 10 ~ 6%.
Cantități mici de bariu se obțin și prin reducerea BaBeO 2 [sintetizat prin fuziunea Ba (OH) 2 și Be (OH) 2] la 1300 ° C cu titan, precum și prin descompunere la 120 ° C Ba (N 3) 2, formată în timpul schimbului p- cationi de săruri de bariu cu NaN3.
Acetat Ba (OOCHN 3), - incolor. cristale; p.p. 490°С (descomp.); dens 2,47 g/cm3; sol. în apă (58,8 g la 100 g la 0°C). Sub 25 ° C, trihidratul cristalizează din soluții apoase, la 25-41 ° C - monohidrat, peste 41 ° C - sare anhidră. Obțineți interacțiune. Ba (OH) 2, VaCO 3 sau BaS cu CH 3 CO 2 H. Folosit ca mordant la vopsirea lânii și chintzului.
Manganat(VI) BaMnO 4 - cristale verzi; nu se descompune până la 1000°C. Obținut prin calcinarea unui amestec de Ba(N03)2 cu Mn02. Un pigment (kassel sau verde mangan) folosit în mod obișnuit pentru pictura în frescă.
Cromat (VI) ВаСrO 4 - cristale galbene; p.p. 1380°C; - 1366,8 kJ/mol; sol. în inorg. to-max, nu sol. in apa. Obțineți interacțiune. soluții apoase de Ba (OH) 2 sau BaS cu cromați de metale alcaline (VI). Pigment (galben barit) pentru ceramică. MPC 0,01 mg/m 3 (în termeni de Cr0 3). Pirconat ВаZrО 3 - incolor. cristale; p.p. ~269°С; - 1762 kJ/mol; sol. în apă și soluții apoase de alcaline și NH 4 HCO 3, descompuse de inorg puternic. to-tami. Obțineți interacțiune. ZrO2 cu BaO, Ba(OH)2 sau BaCO3 când este încălzit. Zirconat de Ba amestecat cu ВаТiO 3 -piezoelectric.
Bromură BaBr 2 - cristale albe; p.p. 847°C; dens 4,79 g/cm3; -757 kJ/mol; bine sol. în apă, metanol, mai rău - în etanol. Din soluții apoase, dihidratul se cristalizează, transformându-se într-un monohidrat la 75 ° C, într-o sare anhidră - peste 100 ° C. În soluții apoase, interacțiunea. cu CO2 și O2 din aer, formând VaCO3 și Br2. Obțineți interacțiunea BaBr 2. p-ditch apos Ba (OH) 2 sau VaCO 3 cu acid bromhidric.
Iodură BaI 2 - incoloră. cristale; p.p. 740°С (descomp.); dens 5,15 g/cm3; . -607 kJ/mol; bine sol. în apă și etanol. Din soluții de apă fierbinte, dihidratul cristalizează (deshidratat la 150 ° C), sub 30 ° C - hexahidrat. Obțineți interacțiunea VaI 2. apa p-ditch Ba (OH) 2 sau VaCO 3 cu acid iodhidric.
Proprietățile fizice ale bariuluiBariul este un metal maleabil alb-argintiu. Se rupe la o lovitură puternică. Există două modificări alotropice ale bariului: α-Ba cu o rețea cubică centrată pe corp este stabilă până la 375 °C (parametrul a = 0,501 nm), β-Ba este stabil mai sus.
Duritate la scară mineralogică 1,25; pe scara Mohs 2.
Bariul metalic este depozitat în kerosen sau sub un strat de parafină.
Proprietățile chimice ale bariuluiBariul este un metal alcalino-pământos. Se oxidează intens în aer, formând oxid de bariu BaO și nitrură de bariu Ba 3 N 2 și se aprinde când este ușor încălzit. Reacționează puternic cu apa, formând hidroxid de bariu Ba (OH) 2:
Ba + 2H 2 O \u003d Ba (OH) 2 + H 2
Interacționează activ cu acizii diluați. Multe săruri de bariu sunt insolubile sau ușor solubile în apă: sulfat de bariu BaSO 4, sulfit de bariu BaSO 3, carbonat de bariu BaCO 3, fosfat de bariu Ba 3 (PO 4) 2. Sulfura de bariu BaS, spre deosebire de sulfura de calciu CaS, este foarte solubilă în apă.
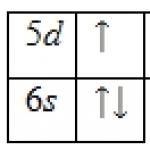
Natural bariul are șapte izotopi stabili din mai. cap. 130, 132, 134-137 și 138 (71,66%). Secțiunea transversală de captare a neutronilor termici este de 1,17-10 28 m 2 . Configurație externă învelişul de electroni 6s2; starea de oxidare + 2, rar + 1; energia de ionizare Ba° -> Ba + -> Ba 2+ resp. 5,21140 și 10,0040 eV; Electronegativitatea Pauling 0,9; raza atomică 0,221 nm, raza ionică Ba 2+ 0,149 nm (numărul de coordonare 6).
Reacționează ușor cu halogenii pentru a forma halogenuri.
Când este încălzit cu hidrogen, formează hidrură de bariu BaH 2 , care, la rândul său, cu hidrură de litiu LiH dă complexul Li.
Reacţionează la încălzire cu amoniac:
6Ba + 2NH3 = 3BaH2 + Ba3N2
Nitrura de bariu Ba 3 N 2 reacționează cu CO la încălzire, formând cianura:
Ba3N2 + 2CO = Ba(CN)2 + 2BaO
Cu amoniacul lichid, dă o soluție de culoare albastru închis, din care se poate izola amoniacul, care are un luciu auriu și se descompune ușor odată cu eliminarea NH3. În prezența unui catalizator de platină, amoniacul se descompune pentru a forma amidă de bariu:
Ba (NH2)2 + 4NH3 + H2
Carbura de bariu BaC 2 poate fi obținută prin încălzirea BaO cu cărbune într-un cuptor cu arc.
Cu fosforul formează fosfura Ba 3 P 2 .
Bariul reduce oxizii, halogenurile și sulfurile multor metale la metalul corespunzător.
Aplicarea bariuluiUn aliaj de bariu cu A1 (aliaj alba, 56% Ba) stă la baza getter-urilor (getter-urilor). Pentru a obține getter-ul propriu-zis, bariul este evaporat din aliaj prin încălzire de înaltă frecvență într-un balon evacuat al dispozitivului; oglindă de bariu (sau acoperire difuză în timpul evaporării într-o atmosferă de azot). Partea activă a majorității covârșitoare a catozilor termoionici este BaO. Bariul este folosit și ca dezoxidant de Cu și Pb, ca aditiv pentru antifricțiuni. aliaje, metale feroase și neferoase, precum și aliaje, din care sunt realizate fonturi tipografice pentru a le crește duritatea. Aliajele de bariu cu Ni sunt folosite pentru fabricarea electrozilor pentru bujiile incandescente din motoarele interne. ardere și în tuburi radio. 140 Va (T 1/2 12,8 zile) este un indicator izotop utilizat în studiul compușilor de bariu.
Bariu metal, adesea într-un aliaj cu aluminiu, este folosit ca un getter în dispozitivele electronice cu vid înalt.
Material anticorozivBariul se adaugă împreună cu zirconiu la lichidele de răcire ale metalelor (aliaje de sodiu, potasiu, rubidiu, litiu, cesiu) pentru a reduce agresivitatea acestora din urmă la conducte și în metalurgie.
Fluorura de bariu este utilizată sub formă de monocristale în optică (lentile, prisme).
Peroxidul de bariu este folosit pentru pirotehnică și ca agent oxidant. Azotatul de bariu și cloratul de bariu sunt folosiți în pirotehnică pentru a colora flăcările (foc verde).
Cromatul de bariu este utilizat la producerea hidrogenului și oxigenului prin metoda termochimică (ciclul Oak Ridge, SUA).
Oxidul de bariu, împreună cu oxizii de cupru și metalele pământurilor rare, este utilizat pentru a sintetiza ceramica supraconductoare care funcționează la temperaturi de azot lichid și mai sus.
Oxidul de bariu este folosit pentru a topi un tip special de sticlă folosit pentru acoperirea tijelor de uraniu. Unul dintre tipurile răspândite de astfel de pahare are următoarea compoziție - (oxid de fosfor - 61%, BaO - 32%, oxid de aluminiu - 1,5%, oxid de sodiu - 5,5%). În fabricarea sticlei pentru industria nucleară se folosește și fosfatul de bariu.
Fluorura de bariu este utilizată în bateriile cu fluor în stare solidă ca componentă a electrolitului cu fluor.
Oxidul de bariu este utilizat în bateriile puternice cu oxid de cupru ca componentă a masei active (oxid de bariu-oxid de cupru).
Sulfatul de bariu este utilizat ca expansor de masă activ cu electrod negativ în producția de baterii plumb-acid.
La masa sticlei se adaugă carbonat de bariu BaCO 3 pentru a crește indicele de refracție al sticlei. Sulfatul de bariu este utilizat în industria hârtiei ca umplutură; calitatea hârtiei este în mare măsură determinată de greutatea acesteia, baritul BaSO 4 face hârtia mai grea. Această sare este inclusă în mod necesar în toate tipurile de hârtie scumpe. În plus, sulfatul de bariu este utilizat pe scară largă în producția de vopsea albă cu litopon, un produs al reacției soluțiilor de sulfură de bariu cu sulfat de zinc:
BaS + ZnSO 4 → BaS0 4 + ZnS.
Ambele săruri, având o culoare albă, precipită, în soluție rămâne apă pură.
La forarea puțurilor de petrol și gaze adânci, o suspensie de sulfat de bariu în apă este utilizată ca fluid de foraj.
O altă sare de bariu își găsește utilizări importante. Acesta este titanatul de bariu BaTiO 3 - unul dintre cei mai importanți feroelectrici (feroelectricii sunt polarizați singuri, fără expunere la un câmp extern. Dintre dielectrici, se evidențiază la fel ca materialele feromagnetice printre conductori. Capacitatea pentru o astfel de polarizare este menținute numai la o anumită temperatură.feroelectricii polarizați diferă constantă dielectrică mai mare), care sunt considerate materiale electrice foarte valoroase.
În 1944, această clasă a fost completată cu titanat de bariu, ale cărui proprietăți feroelectrice au fost descoperite de fizicianul sovietic B.M. Vulom. O caracteristică a titanatului de bariu este că își păstrează proprietățile feroelectrice într-un domeniu foarte larg de temperatură - de la aproape zero absolut până la +125°C.
Bariul a fost folosit și în medicină. Sarea sa sulfat este folosită în diagnosticul bolilor gastrice. BaSO4 este amestecat cu apă și lăsat să fie înghițit de către pacient. Sulfatul de bariu este opac la razele X și, prin urmare, acele părți ale tractului digestiv, prin care trece „terciul de bariu”, rămân întunecate pe ecran. Așa că medicul își face o idee despre forma stomacului și intestinelor, determină locul unde poate apărea un ulcer.
Efectul bariului asupra corpului uman
Căile de intrare în organism.
Principala cale prin care bariul intră în corpul uman este prin alimente. Astfel, unii locuitori marini sunt capabili să acumuleze bariu din apa înconjurătoare, iar în concentrații de 7-100 (și pentru unele plante marine de până la 1000) de ori mai mari decât conținutul acestuia în apa de mare. Unele plante (soia și roșiile, de exemplu) sunt, de asemenea, capabile să acumuleze bariu din sol de 2-20 de ori. Cu toate acestea, în zonele în care concentrația de bariu în apă este mare, apa potabilă poate contribui și la aportul total de bariu. Aportul de bariu din aer este neglijabil.
Pericol pentru sanatate.
În cursul studiilor epidemiologice științifice efectuate sub auspiciile OMS, nu au fost confirmate date privind relația dintre mortalitatea prin boli cardiovasculare și conținutul de bariu din apa potabilă. În studiile pe termen scurt efectuate la voluntari, nu a existat niciun efect advers asupra sistemului cardiovascular la concentrații de bariu de până la 10 mg/L. Adevărat, în experimentele pe șobolani, când aceștia din urmă consumau apă chiar și cu un conținut scăzut de bariu, s-a observat o creștere a tensiunii arteriale sistolice. Acest lucru indică pericolul potențial al creșterii tensiunii arteriale la oameni cu utilizarea prelungită a apei care conține bariu (USEPA are astfel de date).
Datele USEPA sugerează, de asemenea, că chiar și o singură băutură de apă care conține mult mai mult decât conținutul maxim de bariu poate duce la slăbiciune musculară și dureri abdominale. Totuși, este necesar să se țină cont de faptul că standardul de bariu stabilit de standardul de calitate USEPA (2,0 mg/l) depășește semnificativ valoarea recomandată de OMS (0,7 mg/l). Standardele sanitare rusești stabilesc o valoare MPC și mai strictă pentru bariu în apă - 0,1 mg/l. Tehnologii de îndepărtare a apei: schimb ionic, osmoză inversă, electrodializă.
Cu formula chimică BaSO 4 . Este o pulbere albă inodoră, insolubilă în apă. Albul și opacitatea sa, precum și densitatea sa ridicată definesc principalele sale aplicații.
Istoricul numelui
Bariul aparține metalelor alcalino-pământoase. Acestea din urmă sunt denumite astfel deoarece, conform lui D. I. Mendeleev, compușii lor formează o masă insolubilă a pământului, iar oxizii „au un aspect pământesc”. Bariul se găsește în natură sub formă de baritul mineral, care este sulfat de bariu cu diverse impurități.
A fost descoperit pentru prima dată de chimiștii suedezi Scheele și Hahn în 1774, ca parte a așa-numitului spate greu. De aici a venit numele mineralului (din grecescul „baris” – greu), iar apoi metalul în sine, când în 1808 a fost izolat în forma sa pură de Humphry Devi.
Proprietăți fizice
Deoarece BaSO4 este o sare a acidului sulfuric, proprietățile sale fizice sunt parțial determinate de metalul însuși, care este moale, reactiv și alb argintiu. Baritul natural este incolor (uneori alb) și transparent. BaSO 4 pur chimic are o culoare de la alb la galben pal, este neinflamabil, cu un punct de topire de 1580°C.

Care este masa sulfatului de bariu? Masa sa molară este de 233,43 g/mol. Are o greutate specifică neobișnuit de mare - de la 4,25 la 4,50 g/cm 3 . Având în vedere insolubilitatea sa în apă, densitatea sa mare îl face indispensabil ca umplutură pentru fluidele apoase de foraj.
Proprietăți chimice
BaSO4 este unul dintre cei mai puțin solubili compuși în apă. Poate fi obținut din două săruri foarte solubile. Luați o soluție apoasă de sulfat de sodiu - Na2SO4. Molecula sa din apă se disociază în trei ioni: doi Na + și unul SO 4 2-.
Na 2 SO 4 → 2Na + + SO 4 2-

Să luăm și o soluție apoasă de clorură de bariu - BaCl 2, a cărei moleculă se disociază în trei ioni: unul Ba 2+ și doi Cl - .
BaCl 2 → Ba 2+ + 2Cl -
Se amestecă o soluție apoasă de sulfat și un amestec care conține clorură. Sulfatul de bariu se formează ca urmare a combinării a doi ioni cu aceeași mărime și sarcină opusă într-o moleculă.
Ba 2+ + SO 4 2- → BaSO 4
Mai jos puteți vedea ecuația completă pentru această reacție (așa-numita ecuație moleculară).
Na2SO4 + BaCl2 → 2NaCl + BaS04

Ca rezultat, se formează un precipitat insolubil de sulfat de bariu.
Baritul marfă
În practică, materia primă pentru producția de sulfat de bariu comercial destinată utilizării în fluidele de foraj la forarea puțurilor de petrol și gaze este, de regulă, baritul mineral.
Termenul de barit „primar” se referă la produsele comerciale care includ materia primă (obținută din mine și cariere) precum și produse de îmbogățire simplă prin metode precum spălarea, decantarea, separarea în medii grele, flotarea. Majoritatea baritului brut trebuie aduse la o puritate și densitate minime. Mineralul care este folosit ca umplutură este măcinat și cernut la o dimensiune uniformă, astfel încât cel puțin 97% dintre particulele sale să aibă o dimensiune de până la 75 de microni și nu mai mult de 30% să aibă mai puțin de 6 microni. Baritul primar trebuie să fie, de asemenea, suficient de dens pentru a avea o greutate specifică de 4,2 g/cm3 sau mai mare, dar suficient de moale pentru a nu deteriora rulmenții.
Obținerea unui produs chimic pur
Baritul mineral este adesea contaminat cu diverse impurități, în principal oxizi de fier, care îl colorează în diferite culori. Se prelucreaza carbotermic (incalzit cu cocs). Rezultatul este sulfura de bariu.
BaSO 4 + 4 C → BaS + 4 CO
Acesta din urmă, spre deosebire de sulfat, este solubil în apă și reacționează ușor cu oxigenul, halogenii și acizii.
BaS + H2SO4 → BaS04 + H2S
Acidul sulfuric este utilizat pentru a obține un produs final de puritate ridicată. Sulfatul de bariu format prin acest proces este adesea denumit blancfix, care înseamnă „fix alb” în franceză. Se găsește adesea în produsele de consum, cum ar fi vopselele.

În condiții de laborator, sulfatul de bariu se formează prin combinarea ionilor de bariu și a ionilor de sulfat în soluție (vezi mai sus). Deoarece sulfatul este cea mai puțin toxică sare a bariului datorită insolubilității sale, deșeurile care conțin alte săruri de bariu sunt uneori tratate cu sulfat de sodiu pentru a lega tot bariul, care este destul de toxic.
De la sulfat la hidroxid și înapoi
Din punct de vedere istoric, baritul a fost folosit pentru a produce hidroxid de bariu, Ba(OH)2, necesar în rafinarea zahărului. Acesta este, în general, un compus foarte interesant și utilizat pe scară largă în industrie. Este foarte solubil în apă, formând o soluție cunoscută sub numele de apă barită. Este convenabil să se utilizeze pentru legarea ionilor de sulfat în diferite compoziții prin formarea de BaS04 insolubil.
Am văzut mai sus că atunci când este încălzit în prezența cocsului, este ușor să obțineți sulfură de bariu solubilă în apă - BaS din sulfat. Acesta din urmă, atunci când interacționează cu apa fierbinte, formează un hidroxid.
BaS + 2H2O → Ba(OH)2 + H2S
Hidroxidul de bariu și sulfatul de sodiu, luate în soluții, atunci când sunt amestecate, vor da un precipitat insolubil de sulfat de bariu și hidroxid de sodiu.
Ba(OH)2 + Na2S04 = BaS04 + 2NaOH

Se dovedește că sulfatul natural de bariu (baritul) este mai întâi transformat industrial în hidroxid de bariu, iar apoi servește la obținerea aceluiași sulfat la curățarea diferitelor sisteme de sare de ionii de sulfat. În același mod, reacția va avea loc și în timpul purificării ionilor SO 4 2- dintr-o soluție de sulfat de cupru. Dacă faceți un amestec de „hidroxid de bariu + sulfat de cupru”, rezultatul este hidroxid de cupru și sulfat de bariu insolubil.
CuSO 4 + Ba(OH) 2 → Cu(OH) 2 + BaSO 4 ↓
Chiar și în reacția cu acidul sulfuric însuși, ionii săi sulfat vor fi legați complet de bariu.
Utilizare în fluide de foraj
Aproximativ 80% din producția mondială de sulfat de bariu, barit purificat și măcinat, este consumată ca componentă a fluidelor de foraj în crearea puțurilor de petrol și gaze. Adăugarea acestuia crește densitatea fluidului injectat în puț pentru a rezista mai bine la presiunea ridicată a rezervorului și pentru a preveni erupțiile.
Atunci când o sondă este forată, bitul trece prin diverse formațiuni, fiecare având propriile caracteristici. Cu cât adâncimea este mai mare, cu atât procentul de barit trebuie să fie mai mare în structura soluției. Un avantaj suplimentar este acela că sulfatul de bariu este o substanță nemagnetică, deci nu interferează cu diferite măsurători în foraj folosind dispozitive electronice.
Industria vopselei și hârtiei
Cea mai mare parte din BaSO4 sintetic este folosit ca componentă a pigmentului alb pentru vopsele. Deci, blancfix amestecat cu dioxid de titan (TiO 2) este vândut ca o vopsea albă în ulei folosită în pictură.
Combinația de BaSO4 și ZnS (sulfură de zinc) dă un pigment anorganic numit litoponă. Este folosit ca strat de acoperire pentru anumite clase de hârtie fotografică.
Mai recent, sulfatul de bariu a fost folosit pentru a străluci hârtia destinată imprimantelor cu jet de cerneală.
Aplicații în industria chimică și metalurgia neferoasă
În producția de polipropilenă și polistiren, BaSO4 este folosit ca umplutură în proporții de până la 70%. Are efectul de a crește rezistența materialelor plastice la acizi și alcalii, precum și de a le conferi opacitate.

De asemenea, este folosit pentru a produce alți compuși de bariu, în special carbonatul de bariu, care este folosit pentru a face sticlă LED pentru ecrane de televiziune și computer (în mod istoric în tuburi catodice).
Formele utilizate în turnarea metalelor sunt adesea acoperite cu sulfat de bariu pentru a preveni aderența la metalul topit. Acest lucru se realizează la fabricarea plăcilor anodice de cupru. Ele sunt turnate în forme de cupru acoperite cu un strat de sulfat de bariu. Când cuprul lichid se solidifică într-o placă de anod finită, acesta poate fi îndepărtat cu ușurință din matriță.
dispozitive pirotehnice
Deoarece compușii de bariu emit lumină verde atunci când sunt arși, sărurile acestei substanțe sunt adesea folosite în formulele pirotehnice. Deși nitratul și cloratul sunt mai frecvente decât sulfatul, acesta din urmă este utilizat pe scară largă ca componentă în luminile pirotehnice stroboscopice.
agent de contrast cu raze X
Sulfatul de bariu este un agent radioopac folosit pentru a diagnostica anumite probleme medicale. Deoarece astfel de substanțe sunt opace la razele X (blochându-le ca urmare a densității lor mari), zonele corpului în care sunt localizate apar ca zone albe pe filmul cu raze X. Acest lucru creează distincția necesară între un organ (diagnosticat) și alte țesuturi (înconjurătoare). Contrastul va ajuta medicul să vadă orice afecțiuni speciale care pot exista în acel organ sau parte a corpului.

Sulfatul de bariu se ia pe cale orală sau rectală cu o clismă. În primul caz, face esofagul, stomacul sau intestinul subțire opace la razele X. Așa că pot fi fotografiați. Dacă substanța este administrată cu o clismă, atunci intestinul gros sau intestinele pot fi văzute și fixate cu raze X.
Doza de sulfat de bariu va fi diferită pentru diferiți pacienți, totul depinde de tipul de test. Medicamentul este disponibil sub formă de suspensie medicală specială de bariu sau sub formă de tablete. Diferite teste care necesită contrast și echipamente cu raze X necesită cantități diferite de suspensie (în unele cazuri, este necesar un medicament sub formă de tablete). Agentul de contrast trebuie utilizat numai sub supravegherea directă a unui medic.
COMPUȘI DE BARIU, în conformitate cu poziția bariului în subgrupa alcalino-pământoasă din grupa II a sistemului Mendeleev, au un ion Ba ∙∙ dublu încărcat (cu excepția peroxidului de bariu BaO 2). Compușii de bariu se caracterizează printr-o greutate specifică ridicată, incoloritate dacă anionii nu sunt colorați, o culoare verde a flăcării și o cantitate mică de compuși complecși. Din punct de vedere tehnic, cele mai importante sunt oxidul și peroxidul, sărurile insolubile: carbonatul de bariu, sulfatul și acidul cromic și sărurile solubile: nitratul de bariu, clorura de bariu etc. Sărurile solubile ale bariului sunt otrăvitoare. Cantitativ, bariul se determină sub formă de BaS04, dar având în vedere finețea extremă a precipitatelor obținute la temperaturi scăzute, este necesar să se efectueze precipitarea dintr-o soluție clocotită ușor acidulată cu acid clorhidric. Dacă există acid azotic în soluție, o parte din precipitat intră în soluție. În plus, precipitatul de BaS04 poate transporta o parte din săruri datorită adsorbției. Pentru a se separa de stronţiu, bariul este precipitat ca BaSiF6. Dacă compușii de bariu sunt insolubili, atunci se topesc cu carbonat de potasiu-sodiu și, după spălarea aliajului cu apă, se dizolvă în acid. Compușii de bariu se găsesc cel mai frecvent ca baritul mineral; mult mai rar este witherita - carbonat de bariu.
Oxid de bariu BaO- solid alb, cristalizează în cuburi, densitate 5,72-5,32, punct de topire 1580 °, formează un hidrat cristalin după formula:
BaO + 9H 2 O \u003d Ba (OH) 2 ∙ 8H 2 O.
Oxidul de bariu este relativ bine solubil: la 0° - 1,5 ore în 100 de ore de apă; la 10° - 2,2 ore, la 15° - 2,89 ore, la 20° - 3,48 ore, la 50° - 11,75 ore, la 80° - 90,77 ore.Oxidul de bariu se obţine din azotat de bariu prin calcinare; astfel rezultă un produs poros adecvat pentru fabricarea peroxidului din acesta. Încălzirea se realizează în creuzete, într-un cuptor cu mufă, la început foarte atent pentru ca creuzetele să nu spargă. Eliberarea oxizilor de azot începe după 4 ore, dar pentru îndepărtarea lor finală creuzetele sunt aprinse câteva ore la căldură albă (oxizii de azot cu 30% pot fi folosiți pentru obținerea acidului azotic). Produsul este foarte scump, deoarece scump: materialul de pornire, creuzetele care sunt bune doar pentru o singură dată, combustibilul etc. Extragerea oxidului de bariu din witherită (BaCO 3 \u003d BaO + CO 2) este mult mai dificilă decât arderea varului, pentru a • adăugarea inversă a CO 2 are loc foarte uşor; prin urmare, cărbunele este amestecat cu witherit, astfel încât CO 2 trece în CO. Dacă este de dorit să se obțină un produs poros, atunci este necesar să se respecte cu strictețe temperatura de ardere. Pentru a preveni sinterizarea, se adaugă adesea nitrat de bariu, cărbune, gudron sau carbură de bariu, adică.
ВаСО 3 + Ba(NO 3) 2 + 2С = 2ВаО + 2NO 2 + 3СО
ЗВаСО 3 + ВаС 2 = 4ВаО + 5СО.
În plus, este necesar să se protejeze produsul cât mai mult posibil de sinterizarea cu pereții creuzetului și de influența gazelor fierbinți. Calcinarea în cuptoarele cu ax oferă un produs foarte pur (95%) dacă cuptorul este construit din material de înaltă calitate și încălzirea se realizează cu gaz generator, ceea ce permite un control precis al temperaturii. În Italia se folosește încălzirea în cuptoare electrice, dar, se pare, aceasta produce „oxicarbid” și „bariu”, care, pe lângă 80-85% oxid de bariu, conține 10-12% carbură și 3-5% cianură de bariu.
Oxid de bariu apos, barit caustic Ba (OH) 2 , formează cristale monoclinice transparente
Va (OH) 2 ∙ 8H 2 0,
pierderea ultimei molecule de apă numai la căldură roșu închis; cu căldură roșie deschisă se obține BaO, iar cu incandescență într-un curent de aer se obține peroxid de bariu. O soluție de bariu caustic - un alcali puternic - absoarbe CO 2 din aer, formând CaCO 3 insolubil. 100 g de soluție conține: la 0 ° - 1,48 g de BaO, la 10 ° - 2,17, la 15 ° - 2,89, la 20 ° - 3,36, la 50 ° - 10,5, la 80 ° - 4,76. Baritul caustic este folosit pentru a absorbi CO 2, extrage alcaline caustice din sulfați, extrage zahăr din melasă etc. Baritul caustic poate fi obținut prin calcinarea witheritei prin trecerea vaporilor de apă, dar este mai ușor să ardeți BaCO 3 și să acționați asupra BaO cu apă; sau un amestec de 60% BaO și 40% BaS, obținut prin calcinarea BaSO 4 cu cărbune, se dizolvă în apă, iar Ba (OH) 2 se obține nu numai din BaO, ci și dintr-o parte semnificativă de BaS datorită hidrolizei:
2BaS + 2HOH = Ba(OH)2 + Ba(SH)2.
Substanța cristalizată conține doar 1% impurități. Vechile metode de adăugare a oxizilor de fier sau zinc la BaS nu mai sunt folosite. De asemenea, se propune obţinerea baritului caustic prin electroliza clorurii de bariu sau cloratului şi percloratului de bariu în prezenţa unui precipitat de BaC03, care este dizolvat de acidul format la anod.
Peroxid de bariu BaO2 - intercreșteri albe, sidefate ale celor mai mici cristale, foarte puțin solubile în apă (doar 0,168 ore la 100 ore de apă). Pentru a obține peroxid, oxidul de bariu se încălzește în tuburi înclinate sau în mufe speciale, care pot fi păstrate cu precizie la temperatura dorită (500-600 °), iar aerul este purificat de CO 2 și umiditatea este suflată. Cel mai pur peroxid se obține sub formă de cristale pătrate de BaO 2 ∙ 8H 2 O, pentru care peroxidul tehnic este mai întâi triturat cu apă, transferat într-o soluție prin adăugarea de acid clorhidric slab și precipitat cu o soluție de barit caustic, sau pur și simplu se adaugă De 10 ori mai multă soluție de barit 8%. Cel mai pur peroxid este o masă sinterizată cenușiu-verzuie, insolubilă în apă, dar care interacționează cu anhidrida carbonică. Când este încălzit, BaO2 se descompune în BaO și oxigen. Elasticitatea oxigenului peste BaO 2 la 555 ° - 25 mm, la 790 ° - 670 mm. Pulberea de peroxid poate aprinde materiale fibroase. La vânzare sunt: cel mai bun grad - cu 90% BaO 2 și media - cu 80-85%, impuritatea principală fiind BaO. Conținutul de BaO 2 se determină prin titrare cu o soluție 1/10 N-a de KMnO 4 de BaO 2 în acid clorhidric foarte slab rece (gravitate specifică 1,01-1,05), având în prealabil precipitați ionii de bariu cu acid sulfuric slab. De asemenea, este posibilă titrarea peroxidului de bariu izolat din iodură de potasiu cu sulfat de iodură de sodiu. Peroxidul de bariu este folosit pentru a produce peroxid de hidrogen (și, în același timp, pentru a obține „blancfix”) mai puternic albi, și pentru a prepara dezinfectanți.
Nitrit de bariu Ba (NO 2) 2 ∙ H 2 O - prisme hexagonale incolore hexagonale, punct de topire 220°. La 0° în 100 de ore de apă se dizolvă 58 de ore, la 35° - 97 de ore.Se obține prin adăugarea unei soluții de nitrit de sodiu (360 ore de 96% NaNO2 în 1000 ore de apă) la un amestec de 360 ore de NaN02 şi 610 ore BaCl2. La o temperatură ridicată, NaCl cristalizează, cu răcire suplimentară - Ba (NO 2) 2.
Nitrat de bariu Ba (NO 3) 2 - octaedre transparente incolore, se topesc la 375°; în 100 de ore de apă sunt solubile la 10 ° - 7 ore, la 20 ° - 9,2 ore, la 100 ° - 32,2 ore.La încălzire, trece mai întâi în nitritul de bariu, iar apoi în oxid de bariu. Se foloseste: 1) pentru prepararea peroxidului de bariu, 2) pentru lumini verzi la artificii, 3) pentru unii explozivi. Se produce: 1) prin descompunere prin schimb atunci când se adaugă o cantitate teoretică de azotat de sodiu la o soluție fierbinte de clorură de bariu (30 ° V) și recristalizare ulterioară, 2) prin interacțiunea witheritei sau sulfurei de bariu cu acid azotic, 3) prin încălzirea azotatului de calciu cu carbonat de bariu tehnic.
Permanganat de bariu - verdeata de mangan, verdeata Kassel, verdeata rosenstiel. BaMnO 4 - vopsea verde durabilă potrivită pentru pictura în frescă; obtinut prin calcinarea unui amestec de compusi ai bariului (barit caustic, azotat de bariu sau peroxid de bariu) si mangan (dioxid sau oxid).
sulfură de bariu BaS - masa poroasa cenusie, usor de oxidat si atrage anhidrida carbonica si apa; se descompune cu apa. Este folosit pentru fabricarea majorității compușilor de bariu (litopon, văruire puternică etc.), pentru extragerea zahărului din melasă și forfecarea lânii din piei (depilatoriu). Pentru minerit, folosesc calcinarea unui amestec de spate greu cu cărbune la 600-800 °:
BaSO 4 + 2C = 2CO 2 + BaS,
în timp ce la o temperatură mai mare se irosește de două ori mai mult cărbune. Condiția principală este contactul strâns dintre cărbune și spar, care se realizează prin măcinarea spate cu 30-37% cărbune și apă în mori rotative. Cuptoarele sunt arse în cuptoare rotative, cum ar fi cele utilizate pentru producția de ciment sau sodă, cu o cameră prăfuită în spatele cuptoarelor scurte pentru a depune fum și funingine. Produsul rezultat conține 60-70% substanțe solubile în apă, 20-25% - solubile în acizi și 5% reziduuri. Produsul rezultat este aruncat fierbinte în apă sau într-o soluție apoasă de 1-2% NaOH (36 ° B), unde jumătate trece în oxid apos de Ba (OH) 2, iar cealaltă în Ba (SH) 2 hidrosulfuros. Această soluție este utilizată direct pentru prepararea compușilor de bariu (litopon, etc.) sau pentru extracția zahărului. Când reziduul reacţionează cu acidul clorhidric, se obţine clorură de bariu. La fabricile de tip vechi, calcinarea se efectuează în retorte de argilă, acoperite uniform de flacără. Plăcile bine uscate de cărbune și spate amestecate cu apă sunt încărcate în retorte. De îndată ce flăcările monoxidului de carbon arzând dispar, plăcile sunt îndepărtate astfel încât să cadă în cutii de fier închise ermetic.
Sulfat de bariu BaS 2 O 3 ∙ H 2 O Se formează din sulfură de bariu: 1) cu acces liber al aerului și 2) cu descompunere prin schimb cu sulfat de sodiu. Este folosit pentru stabilirea titrurilor în timpul iodometriei.
Sulfat de bariu BaSO4 , spart greu („puternic”, „mineral”, „nou”, etc. văruire), pulbere albă pură, pământoasă, foarte grea, practic insolubilă în apă și acizi (solubilitate: la 18 ° în 1 litru de apă - 2 . 3 mg). Natural se macină direct. Cele mai bune soiuri incolore se numesc spart „floare”; ultramarinul se adaugă la gălbui și roz. Uneori, spatul greu este măcinat și încălzit cu acid clorhidric pentru a îndepărta fierul; sau spar este topită cu Na 2 SO 4 și separat de aliaj prin acțiunea apei. Artificial se obţine: 1) ca deşeu la prepararea peroxidului de hidrogen; 2) din clorură de bariu prin interacţiune: a) cu acid sulfuric, care dă un precipitat precipitat rapid, b) cu sulfură de sodiu Na 2 SO 4 sau cu sare de sulfură de magneziu MgSO 4 , care dă o pulbere cu cădere lentă şi cu acoperire mare; în timpul producției, este important să curățați acidul sulfuric curat; 3) din witherit; daca este foarte pur, poate fi macinat direct prin actiunea H2SO4, dar cu adaos de HCl 2%; dacă witherita conține impurități, se dizolvă mai întâi în acid clorhidric și apoi se precipită. Sulfatul de bariu este folosit de Ch. arr. pentru colorarea tapetului hartiei colorate, cartonului si in special pentru hartii fotografice, pentru vopsele usoare in ulei si vopsele lac din carbune, la fabricarea fildesului si cauciucului artificial, pentru amestecarea cu alimentele introduse in stomac in timpul radiografiei.
Carbonat de bariu BaCO 3 - witherit mineral (cristale rombice) sau obtinut artificial sub forma celui mai mic sediment (gravitate specifica 4,3); mai greu de disociat la calcinare decât CaCO3; la 1100° presiunea CO 2 este de numai 20 mm. Este folosit pentru extragerea altor compuși de bariu, la fabricarea cărămizilor și a teracotei, a porțelanului, a marmurei artificiale și a cristalului de barit. Se prepară artificial: 1) dintr-o soluţie brută de sulfură de bariu prin injectarea de anhidridă carbonică; 2) încălzirea sulfatului de bariu cu potasiu la presiune de 5 atm; 3) la descompunerea zaharatului de bariu cu anhidridă carbonică.
Acetat de bariu Ba (C 2 H 3 O 2) 2 ∙ H 2 O - cristale usor solubile folosite in vopsire; sunt produse prin interacțiunea sulfurei sau carbonatului de sodiu cu acidul acetic.
Fluorura de bariu BaF 2 - pulbere albă, ușor solubilă în apă, se topește la 1280°, obținută prin dizolvarea carbonatului de bariu sau causticului în HF sau fierbere criolit cu oxid de bariu apos.
Clorura de bariu l 2 ∙ 2Н 2O- plăci rombice plate incolore (gravitate specifică 3,05), stabile în aer, gust acru, otrăvitoare; atunci când este încălzit, este relativ ușor să pierdeți prima particulă de apă și mult mai dificil să pierdeți a doua; BaCl2 anhidru dreapta. sistemul se topește la 962°. 100 de ore de soluție conțin sare anhidră:
ВаСl 2 este utilizat pentru fabricarea albului „durabil” și pentru transformarea vitriolului conținut în produsele ceramice în BaSO4 insolubil; se extrage din barit prin calcinarea cu cărbune și clorură de calciu în cuptoare cu sifon la 900-1000 ° în flacără reducătoare și se poate folosi și o soluție de clorură de calciu 70%, dar clorura de calciu solidă este mai bună:
BaSO 4 + 4C \u003d BaS + 4CO;
BaS + SaSl 2 \u003d TUl 2 + CaS.
Produs corespunzător, se obține un produs poros aproape negru cu 50-56% BaCl2. După leșierea sistematică, sarea se cristalizează (în prealabil se trece un jet de anhidridă carbonică) până când hidrogenul sulfurat este complet îndepărtat și evaporat în vase lăcuite în interior. Cristalele sunt separate prin centrifugare. Dacă este nevoie de BaCl2 anhidru, atunci sarea este încălzită în vase cu agitatoare pentru a obține cristale foarte mici, care sunt apoi calcinate și se obține 95% BaCl2. Este posibil să se obțină BaCl 2 prin adăugarea de pulbere de BaS la acidul clorhidric în vase închise, de unde este necesar să se îndepărteze hidrogenul sulfurat eliberat în conducta fabricii sau să o ardă la SO 2 folosind acesta din urmă pentru acid sulfuric. Desigur, este mult mai avantajos să acționezi cu acid clorhidric asupra BaCO3.
Clorat de bariu Ba(C lO 3) 2 ∙ H 2O- prisme monoclinice, foarte solubile la rece si chiar mai bune in apa calda. Explodează cu ușurință când este încălzit și la impact dacă este amestecat cu o substanță combustibilă. Este folosit în pirotehnică pentru flăcări verzi. Este produs prin electroliza la 75° a unei soluții saturate de BaCl 2 , cu un anod de platină și un catod de grafit.
BARIUL (Bariu latinesc), Ba, un element chimic din grupa II a formei scurte (grupa 2 a formei lungi) a sistemului periodic; se referă la metale alcalino-pământoase; numărul atomic 56, masa atomică 137,327. În natură sunt 7 nuclizi stabili, dintre care predomină 138 Ba (71,7%); aproximativ 30 de nuclizi au fost obţinuţi artificial.
Referință istorică. Bariul sub formă de oxid a fost descoperit în 1774 de K. Scheele, care a descoperit un „pământ” necunoscut anterior, numit mai târziu „pământ greu” – baritul (din grecescul βαρ?ς – greu). În 1808, G. Davy a obținut bariu metalic sub formă de amalgam prin electroliza sărurilor topite.
Distribuție în natură. Conținutul de bariu din scoarța terestră este de 5,10 -2% în greutate. Datorită activității sale chimice ridicate, nu apare sub formă liberă. Principalele minerale sunt baritul BaSO 4 și witherita BaSO 3 . Producția mondială de BaSO4 este de aproximativ 6 milioane de tone/an.
Proprietăți. Configurația învelișului electron exterior al atomului de bariu este 6s 2 ; în compuși prezintă o stare de oxidare de +2, rar +1; Electronegativitatea Pauling 0,89; raza atomică este de 217,3 nm, raza ionului Ba 2+ este de 149 pm (numărul de coordonare 6). Energia de ionizare Ba 0 → Ba + → Ba 2+ 502,8 și 965,1 kJ / mol. Potențialul standard al electrodului unei perechi de Ba 2+ / Ba într-o soluție apoasă este de -2,906 V.
Bariul este un metal maleabil alb argintiu; t pl 729 °С, t ΚИΠ 1637 °С. La presiune normală, rețeaua cristalină a bariului este cubică centrată pe corp; la 19 °C și 5530 MPa, se formează o modificare hexagonală. La 293 K, densitatea bariului este de 3594 kg/m 3 , conductivitatea termică este de 18,4 W/(m·K), rezistența electrică este de 5·10 -7 Ohm·m. Bariul este paramagnetic; susceptibilitate magnetică specifică 1,9·10 -9 m 3 /kg.
Bariul metalic se oxidează rapid în aer; se păstrează în kerosen sau sub un strat de parafină. Bariul reacţionează la temperatura obişnuită cu oxigenul, formând oxid de bariu BaO, iar cu halogenii, formând halogenuri. Prin calcinarea BaO într-un curent de oxigen sau aer la 500°C se obține peroxidul BaO2 (se descompune în BaO la 800°C). Reacțiile cu azot și hidrogen necesită încălzire; produșii de reacție sunt nitrură de Ba 3 N 2 și hidrură de BaH 2. Bariul reacționează cu vaporii de apă chiar și la frig; se dizolvă energic în apă, dând hidroxid de Ba (OH) 2, care are proprietățile alcaline. Bariul formează săruri cu acizii diluați. Dintre cele mai utilizate săruri de bariu, solubile în apă: clorură BaCl 2 și alte halogenuri, azotat Ba (NO 3) 2, clorat Ba (ClO 3) 2, acetat Ba (OOCH 3) 2, sulfură BaS; slab solubil - sulfat BaS0 4, carbonat BaCO 3, cromat BaCrO 4. Bariul reduce oxizii, halogenurile și sulfurile multor metale la metalul corespunzător. Bariul formează aliaje cu majoritatea metalelor, uneori aliajele conțin compuși intermetalici. Astfel, BaAl, BaAl 2 , BaAl 4 au fost găsite în sistemul Ba-Al.
Sărurile de bariu solubile sunt toxice; BaSO4 practic netoxic.
chitanta. Principala materie primă pentru producerea bariului este concentratul de baritic (80-95%) BaSO 4 , care se reduce cu cărbune, cocs sau gaz natural combustibil; sulfura de bariu rezultată este procesată în alte săruri ale acestui element. Prin calcinarea compușilor de bariu se obține BaO. Bariul metalic pur comercial (96-98% în greutate) se obține prin reducerea termică a oxidului de BaO cu pulbere de Al. Prin distilare în vid, bariul este purificat până la un conținut de impurități mai mic de 10-4%, prin topire pe zonă - până la 10-6%. O altă metodă de obținere a bariului din BaO este electroliza unei topituri de oxid. Cantități mici de bariu se obțin prin reducerea berilatului BaBeO 2 la 1300 ° C cu titan.
Aplicație. Bariul este folosit ca dezoxidant pentru cupru și plumb, ca aditiv la aliajele antifricțiune, metalele feroase și neferoase, precum și la aliajele folosite la fabricarea fonturilor tipografice în scopul creșterii durității acestora. Aliajele bariu-nichel sunt folosite pentru a face electrozi pentru bujii în motoarele cu ardere internă și tuburile radio. Un aliaj de bariu cu aluminiu - alba, care contine 56% Ba, baza getter-urilor. Bariu metal - material pentru anozi în sursele de curent chimic. Partea activă a majorității catozilor termoionici este oxidul de bariu. Peroxidul de bariu este folosit ca oxidant, înălbitor, în pirotehnică; anterior a fost folosit pentru regenerarea oxigenului din CO 2 . Hexaferita de bariu BaFe 12 O 19 este un material promițător pentru utilizarea în dispozitivele de stocare a informațiilor; BaFe 12 O 19 este folosit pentru a face magneți permanenți. BaSO4 este introdus în fluidele de foraj în timpul producției de petrol și gaze. Titanatul de bariu BaTiO 3 este unul dintre cei mai importanți feroelectrici. Nuclidul 140 Va (emițător β, T 1/2 12,8 zile) este un trasor izotop utilizat pentru studiul compușilor de bariu. Deoarece compușii de bariu absorb bine razele X și radiațiile γ, ei sunt introduși în compoziția materialelor de protecție pentru instalațiile de raze X și reactoarele nucleare. BaSO4 este utilizat ca agent de contrast pentru studiile cu raze X ale tractului gastrointestinal.
Lit. : Akhmetov TG Chimia și tehnologia compușilor de bariu. M., 1974; Tretiakov Yu.D. etc.Chimie anorganică. M., 2001.
D. D. Zaitsev, Yu. D. Tretiakov.
În 1808, Davy Humphrey a obținut bariu sub formă de amalgam prin electroliza compușilor săi.
Chitanță:
În natură, formează mineralele barita BaSO 4 și witherita BaCO 3 . Obținut prin aluminotermie sau descompunerea azidei:
3BaO+2Al=Al2O3+3Ba
Ba(N 3) 2 \u003d Ba + 3N 2
Proprietăți fizice:
Un metal alb argintiu cu un punct de topire și de fierbere mai mare și cu o densitate mai mare decât metalele alcaline. Foarte moale. Tm. = 727°C.
Proprietăți chimice:
Bariul este cel mai puternic agent reducător. În aer, devine rapid acoperit cu o peliculă de oxid, peroxid și nitrură de bariu, se aprinde atunci când este încălzit sau pur și simplu zdrobit. Interacționează puternic cu halogenii, atunci când este încălzit cu hidrogen și sulf.
Bariul reacționează energic cu apa și acizii. Depozitați, ca și metalele alcaline, în kerosen.
În compuși, prezintă o stare de oxidare de +2.
Cele mai importante conexiuni:
oxid de bariu. Un solid care reacționează puternic cu apa pentru a forma hidroxid. Absoarbe dioxidul de carbon, transformându-se în carbonat. Când este încălzit la 500 ° C, reacţionează cu oxigenul pentru a forma peroxid
peroxid de bariu BaO 2 , substanță albă, slab solubilă, agent oxidant. Folosit în pirotehnică, pentru a produce peroxid de hidrogen, înălbitor.
hidroxid de bariu Ba(OH)2, Ba(OH)2 octahidrat *8H20, incolor. cristal, alcali. Folosit pentru a detecta ionii de sulfat și carbonat, pentru a purifica grăsimile vegetale și animale.
săruri de bariu cristale incolore. substante. Sărurile solubile sunt foarte toxice.
Clorură bariul se obține prin interacțiunea sulfatului de bariu cu cărbunele și clorura de calciu la 800°C - 1100°C. Reactiv pentru ion sulfat. folosit în industria pielăriei.
Nitrat bariu, azotat de bariu, o componentă a compozițiilor pirotehnice verzi. Când este încălzit, se descompune formând oxid de bariu.
Sulfat bariul este practic insolubil în apă și în acizi, prin urmare este ușor toxic. folosit pentru albirea hârtiei, pentru fluoroscopie, umplutură de beton barit (protecție împotriva radiațiilor radioactive).
Aplicație:
Bariul metalic este folosit ca componentă a unui număr de aliaje, un dezoxidant în producția de cupru și plumb. Sărurile de bariu solubile sunt otrăvitoare, MPC 0,5 mg/m 3 . Vezi si:
SI. Venetsky Despre rare și împrăștiate. Povești de metal.