Lantanul (Lanthanum, La) este un element chimic la numărul 57 în tabelul periodic.
Un loc aparte între elementele chimice îl ocupă această „familie”, interconectată printr-o asemănare excepțională de proprietăți. Numele lor învechit este elementele pământurilor rare (REE). Interesul pentru ele a crescut semnificativ după punerea în funcțiune a primelor reactoare atomice, în timpul cărora aceste elemente se formează ca produse secundare.
Acest element a fost ascuns chimiștilor iscoditori pentru o perioadă foarte lungă de timp, pentru care a primit numele de lanthanum („lantano” în greacă „mă ascund”, „ascuns”). A fost descoperit de chimistul suedez Mozander în 1839. De mai bine de o sută de ani, lantanul a fost un element greu accesibil nu doar pentru industrie, ci și pentru laboratorul de chimie. În forma sa pură, lantanul (și compușii săi) a fost obținut numai după așa-numita analiză cromatografică, dezvoltată de omul de știință rus M. S. Tsvet în 1903, a intrat ferm în practica laboratoarelor și a întreprinderilor industriale.
Esența acestei metode în termenii cei mai generali este următoarea. Soluția de testat este trecută printr-un tub umplut cu o pulbere necolorată sau o substanță cu granulație fină care are capacitatea de a reține (adsorb) particulele altor substanțe pe suprafața sa.
Substantele incluse in amestec, in functie de gradul de adsorbtie al acestora pe suprafata absorbantului (adsorbantului), vor fi amplasate la diferite niveluri ale inaltimii acestuia in tub (coloana). Dacă soluția constă dintr-un amestec de substanțe colorate (MS Tsvet a lucrat cu astfel de soluții la un moment dat), atunci, datorită capacității lor diferite de absorbție, acestea sunt reținute în diferite părți ale adsorbantului, colorându-l în culoarea corespunzătoare substanței date. .
Astfel, părțile constitutive ale amestecului sunt separate. Masa adsorbantului pe toată lungimea sa în tub, în conformitate cu culoarea substanței reținute, va avea culori diferite sau nuanțe diferite de aceeași culoare (în funcție de culorile părților constitutive ale amestecului). Coloana rezultată de adsorbant colorat se numește cromatogramă (din grecescul „crom” - vopsea, culoare și „grapho" - scriu eu). Pentru a izola componentele amestecului, coloana de adsorbant este îndepărtată cu grijă din tub și împărțită în zone de culoare. Compoziția fiecărei zone colorate este determinată prin metode convenționale de analiză chimică. Este destul de clar că analiza nu prezintă nicio dificultate atunci când în fiecare zonă este prezentă o singură substanță. Cu toate acestea, în majoritatea cazurilor, zonele adsorbantului colorat nu diferă atât de puternic una de cealaltă încât să poată fi separate mecanic cu ușurință. De obicei, zonele sunt combinate și trec treptat una în alta. În aceste cazuri, tubul care conține adsorbantul cu substanțele reținute pe acesta este spălat cu un solvent special selectat, care se raportează diferit la constituenții adsorbiți ai amestecului. Această metodă de extragere a substanței adsorbite din adsorbant se numește eluție (din latinescul „elutio” – spălare). Eluția face posibilă utilizarea nu numai a diferenței de adsorbabilitate a părților constitutive ale amestecului, ci și a solubilității acestora.
Lantanul și compușii săi prezintă o asemănare foarte mare cu o serie de alte elemente foarte asemănătoare cu lantanul.
Numărul de „rude” ale lantanului este cunoscut. Sunt 14. Din lantan, ca fiind cel mai bine studiat, toate sunt combinate într-un singur grup, într-o singură celulă a sistemului Mendeleev sub numele familiei lantanidelor.
Marea asemănare a proprietăților chimice ale lantanidelor este asociată cu structura specială a învelișurilor de electroni ale atomilor acestor elemente, de la lantan până la lutețiu inclusiv. Această structură specială duce la faptul că pe măsură ce numărul ordinal al elementului crește, raza atomică nu crește (comprimarea lantanidelor). Acest fenomen explică o asemenea mare similitudine chimică a tuturor lantanidelor.
După ce sărurile pure de lantan au fost izolate, obținerea lantanului în sine nu a mai fost dificilă. De exemplu, lantanul metal a fost obținut prin electroliza clorurii de lantan, care în comportamentul său chimic seamănă cu calciul metalului. Lantanul este asemănător ca duritate cu staniul (densitate 6,2), punctul său de topire este de numai 915-925°C, dar punctul de fierbere este surprinzător de ridicat (4515°C). Ca multe metale active, descompune apa, reacționează bine cu acizii și, atunci când este încălzit puternic cu clor, sulf și alți metaloizi, adică prezintă proprietățile unui metal tipic.
Lantanul este un metal „autoprotector”: în aer uscat, este acoperit cu o peliculă subțire de oxid, care îl protejează de oxidarea ulterioară. Dar o astfel de „protecție” are loc numai în aer uscat, umiditatea se combină cu acest film și formează o bază puternică.
Am menționat în mod repetat un metal atât de important precum aluminiul și am subliniat, în special, capacitatea sa de a arde cu eliberarea unei cantități mari de căldură. Pe această reacție se bazează multe procese diferite. În lantan, căldura de reacție a combinației cu oxigenul este și mai mare. De îndată ce au învățat cum să obțină lantan în cantități mari, acesta a început să concureze cu aluminiul în metalurgie. Pentru a elimina oxigenul din oțelul lichid, adesea nu aluminiul este introdus în el, ci lantanul. Este necesar doar un kilogram din acest „dezoxidant” pe tonă de oțel, deoarece substanțele care eliberează oțelul de oxigen sunt numite în tehnologie. Milioane de tone de oțel au fost deja prelucrate în acest mod și ei spun că aceasta este o metodă excelentă de a-i îmbunătăți calitatea.
Lantanul a fost obținut în amestec cu ceriu, un alt membru al familiei lantanidelor, într-un raport de aproximativ 1:1. Prin topirea unui amestec din aceste metale cu fierul, au obținut ... „flent”, care a fost utilizat pe scară largă la brichetele de buzunar. Desigur, „flent” fier-ceriu-lantan nu are nimic de-a face cu piatra naturală de silex - un compus de siliciu. Acest nume a fost dat aliajului pentru capacitatea de a „sclipi” atunci când frecați o roată de oțel zimțată pe el. Această abilitate a fost folosită nu numai în brichete inofensive, ci și în obuzele de artilerie. După ce am furnizat proiectilului o duză din acest „metal mixt”, am avut ocazia să observăm proiectilul în zbor. „Metal mixt” scântei când zboară în aer. În acest caz, rolul roții brichetei este jucat de aerul însuși, frecându-se de metal.
Compușii de lantan sunt utilizați la fabricarea sticlei pentru cele mai bune lentile de cameră și ochelari speciali de siguranță. Într-un aliaj cu magneziu, lantanul este folosit la fabricarea pieselor de motoare aeronave.
Este curios că planta familiară afinul este un fel de „depozit” de lantan, a cărui cenușă conține până la 0,17% oxid de lantan. Există mult lantan în cenușa mesteacănilor de Karelia subdimensionați.
DEFINIȚIE
Lantan este situat în a șasea perioadă a grupei III a subgrupului principal (A) al Tabelului Periodic.
aparține familiei f-elemente. Metal. Denumirea - La. Număr ordinal - 57. Masa atomică relativă - 138,906 a.m.u. Lantanul este un metal cu pământuri rare. Toate au o structură similară, prin urmare, sunt separate într-un grup separat de elemente, care se numește lantanide.
Structura electronică a atomului de lantan
Atomul de lantan este format dintr-un nucleu încărcat pozitiv (+57), în interiorul căruia se află 57 de protoni și 82 de neutroni, iar 57 de electroni se mișcă în șase orbite.
Fig.1. Structura schematică a atomului de lantan.
Distribuția electronilor în orbitali este următoarea:
57La) 2) 8) 18) 18) 9) 2 ;
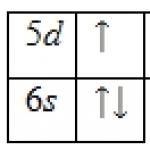
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 0 5s 2 5p 6 5d 1 6s 2 .
Nivelul de energie exterior al atomului de lantan conține 3 electroni, care sunt valență. Diagrama energetică a stării fundamentale ia următoarea formă:

Electronii de valență ai atomului de lantan pot fi caracterizați printr-un set de patru numere cuantice: n(cuantumul principal), l(orbital), m l(magnetic) și s(a învârti):
|
subnivel |
||||
Exemple de rezolvare a problemelor
EXEMPLUL 1
Cel mai semnificativ lucru despre elementul #57 este, fără îndoială, că conduce în rândurile celor 14 lantanide - elemente cu proprietăți extrem de asemănătoare. Lantanul și lantanidele sunt întotdeauna împreună: în minerale, în înțelegerea noastră, în metal. La Expoziția Mondială de la Paris din 1900, au fost demonstrate pentru prima dată mostre ale unora dintre presupusele lantanide pure. Dar nu există nicio îndoială că în fiecare probă, indiferent de etichetă, existau lantan, ceriu, neodim cu praseodim, iar cele mai rare dintre lantanide - tuliu, holmiu, lutețiu. Cel mai rar, cu excepția celui „disparut” și recreat în reacțiile nucleare elementul nr. 61 - prometiu. Cu toate acestea, dacă prometiu ar avea izotopi stabili, ar fi prezent și în orice probă din orice element de pământ rar.
Abia în ultimele decenii dezvoltarea științei și tehnologiei a atins un nivel la care omenirea a putut să-și pună în slujba calitățile individuale ale fiecăreia (sau aproape fiecăruia) dintre lantanide, deși, ca și până acum, una dintre cele mai populare și Cele mai ieftine produse din pământuri rare rămân mischmetal - „aliaj natural” de lantan și lantanide... Prin urmare, ar fi logic să dedicăm doar jumătate din această poveste direct elementului nr. 57, iar cealaltă jumătate „echipei” de pământuri rare, ca un întreg *. Desigur, fiecare dintre lantanide - ca individ chimic - merită o poveste independentă; aici – despre „liderul” lor și despre ceea ce este comun tuturor.
* Pe lângă lantan și lantanide, elementele pământurilor rare includ scandiu și ytriu.
Lantan fără lantanide
Indiferent cât de trist este să realizezi, eroul poveștii noastre este o persoană complet obișnuită. Acesta este un metal obișnuit în aspect (alb-argintiu, acoperit cu o peliculă de oxid cenușiu) și în proprietăți fizice: punctul de topire 920, punctul de fierbere 3469 ° C; în ceea ce privește rezistența, duritatea, conductibilitatea electrică și alte caracteristici, lantanul metalic ajunge întotdeauna în mijlocul meselor. Lantanul este, de asemenea, comun în proprietățile chimice. În aer uscat, nu se schimbă - filmul de oxid protejează în mod fiabil împotriva oxidării în vrac. Dar dacă aerul este umed (și în condiții terestre obișnuite este aproape întotdeauna umed), lantanul metalic este oxidat treptat la hidroxid. La(OH)3 este o bază de rezistență medie, care este din nou tipică unui metal „de mijloc”.
Ce se mai poate spune despre proprietățile chimice ale lantanului? În oxigen, atunci când este încălzit la 450 ° C, arde cu o flacără strălucitoare (în acest caz, se eliberează destul de multă căldură). Dacă este calcinat în atmosferă de azot, se formează nitrură neagră. În clor, lantanul se aprinde la temperatura camerei, în timp ce reacţionează cu bromul şi iodul numai când este încălzit. Se dizolvă bine în acizi minerali, nu reacționează cu soluțiile alcaline. În toți compușii, lantanul prezintă o valență de 3+. Într-un cuvânt, un metal este ca un metal - atât din punct de vedere al proprietăților fizice, cât și al proprietăților chimice.
Poate singura caracteristică distinctivă a lantanului este natura interacțiunii sale cu hidrogenul. Reacția dintre ele începe deja la temperatura camerei și continuă cu eliberarea de căldură. Se formează hidruri de compoziție variabilă, deoarece, în același timp, lantanul absoarbe hidrogenul - cu cât mai intens, cu atât temperatura este mai mare.
Lantanidele interacționează și cu hidrogenul. Unul dintre ele, ceriul, este folosit chiar și ca absorbant de gaz în industria electrovidului și în metalurgie.
Aici ajungem la una dintre părțile importante ale poveștii noastre, la subiectul „Lantan și ceriu”, iar în legătură cu acesta - la istoria lantanului.
În ceea ce privește prevalența în natură, în ceea ce privește scara de producție și în ceea ce privește lățimea de utilizare, lantanul este inferior celui mai apropiat analog al său, primul dintre lantanide. „Strămoș” și - pentru totdeauna al doilea, așa este poziția lantanului în familia sa. Și când elementele din pământuri rare au fost împărțite în două subgrupe în funcție de totalitatea proprietăților lor, lantanul a fost atribuit unui subgrup al cărui nume a fost dat în onoarea ceriului ... Și lantanul a fost descoperit după ceriu, ca amestec cu ceriu, în ceritul mineral. Aceasta este povestea, povestea profesorilor și a elevilor.
În 1803, chimistul suedez Jene Jacob Berzelius, în vârstă de 24 de ani, împreună cu profesorul său Hisinger, au investigat mineralul cunoscut acum sub numele de cerită. Acest mineral a fost descoperit de Gadolin în 1794, pământ de ytriu și un alt pământ rar, foarte asemănător cu ytriul. L-au numit ceriu. Aproape simultan cu Berzelius, celebrul chimist german Martin Klaproth a descoperit pământul de ceriu.
Berzelius a revenit să lucreze cu această substanță mulți ani mai târziu, deja un om de știință distins. În 1826, Karl Mozander, un student, asistent și unul dintre prietenii apropiați ai lui Berzelius, a examinat pământul de ceriu și a concluzionat că era eterogen, că, pe lângă ceriu, conținea încă un element, și poate mai mult de unul, nou. Dar pentru a testa această presupunere a fost nevoie de multă ceritate. Mozander a reușit să demonstreze complexitatea pământului de ceriu abia în 1839.
Interesant, cu un an mai devreme, un student Erdmann, necunoscut printre chimiști, a găsit un nou mineral în Norvegia și l-a numit după profesorul său Mozander - mosanderite. Din acest mineral au fost izolate și două pământuri rare, ceriu și nova.
Noul element găsit în cerită și mosanderit a fost numit lantan la sugestia lui Berzelius. Numele cu indiciu: vine din grecescul λανθανειν - a ascunde, a fi uitat. Lantanul conținut de cerite a fost ascuns cu succes de chimiști timp de 36 de ani!
Multă vreme s-a crezut că lantanul este divalent, că este un analog al calciului și al altor metale alcalino-pământoase, iar greutatea sa atomică este de 90...94. Nu a existat nicio îndoială cu privire la corectitudinea acestor cifre până în 1869. Mendeleev a văzut că nu există loc pentru elementele pământurilor rare în grupa II a sistemului periodic și le-a pus în grupa III, atribuind greutatea atomică 138 ... 139 lantanului. Dar legitimitatea unei astfel de mișcări mai trebuia dovedită. Mendeleev a întreprins un studiu al capacității termice a lantanului. Valoarea obținută de el a indicat în mod direct că acest element trebuie să fie trivalent...
Lantanul metalic, desigur, departe de a fi pur, a fost obținut mai întâi de Mosander prin încălzirea clorurii de lantan cu potasiu.
În zilele noastre, la scară industrială, se obține lantanul cu o puritate de peste 99%. Vom urmări cum se face acest lucru, dar mai întâi ne vom familiariza cu principalele minerale ale lantanului și cu primele etape ale celui mai complex proces de separare a elementelor pământurilor rare.
S-a menționat deja că în minerale lantanul și lantanidele se însoțesc invariabil. Există minerale selective în care proporția unuia sau altui element de pământ rar este mai mare decât de obicei. Dar nu există minerale pur lantan sau pur ceriu, ca să nu mai vorbim de alte lantanide. Un exemplu de mineral de lantan selectiv este davidita, în care până la 8,3% La 2 O 3 și doar 1,3% oxid de ceriu. Dar lantanul se obține în principal din monazit și bastnäsite, precum și din ceriu și din toate celelalte elemente ale subgrupului ceriu.
Monazite este un mineral greu, strălucitor, de obicei galben-maro, dar uneori de alte culori, deoarece nu diferă în constanța compoziției sale. Mai exact, compoziția sa este descrisă printr-o formulă atât de ciudată: (REE)PO 4 . Înseamnă că monazit este un fosfat de elemente de pământuri rare (REE). De obicei monazit conține 50...68% oxizi REE și 22...31,5% P 2 O 5 . Și mai conține până la 7% dioxid de zirconiu, 10% (în medie) dioxid de toriu și 0,1 ... 0,3% uraniu. Aceste cifre arată clar de ce căile pământurilor rare și ale industriilor nucleare sunt atât de strâns legate între ele.
Metalul amestecat de pământuri rare - mischmetal - și un amestec al oxizilor acestora au început să fie utilizate la sfârșitul secolului trecut, iar la începutul acestui secol, a fost demonstrat un exemplu remarcabil de furt internațional în legătură cu acestea. Navele germane care au livrat marfă în Brazilia, întorcându-se înapoi, au umplut calele cu nisip de pe plajele de pe coasta atlantică a acestei țări și din anumite locuri. Căpitanii au susținut că nisipul era doar balast necesar pentru a face nava mai stabilă. În realitate, îndeplinind ordinele industriașilor germani, au furat materii prime minerale valoroase - nisipurile de coastă ale statului Espirito Santo, bogate în monazit...
Placerii monazite sunt distribuiți de-a lungul malurilor râurilor, lacurilor și mărilor de pe toate continentele. La începutul secolului (date pentru 1909), 92% din producția mondială de materii prime din pământuri rare și în principal monazit, reprezenta Brazilia. Zece ani mai târziu, centrul de greutate s-a mutat cu mii de kilometri spre est (sau vest, în funcție de modul în care numărați) - spre India. După 1950, în legătură cu dezvoltarea industriei nucleare, Statele Unite au devenit hegemonul dintre țările capitaliste în extracția și prelucrarea materiilor prime din pământuri rare.
Desigur, țara noastră și alte țări ale comunității socialiste au trebuit să își dezvolte propria industrie a pământurilor rare și să-și găsească propriile materii prime.
Să urmăm în termeni generali calea de la nisipul monazit la lantan.
Deși nisipul se numește monazit, nu există prea mult monazit în el - o fracțiune de procent. De exemplu, în bine-cunoscutele monazite din Idaho (SUA), o tonă de nisip conține doar 330 g de monazit. Prin urmare, în primul rând, se obține un concentrat de monazit.
Prima etapă de concentrare are loc deja pe dragă. Densitatea monazitului este de 4,9 ... 5,3, iar nisipul obișnuit - o medie de 2,7 g / cm 3. Cu o astfel de diferență de greutate, separarea gravitațională nu este dificilă. Dar, pe lângă monazit, mai sunt și alte minerale grele în aceleași nisipuri. Prin urmare, pentru a obține un concentrat de monazit cu o puritate de 92...96% se folosește un complex de metode de îmbogățire gravitațională, magnetică și electrostatică. Ca rezultat, pe parcurs se obțin ilmenit, rutil, zircon și alte concentrate valoroase.
Ca orice mineral, monazitul trebuie „deschis”. Cel mai adesea, concentratul de monazit este tratat pentru aceasta cu acid sulfuric concentrat *. Sulfații rezultați din elementele pământurilor rare și toriu sunt levigați cu apă plată. După ce intră în soluție, siliciul și o parte din zircon care nu s-a separat în etapele anterioare rămân în sediment.
* Metoda alcalină de deschidere a monazitei este, de asemenea, comună.
În următoarea etapă de separare, se extrage mezotoriul de scurtă durată (radiu-228), apoi toriu însuși, uneori împreună cu ceriul, alteori separat. Separarea ceriului de lantan și un amestec de lantanide nu este deosebit de dificilă: spre deosebire de acestea, este capabil să prezinte o valență 4+ și să precipite sub formă de hidroxid de Ce(OH)4, în timp ce analogii săi trivalenți rămân în soluție. . Remarcăm doar că operația de separare a ceriului, precum și a celor anterioare, se efectuează în mod repetat - pentru a „stors” cât mai complet posibil concentratul scump de pământuri rare.
După izolarea ceriului, soluția conține cel mai mult lantan (sub formă de azotat de La(NO 3) 3, deoarece în una dintre etapele intermediare acidul sulfuric a fost înlocuit cu acid azotic pentru a facilita separarea ulterioară). Din această soluție se obține lantanul prin adăugarea de nitrați de amoniac, amoniu și cadmiu. În prezența Cd(NO 3) 2 separarea este mai completă. Cu ajutorul acestor substanțe, toate lantanidele trec în precipitat, în timp ce în filtrat rămân doar cadmiul și lantanul. Cadmiul este precipitat cu hidrogen sulfurat, precipitatul este separat, iar soluția de azotat de lantan este purificată de câteva ori prin cristalizare fracționată din impuritățile lantanide.
În cele din urmă, se obține de obicei clorură de lantan LaCl3. Electroliza clorurii topite produce lantan cu o puritate de până la 99,5%. Și mai mult lantan pur (99,79% și mai mult) se obține prin metoda termică cu calciu. Aceasta este tehnologia clasică tradițională.
După cum puteți vedea, obținerea lantanului elementar este o chestiune complicată.
Separarea lantanidelor - de la praseodim la lutețiu - necesită și mai mult efort și bani, și timp, desigur. Prin urmare, în ultimele decenii, chimiștii și tehnologii din multe țări ale lumii au căutat să creeze metode noi, mai avansate, pentru separarea acestor elemente. Astfel de metode – extracția și schimbul de ioni – au fost create și introduse în industrie. Deja la începutul anilor 1960, plantele care funcționează pe principiul schimbului de ioni au obținut un randament de 95% din produse din pământuri rare, cu o puritate de până la 99,9%.
Până în 1965, organizațiile de comerț exterior ale țării noastre puteau oferi cumpărătorilor toate lantanidele sub formă de metale cu o puritate de peste 99%. Pe lângă prometiu, desigur, deși preparatele radioactive ale acestui element - produsele dezintegrarii nucleare a uraniului - au devenit și ele destul de accesibile.
Cataloagele Techsnabexport au inclus și aproximativ 300 de compuși chimic puri și extrapuri de lantan și lantanide. Aceasta este o dovadă a nivelului ridicat de dezvoltare al industriei sovietice de pământuri rare.
Dar să revenim la lantan.
Pe scurt despre utilizarea lantanului și a compușilor săi
Lantanul pur nu este aproape niciodată folosit ca metal de aliere, folosind ceriu sau mischmetal mai ieftin și mai accesibil pentru aceasta - efectul de aliere al lantanului și al lantanidelor este aproape același.
S-a menționat mai sus că uneori lantanul este extras dintr-un amestec prin extracție folosind solubilitatea diferită a unor compuși (în mare parte complecși) ai elementelor pământurilor rare în solvenți organici. Dar se întâmplă ca elementul nr. 57 însuși să fie folosit ca extractant. Lantanul topit este folosit pentru extragerea plutoniului din uraniul lichid. Iată un alt punct de contact între industria nucleară și industria pământurilor rare.
Oxidul de lantan La 2 O 3 este folosit mult mai pe scară largă. Această pulbere amorfă albă, insolubilă în apă, dar solubilă în acizi, a devenit o componentă importantă a sticlelor optice. Lentilele foto ale celebrei companii Kodak conțin de la 20 la 40% La 2 O 3 . Datorită adăugării de lantan, a fost posibil să se reducă dimensiunea obiectivului la aceeași deschidere și să se îmbunătățească considerabil calitatea fotografierii în culori. Se știe că în timpul celui de-al Doilea Război Mondial ochelarii de lantan au fost folosiți în instrumentele optice de câmp. Cele mai bune lentile fotografice domestice, de exemplu, Industar-61LZ, sunt, de asemenea, realizate din sticlă lantan, iar una dintre cele mai bune camere de film amatoare ale noastre se numește Lanthanum... Recent, sticla cu lantan a fost folosită și pentru fabricarea sticlei de laborator. Oxidul de lantan oferă sticlei nu numai proprietăți optice valoroase, ci și o rezistență mai mare la căldură și acid.
Acesta este, probabil, tot ceea ce se poate spune despre lantan fără lantanide, deși în unele locuri era imposibil să nu se abată de la principiul „fără” ...
Lanthan și echipa lui
Compararea lantanului și a lantanidelor cu o echipă sportivă poate părea exagerat pentru unii. Cu toate acestea, această comparație nu este mai sedițioasă decât definițiile binecunoscute precum „familia lantanidelor” sau „gemenii chimici”. Judecați singuri: lantanul și echipa sa au o singură uniformă (alb-argintiu) și, la fel ca jucătorii de hochei, toți au muniție de protecție (din pelicule de oxid). Toate sunt eliberate de natură aproximativ în mod egal (asemănarea este extrem de mare), dar, ca și în sport, din diverse motive, „abilitățile” sunt realizate într-o măsură diferită: unii „se joacă” mai bine, alții mai rău... Și de Desigur, fiecare membru al acestui comandă „fănturile” și „trucurile” preferate - feromagnetismul gadoliniului, de exemplu.
Și în ceea ce privește proprietățile chimice, lantanidele încă nu sunt gemeni - altfel nu ar fi posibil să le separăm. Ca într-o echipă sportivă bună, ei sunt uniți în principal și individual în special. În ceea ce privește numărul de participanți, numărul de jucători în diferite jocuri este diferit, 14 este în intervalul normal...
Adevărat, a existat o perioadă în care aproape cincizeci de candidați au fost recomandați acestei „echipe”. Numărul de elemente asemănătoare lantanului descoperite a crescut într-un ritm catastrofal. În compilat de profesorul N.A. Lista lui Figurov de elemente descoperite fals conține cele mai multe lantanide false. Nici măcar marii oameni de știință nu au evitat greșelile - Mozander, Lecoq de Boisbaudran, Auer von Welsbach, Crookes, Urbain.
Neperiodicitatea proprietăților lantanului și a echipei sale, ieșind din secvența strictă a sistemului periodic, a cauzat probleme lui Mendeleev. Dar cu timpul, totul s-a rezolvat. Profesorul de la Universitatea din Praga, Bohuslav Frantsevich Brauner, a fost primul care a propus să scoată lantanidele din partea principală a mesei.
„Trebuie să fii un expert în „pământuri rare” precum B.F. Brauner, pentru a înțelege acest subiect complex, dificil și încă aproape finalizat, în care verificarea este dificilă nu numai prin originalitatea și asemănarea multor relații inițiale, ci și prin dificultățile în obținerea materialului natural în sine ”, a scris Mendeleev în 1902.
„În ceea ce privește sistematica elementelor pământurilor rare și locul lor în tabelul periodic, este acum sigur să presupunem că scandiul, ytriul și lantanul se află în rândurile pare ale grupului III, după cum rezultă din greutățile lor atomice și din volum. a oxizilor lor... Alte elemente ale pământurilor rare formează probabil un grup sau un nod interperiodic în sistem, unde se succed în ceea ce privește greutățile atomice. Acestea sunt cuvintele lui Brauner din articolul „Elementele pământurilor rare” scris pentru penultima ediție (1903) pe viață a Fundamentals of Chemistry a lui Mendeleev.
În sfârșit, a fost posibil să se dezlege „nodul din sistem” numai după ce un nou criteriu, mai precis din punct de vedere fizic, a fost pus în baza tabelului periodic - sarcina nucleului atomic. Apoi a devenit clar că doar 15 elemente se pot potrivi între lantan și tantal, iar acesta din urmă ar trebui să fie un analog al zirconiului. Acest element, hafniul, a fost descoperit de Coster și Hevosi în 1923.
Ultima (după numărul atomic) lantanidă, lutețiul, a fost descoperită mai devreme, în 1907.
Este firesc să căutăm motive pentru proprietățile comune ale lantanului și ale lantanidelor în structura învelișurilor de electroni ale atomilor lor.
Conform legilor mecanicii cuantice, electronii se pot învârti în jurul nucleelor care nu se află pe nicio orbită. Ele par să fie distribuite pe straturi - scoici. Capacitatea acestor învelișuri, numărul maxim de electroni din ele, este determinată de formula ne = 2N 2, unde ne este numărul de electroni, a N este numărul carcasei, numărând de la miez. Rezultă că primul înveliș poate avea doar doi electroni, al doilea - opt, al treilea - optsprezece, al patrulea - treizeci și doi și așa mai departe.
Deja în a patra perioadă a tabelului periodic, începând cu scandiu, „următorii” electroni nu cad în al patrulea strat exterior, ci în cel anterior. De aceea, diferența de proprietăți a elementelor cu numere atomice de la 12 la 30 nu este la fel de accentuată ca cea a elementelor mai ușoare. O imagine similară se observă în a cincea perioadă. Și aici, începând cu ytriu, noi electroni umplu nu a cincea, ci penultima, a patra înveliș - se formează o altă serie de așa-numitele metale de tranziție.
Orez. 3. Curba volumelor atomice ale elementelor pământurilor rare. Are două maxime formate din elemente care prezintă valență 2+; în contrast, elementele care pot fi tetravalente au volume atomice minime
Transferând această analogie în perioada a șasea, ar fi logic să presupunem că, începând cu lantanul (este un analog al scandiului și ytriului), același lucru se va întâmpla aici. Electronii, însă, ignorând logica noastră, umplu aici nu penultima, ci a treia înveliș din exterior, deoarece există locuri libere pe ea. Conform formulei ne = 2N 2, pe acest înveliș - al patrulea din nucleu - pot fi 32 de electroni. Aici ajung, cu rare excepții, „noii” electroni ai următoarelor lantanide. Și, deoarece proprietățile chimice ale unui element sunt determinate în primul rând de structura învelișurilor exterioare de electroni, proprietățile lantanidelor se dovedesc a fi chiar mai apropiate decât cele ale metalelor de tranziție.
După cum se potrivește elementelor din grupa III, lantanidele sunt de obicei trivalente. Dar unele dintre ele pot prezenta și o altă valență: ceriu, praseodim și terbiu - 4+; samariu, europiu și iterbiu - 2+.
Valențele anormale ale lantanidelor au fost investigate și explicate de chimistul german Wilhelm Klemm. Din spectrele de raze X, el a determinat principalii parametri ai cristalelor și volumelor atomice ale acestora. Curba volumului atomic arată clar maximele (europiu, iterbiu) și, mai puțin clar, minimele (ceriu, terbiu). Praseodimiul și samariul ies și ele, deși nu atât de mult, din seria definită de curba care cade lină. Prin urmare, primul „gravitează” la ceriu și terbiu de volum redus, iar al doilea - la europiu și iterbiu mari. Elementele cu volume atomice mai mari rețin electronii mai strâns și, prin urmare, sunt doar tri- sau chiar divalente. La atomii „cu volum mic”, dimpotrivă, unul dintre electronii „interni” nu este ferm închis în înveliș - prin urmare, atomii de ceriu, praseodim și terbiu pot fi tetravalenți.
În lucrările lui Klemm, a fost dată și o justificare fizică pentru împărțirea de lungă durată a elementelor pământurilor rare în două subgrupe - ceriu și ytriu. Primul include lantanide și lantanide de la ceriu la gadoliniu, al doilea include ytriu și lantanide de la terbiu la lutețiu. Diferența dintre elementele acestor două grupuri este direcția spinurilor electronilor care umplu a patra înveliș principal pentru lantanide.
Spinurile - momentele proprii ale impulsului electronilor - pentru primii au același semn; în cel din urmă, jumătate dintre electroni au spini de un semn, iar jumătate din celălalt.
Dar destule despre anomaliile care pot fi explicate doar cu ajutorul mecanicii cuantice - să revenim la tipare.
Când vine vorba de lantanide, modelele par uneori ilogice. Un exemplu în acest sens este contracția lantanidelor.
Compresia lantanidică este denumirea dată scăderii naturale a mărimii ionului trivalent al elementelor pământurilor rare, de la lantan la lutețiu, descoperită de geochimistul norvegian Goldschmidt. S-ar părea că totul ar trebui să fie invers: există un proton în plus în nucleul atomului de ceriu decât în nucleul atomului de lantan; nucleul de praseodim este mai mare decât nucleul de ceriu și așa mai departe. În consecință, crește și numărul de electroni care se rotesc în jurul nucleului. Și dacă ne imaginăm un atom așa cum este de obicei desenat pe diagrame - sub forma unui disc mic înconjurat de orbite alungite de electroni invizibili, orbite de diferite dimensiuni, atunci, evident, profitul electronilor ar trebui să crească dimensiunea atomului, așa cum un întreg. Sau, dacă aruncăm electronii exteriori, al căror număr poate să nu fie același, aceeași regularitate ar trebui să fie observată în dimensiunile ionilor trivalenți ai lantanului și a echipei sale.
Adevărata stare de lucruri este ilustrată de diagrama compresiei lantanidelor. Raza ionului de lantan trivalent este de 1,22 Å, iar același ion de lutețiu este de numai 0,99 Å. Nu totul este logic, ci tocmai invers. Cu toate acestea, nu este greu să ajungeți la fundul sensului fizic al fenomenului de compresie a lantanidelor chiar și fără mecanică cuantică, este suficient doar să amintim legile de bază ale electromagnetismului.
Sarcina nucleului și numărul de electroni din jurul lui cresc în paralel. Crește și forța de atracție între sarcini opuse; un nucleu mai greu atrage electronii mai puternic, le scurtează orbitele. Și deoarece orbitele profunde ale atomilor de lantanide sunt cele mai saturate cu electroni, atracția electrică are un efect și mai puternic.
Apropierea razelor ionice și caracterul comun al proprietăților chimice sunt principalele motive pentru prezența comună a lantanidelor în minerale.
Despre mineralele pământurilor rare
Principalul dintre ele - monazit - este descris mai sus. Al doilea cel mai important mineral de pământuri rare, bastnäsite, este similar în multe privințe. Bastnäsite este, de asemenea, greu, de asemenea strălucitor, de asemenea, nu este constant la culoare (cel mai adesea galben deschis). Dar din punct de vedere chimic este legat de monazit doar printr-un conținut ridicat de lantan și lantanide. Dacă monazit este un fosfat, atunci bastnäsite este un fluorocarbonat de pământuri rare, compoziția sa este de obicei scrisă după cum urmează: (La, Ce)FCO 3 . Dar, așa cum se întâmplă adesea, formula minerală nu reflectă pe deplin compoziția sa. În acest caz, indică doar componentele principale: în bastnäsite 36,9 ... 40,5% oxid de ceriu și aproape aceiași (în total) oxizi de lantan, praseodim și neodim. Dar, desigur, conține și alte lantanide.
Pe lângă bastnazit și monazit, se folosesc practic mai multe minerale pământuri rare, deși într-o măsură limitată, în special gadolinit, în care există până la 32% oxizi REE din subgrupa ceriu și 22 ... 50% ytriu. În unele țări, metalele pământurilor rare sunt extrase în timpul procesării complexe a loparitei și apatitei.

Orez. 4. Conținutul relativ de lantanide din scoarța terestră. Model: numerele pare sunt mai frecvente decât numerele impare
În total, sunt cunoscute aproximativ 70 de minerale din pământuri rare propriu-zise și încă aproximativ 200 de minerale, în care aceste elemente sunt incluse ca impurități. Acest lucru indică faptul că pământurile „rare” nu sunt deloc atât de rare, iar acest vechi nume comun pentru scandiu, ytriu și lantan cu cele lantanide nu este altceva decât un tribut adus trecutului. Nu sunt rare - există mai mult ceriu în pământ decât plumb, iar cele mai rare dintre pământurile rare sunt mult mai frecvente în scoarța terestră decât mercurul. Totul este despre dispersarea acestor elemente și dificultatea de a le separa unul de celălalt. Dar, desigur, lantanidele nu sunt distribuite în mod egal în natură. Elementele cu numere atomice par sunt mult mai comune decât vecinii lor impari. Această împrejurare, desigur, afectează scara producției și prețurile pentru metalele pământurilor rare. Cele mai inaccesibile lantanide - terbiu, tuliu, lutețiu (rețineți că toate acestea sunt lantanide cu numere atomice impar) - sunt mai scumpe decât aurul și platina. Și prețul ceriului cu o puritate mai mare de 99% este de numai 55 de ruble pe kilogram (date din 1970). Pentru comparație, subliniem că un kilogram de mischmetal costă 6 ... 7 ruble, iar ferocerul (10% fier, 90% elemente din pământuri rare, în principal ceriu) - doar cinci. Amploarea utilizării elementelor pământurilor rare este, de regulă, proporțională cu prețurile...
Lantanidele în practică
În toamna anului 1970, Consiliul științific al Institutului de Mineralogie, Geochimie și Chimie Cristalală a Elementelor Rare al Academiei de Științe a URSS s-a reunit pentru o întâlnire extinsă cu o agendă destul de neobișnuită. Posibilitățile elementelor pământurilor rare au fost discutate „în lumina problemelor agriculturii”.
Problema influenței acestor elemente asupra organismelor vii nu a apărut întâmplător. Pe de o parte, se știe că pământurile rare sunt adesea incluse ca impurități în compoziția celor mai importante minerale pentru agrochimie - fosforiti și apatit. Pe de altă parte, au fost identificate plante care pot servi ca indicatori biochimici ai lantanului și ai analogilor săi. Deci, de exemplu, în cenușa frunzelor de nuc de hickory sudic, până la 2,5% din elementele pământurilor rare. O concentrație crescută a acestor elemente a fost găsită și în sfecla de zahăr și lupin. Conținutul de elemente de pământ rare în solul tundrei ajunge la aproape 0,5%.
Este puțin probabil ca aceste elemente comune să nu afecteze dezvoltarea plantelor și, eventual, a organismelor de pe alte trepte ale scării evolutive. Pe la mijlocul anilor 1930, omul de știință sovietic A.A. Drobkov a studiat efectul pământurilor rare asupra diferitelor plante. A experimentat cu mazăre, napi și alte culturi, a introdus pământuri rare cu sau fără bor, mangan. Rezultatele experimentelor au spus că pământurile rare sunt necesare pentru dezvoltarea normală a plantelor... Dar a trecut un sfert de secol înainte ca aceste elemente să devină relativ accesibile. Răspunsul final la întrebarea cu privire la rolul biologic al lantanului și al echipei sale încă nu a fost dat.
În acest sens, metalurgiștii i-au întrecut semnificativ pe agrochimiștii. Unul dintre cele mai semnificative evenimente din ultimele decenii în industria siderurgică este legat de lantanul și echipa sa.
Fonta ductilă se obținea de obicei prin modificarea cu magneziu. Semnificația fizică a acestui aditiv va deveni clar dacă ne amintim că fonta conține 2 ... 4,5% carbon sub formă de fulgi de grafit, ceea ce conferă fontei principalul său dezavantaj tehnic - fragilitatea. Adăugarea de magneziu face ca grafitul să se transforme într-o formă sferică sau globulară distribuită mai uniform în metal. Ca rezultat, structura este îmbunătățită semnificativ și, odată cu aceasta, proprietățile mecanice ale fontei. Cu toate acestea, aliarea fontei cu magneziu necesită costuri suplimentare: reacția este foarte violentă, metalul topit stropește în toate direcțiile și, prin urmare, a fost necesară construirea unor camere speciale pentru acest proces.
Metalele pământurilor rare acționează asupra fontei într-un mod similar: „elimină” impuritățile de oxid, leagă și îndepărtează sulful și contribuie la tranziția grafitului la o formă globulară. Și, în același timp, nu necesită camere speciale - reacția se desfășoară calm. Și rezultatul?
Se introduc doar 4 kg (0,4%) de aliaj ferocer-magneziu per tona de fontă, iar rezistența fontei este dublată! O astfel de fontă poate fi folosită în multe cazuri în locul oțelului, în special la fabricarea arborilor cotit. Nu numai că fonta ductilă este cu 20...25% mai ieftină decât piesele turnate din oțel și de 3...4 ori mai ieftină decât piesele forjate din oțel. Rezistența la abraziune a fustelor din fontă sa dovedit a fi de 2-3 ori mai mare decât cea a celor din oțel. Arborii cotiți din fontă ductilă sunt deja folosiți în locomotivele diesel și alte mașini grele.
Elemente de pământ rare (sub formă de mischmetal și ferocer) sunt, de asemenea, adăugate la oțel de diferite grade. În toate cazurile, acest aditiv funcționează ca un dezoxidant puternic, un excelent degazant și desulfurant. În unele cazuri, pământurile rare sunt aliate... oțel aliat. Oțelurile nichel-crom sunt greu de laminat - doar 0,03% mischmetal introdus într-un astfel de oțel crește foarte mult ductilitatea acestuia. Acest lucru facilitează laminarea, fabricarea pieselor forjate și tăierea metalelor.
În compoziția aliajelor ușoare sunt introduse și elemente din pământuri rare. Cunoscut, de exemplu, aliaj de aluminiu rezistent la căldură cu 11% mischmetal. Aditivii de lantan, ceriu, neodim și praseodim au făcut posibilă creșterea punctului de înmuiere al aliajelor de magneziu de peste trei ori și, în același timp, creșterea rezistenței lor la coroziune. După aceea, aliajele de magneziu cu elemente de pământuri rare au început să fie utilizate pentru fabricarea de piese pentru aeronave supersonice și obuze pentru sateliții artificiali de pe Pământ.
Aditivii de pământuri rare îmbunătățesc proprietățile altor metale importante - cupru, crom, vanadiu, titan... Nu este surprinzător faptul că metalurgiștii folosesc din ce în ce mai mult metale din pământuri rare în fiecare an.
Lantanul și analogii săi și-au găsit aplicații în alte domenii ale tehnologiei moderne. În industria chimică și a petrolului, aceștia (și compușii lor) acționează ca catalizatori eficienți, în industria sticlei ca coloranți și ca substanțe care conferă proprietăți specifice sticlei. Utilizarea lantanidelor în inginerie nucleară și în industriile conexe este diversă. Dar mai multe despre asta mai târziu, în secțiunile dedicate fiecăreia dintre lantanide. Vom sublinia doar că și prometiuul creat artificial și-a găsit aplicație: energia de descompunere a prometiu-147 este folosită în bateriile electrice atomice. Într-un cuvânt, timpul șomajului elementelor pământurilor rare s-a încheiat cu mult timp în urmă și irevocabil.
Nu trebuie să presupunem însă că toate problemele asociate cu „nodul” din tabelul periodic au fost deja rezolvate. Astăzi, cuvintele lui Dmitri Ivanovici Mendeleev despre „pământurile rare” sunt deosebit de relevante: „O mulțime de lucruri noi s-au acumulat aici în ultimii ani” ... Cu toate acestea, numai amatorii pot considera că totul și totul a fost cunoscut, că rar subiectul pământului s-a epuizat. Experții, dimpotrivă, sunt siguri că cunoașterea lantanului și a echipei sale abia la început, că aceste elemente vor surprinde lumea științifică de mai multe ori. Și poate nu numai științific.
otravă de reactor
Lantanul natural este format din doi izotopi cu numerele de masă 138 și 139, iar primul (fracția sa este de doar 0,089%) este radioactiv. Se descompune prin captarea K cu un timp de înjumătățire de 3,2·10 11 ani. Izotopul lantan-139 este stabil. Apropo, se formează în reactoarele nucleare în timpul descompunerii uraniului (6,3% din masa tuturor fragmentelor). Acest izotop este considerat o otravă de reactor, deoarece captează neutronii termici destul de activ, ceea ce este, de asemenea, caracteristic lantanidelor. Dintre izotopii artificiali ai lantanului, cel mai interesant este lantanul-140 cu un timp de înjumătățire de 40,22 ore. Acest izotop este folosit ca trasor radioactiv în studiul proceselor de separare a lantanului și a lantanidelor.
Care dintre cele trei?
Elementele care urmează lantanului sunt numite pământuri rare, sau lantanide sau lantanide. Care dintre aceste nume este cel mai potrivit? Termenul de „pământuri rare” a apărut în secolul al XVIII-lea. Acum este atribuit oxizilor de scandiu, ytriu, lantan și analogilor săi; inițial, termenul avea un sens mai larg. „Pământurile” se numesc în general toți oxizii refractari ai metalelor. În ceea ce privește elementele cu numere atomice de la 57 la 71, acest lucru este adevărat: punctul de topire al La 2 O 3 este de aproximativ 2600°C. În forma sa pură, multe dintre aceste „pământuri” sunt rare până astăzi. Dar nu este nevoie să vorbim despre raritatea elementelor pământurilor rare din scoarța terestră...
Termenul „lantanide” a fost introdus pentru a arăta că următoarele paisprezece elemente vin după lantan. Dar apoi, cu același succes, fluorul poate fi numit oxigen (sau oxid) - urmează și oxigenul, iar clorul - sulfură ... Dar chimia a investit de mult în conceptele de „sulfură”, „fosfură”, „hidrură”, clorură și așa mai departe sens diferit. Prin urmare, termenul „lantanide” este considerat nereușit de majoritatea oamenilor de știință și este folosit din ce în ce mai puțin.
„Lantanide” - mai justificate. Terminația „oid” indică asemănarea. „Lantanide” înseamnă „asemănător lantanului”. Aparent, acest termen ar trebui folosit pentru a desemna 14 elemente - analogi ai lantanului.
"Poveste noua"
În istoria lantanului și a lantanidelor se pot distinge două perioade de timp, mai ales bogate în descoperiri și dispute. Prima dintre ele datează de la sfârșitul secolului al XIX-lea, când lantanidele au fost descoperite și „închise” atât de des încât până la urmă a devenit nici măcar interesant... A doua perioadă tulbure a fost anii 50 ai secolului XX, când dezvoltarea tehnologiei nucleare a ajutat la obținerea unor cantități mari de materii prime din pământuri rare și a stimulat noi cercetări în acest domeniu. Atunci a existat tendința de a obține și utiliza elemente de pământ rare nu într-un amestec, ci fiecare separat, folosind proprietățile lor specifice. Nu întâmplător, în 15 ani (din 1944 până în 1958) numărul publicațiilor științifice dedicate lantanidelor a crescut de 7,6 ori și chiar mai mult pentru unele elemente individuale: pentru holmiu, de exemplu, de 24 și pentru tuliu de 45 de ori. !
Mascarată ca amidon
Unul dintre compușii lantanului, acetatul său de bază, se comportă ca amidonul atunci când i se adaugă iod. Gelul alb capătă o culoare albastru strălucitor. Analiștii folosesc uneori această proprietate pentru a descoperi lantanul în amestecuri și soluții.
Bivalent doar formal
S-a stabilit că în toți compușii lantanul prezintă aceeași valență - 3+. Dar cum să explicăm atunci existența dihidridei gri-negru LaH 2 și a sulfurei galbene LaS? Sa constatat că LaH2 este un intermediar relativ stabil al reacției de formare a LaH3 și că lantanul este trivalent în ambele hidruri. Molecula de dihidrură conține o legătură metalică La-La. Cu sulfură, totul este explicat și mai simplu. Această substanță are o conductivitate electrică ridicată, ceea ce sugerează prezența ionilor La 3+ și a electronilor liberi în ea. Apropo, LaH 2 conduce bine curentul, în timp ce LaH 3 este un semiconductor.
Lantan - 57
Lantan (La) metal pământuri rare, număr atomic 57, masă atomică 138,91, punct de topire 920°C și densitate 6,16 g/cm3.
Nu l-au putut deschide mult timp, fapt pentru care și-a primit numele („lantan”, în greacă „mă ascund”). Multă vreme, lantanul a fost greu de obținut în laborator și, mai mult, în industrie. În forma sa pură, el și compușii săi au fost obținuți abia în 1903, folosind cromatografia. Mai întâi, au fost izolate sărurile de lantan, apoi lantanul însuși, în forma sa pură. Lantanul metalic este foarte asemănător cu calciul metalic. Duritatea sa este comparabilă cu cea a staniului, descompune apa, reacționează cu acizii, iar la încălzire, cu clorul și sulful. În aer uscat deschis, se oxidează și, o peliculă subțire de oxid, protejează corpul metalic de oxidare.
OBȚINEREA LANTANULUI.

metal pământuri rare - lantan
În natură, lantanul se găsește în principal în minerale numite monazit și bastnäsite. Este prezent și în mineralele loparită și apatită. Aceste minerale conțin și alte REM, ceea ce face dificilă izolarea lantanului pur. În industrie, ca produs comercial, lantanul este produs cu o puritate de până la 99%, care este apoi adus la o puritate mai mare.
Monazit este un mineral greu găsit în natură într-o varietate de culori datorită compoziției sale chimice variabile. Conține până la 68% oxizi din diferite REM, până la 7% zirconiu, până la 10% dioxid de toriu și fracțiuni de un procent de uraniu. Monazitul, de obicei sub formă de placeri, se găsește pe țărmurile mărilor, lacurilor și râurilor de pe diferite continente. După extragerea mineralelor, este necesar să se obțină un concentrat cu o puritate de până la 92-96%. Pentru aceasta se aplică procedeul de zdrobire grosieră, zdrobire fină și apoi îmbogățire, prin metode gravitaționale, magnetice și electrostatice. In acest caz se obtin si alte concentrate (ilmenit, rutil, zirconiu).
Apoi, concentratul de monazit rezultat este tratat cu acid sulfuric (uneori cu alcali). Sulfații REM rezultați sunt levigați cu apă, intră în soluție, iar silicea și o parte de zircon rămân în precipitat. În următoarea etapă de prelucrare, radiul 228 și toriu cu ceriu sunt separate. După separarea ceriului, lantanul rămâne în soluție sub formă de clorură de LaCl3. Apoi, este supus electrolizei în topitură, unde este izolat cu o puritate de până la 99,5%. Pentru a obține mai mult lantan pur până la 99,8%, se utilizează o metodă de prelucrare termică a calciului. Există și alte metode de separare a metalelor din pământuri rare - extracția și schimbul de ioni, a căror utilizare realizează o puritate a lantanului obținut de până la 99,9%.
Mai recent, lantanul a fost obținut împreună cu ceriul. În acest amestec, au fost într-un raport de 1: 1, iar acest amestec a avut proprietăți piroforice, care a fost folosit în producția de proiectile trasoare. Lantanul poate fi obținut în producția de superfosfați și apatite, ale căror rezerve în țara noastră sunt inepuizabile.
APLICAREA LANTANULUI.
Atunci când se creează noi materiale în lumea modernă, este dificil să supraestimezi importanța metalelor din pământuri rare, inclusiv a lantanului.
Energie. Energia nucleară consumă o cantitate mare de lantan ca aditiv la combustibilul nuclear. De asemenea, este folosit pentru a produce plutoniu. Industria energiei eoliene folosește magneți puternici fabricați cu lantan pentru generatoarele de turbine eoliene.
Industria petrolului. Lantanul este folosit ca catalizator în procesul de cracare a uleiului.
Fosfori. Lantanul este utilizat în producția de lămpi fluorescente, în producția de ecrane plate și monitoare, pentru dispozitive pe tuburi catodice. În prezent, producția de fosfor devine cea mai mare industrie din lume pentru consumul de REM și lantan, în special sub formă de metale foarte purificate și compuși complecși, precum LaCeT, LaP.
Electronică. Productie de microcipuri si dispozitive de memorie pentru calculatoare, productie de display-uri LED.
Aliaje și ceramică. Pentru aliarea și rafinarea aliajelor în metalurgie, așa-numitele. misch metal (un aliaj de ceriu 45-50%, lantan 22-35%, neodim 15-17% și alte REM-uri cu fier până la 5% și siliciu 0,1-0,3%), o componentă foarte importantă pentru obținerea metalelor pure, ca ligaturi pentru obtinerea aliajelor termorezistente si chimice. Un amestec de lantan și ceriu, introdus în compoziția oțelurilor crom-nichel, crește semnificativ ductilitatea acestora, ceea ce facilitează rularea de zece ori și reduce semnificativ pierderile de metal. Obținerea metalelor refractare de înaltă puritate este imposibilă fără introducerea lantanului și a amestecului acestuia cu ceriu în aliajele lor. Adăugările de lantan și amestecul acestuia cu ceriu la aluminiu și magneziu le măresc semnificativ proprietățile mecanice și chimice. Producția de ceramică electrică și electronică folosind lantan devine o industrie importantă pe piețele țărilor industriale dezvoltate.
Spațiu și aviație. Fabricarea materialelor structurale pentru corpurile de sateliți și nave spațiale. Aceste materiale suportă sarcini enorme, scăderi de temperatură și presiune. Pentru motoarele cu turbină cu gaz ale aeronavelor, se utilizează microalierea cu aliaje REM, care conțin lantan.
Industria auto Producția de catalizatori de combustibil, crearea de baterii de nouă generație, producția de motoare pentru vehicule hibride.
Lasere și optoelectronică. Fabricarea lentilelor optice.
Alții. Crearea de dispozitive de diagnostic în medicină, crearea de noi tipuri de îngrășăminte pentru agricultură. Crearea de filtre pentru industriile ecologice.
Introducere
1. Chitanță
2. Proprietăți
3. Aplicare
4. Rolul biologic
Concluzie
Introducere
Lantanul, ca element chimic, nu a putut fi descoperit timp de 36 de ani. În 1803, chimistul suedez Jöns Jakob Berzelius, în vârstă de 24 de ani, a investigat mineralul cunoscut acum sub numele de cerită. În acest mineral s-au găsit pământ de ytriu și un alt pământ rar, foarte asemănător cu ytriul. L-au numit ceriu. În 1826, Carl Mozander a investigat pământul de ceriu și a concluzionat că este eterogen, că, pe lângă ceriu, conține încă un element nou. Mozander a reușit să demonstreze complexitatea pământului de ceriu abia în 1839. A reușit să izoleze un nou element atunci când a avut la dispoziție o cantitate mai mare de cerită.
1. Chitanță
Lantanul metalic, desigur, departe de a fi pur, a fost obținut mai întâi de Mosander prin încălzirea clorurii de lantan cu potasiu. In zilele noastre, la scara industriala, se obtine lantanul cu o puritate de peste 99%; predominant din monazit și bastnäsite, precum și ceriu și toate celelalte elemente ale subgrupului ceriu.
Mozanitul este un mineral greu, strălucitor, de obicei galben-maro, dar uneori de alte culori, deoarece nu diferă în compoziția sa. Mai exact, compoziția sa este descrisă printr-o formulă atât de ciudată: (REE)RO4: asta înseamnă că monazit este un fosfat al elementelor pământurilor rare (REE). De obicei în monalit 50-68% oxizi REE și 22-31,5% P2O5. Și mai conține până la 7% dioxid de zirconiu, 10% (în medie) dioxid de toriu și 0,1-0,3% uraniu. Aceste cifre arată clar de ce în timpul nostru căile industriilor pământurilor rare și nucleare sunt strâns legate între ele. Placerii monazite sunt distribuiți de-a lungul malurilor râurilor, lacurilor și mărilor de pe toate continentele. La începutul secolului (date pentru 1909), 92% din producția mondială de materii prime din pământuri rare, în principal monazit, provenea din Brazilia. După 1950, în legătură cu dezvoltarea industriei nucleare, Statele Unite au devenit hegemonul dintre țările capitaliste în extracția și prelucrarea materiilor prime din pământuri rare.
Pentru a obține un concentrat de monazit cu o puritate de 92 - 96% se folosește un complex de metode de îmbogățire gravitațională, magnetică și electrostatică. Ca rezultat, pe parcurs se obțin ilmenit, rutil, zircon și alte concentrate valoroase.
Ca orice mineral, monazitul trebuie „deschis”. Cel mai adesea, concentratul de monazit este tratat pentru aceasta cu acid sulfuric concentrat (metoda alcalină de deschidere a monazitului a devenit, de asemenea, răspândită). Sulfații rezultați din elementele pământurilor rare și toriu sunt levigați cu apă rece. După ce intră în soluție, siliciul și o parte din zircon care nu s-a separat în etapele anterioare rămân în sediment.
În etapa următoare, mezotoriul de scurtă durată (radiu - 228) este separat, iar apoi toriul însuși - uneori împreună cu ceriul, alteori separat. După ce ceriul este izolat, cea mai mare parte a lantanului rămâne în soluție, care se obține de obicei sub formă de clorură de LaCl3. Electroliza clorurii topite produce lantan cu o puritate de până la 99,5%. Lantanul și mai pur - 99,79% și mai mult se obține prin metoda termică cu calciu. Aceasta este tehnologia clasică, tradițională. După cum puteți vedea, obținerea lantanului elementar este o chestiune complicată.
Separarea lantanidelor - de la praseodim la lutețiu - necesită și mai mult efort și bani, și timp, desigur. Prin urmare, în ultimul deceniu, chimiștii și tehnologii din multe țări ale lumii au căutat să creeze metode noi, mai avansate pentru separarea acestor elemente. Astfel de metode – extracția și schimbul de ioni – au fost create și introduse în industrie. Deja la începutul anilor 1960, plantele care funcționează pe principiul schimbului de ioni au obținut un randament de 95% din produse din pământuri rare, cu o puritate de până la 99,9%.
2. Proprietăți
Proprietățile fizice ale lantanului
LANTAN (din greaca lanthano - ascundere; lat. Lanthanum) La, chem. element III gr. periodic sisteme, număr atomic 57, masă atomică 138,9055; aparține elementelor pământurilor rare. Lantanul natural este format din doi izotopi 139La (99,911%) și 138La radioactivi (0,089%).
|
numar atomic |
||
|
Aspect |
metal moale, maleabil, vâscos alb-argintiu |
|
|
Proprietățile atomului |
||
|
Masa atomica (masa molara) |
138,9055 a. e.m. (g/mol) |
|
|
Raza atomului |
||
|
Energia de ionizare (primul electron) |
541,1 (5,61) kJ/mol (eV) |
|
|
Configuratie electronica |
||
|
Proprietăți termodinamice |
||
|
Densitate |
||
|
Căldura specifică |
0,197 J/(K mol) |
|
|
Conductivitate termică |
13,4 W/(m K) |
|
|
Temperatură de topire |
||
|
Căldura de topire |
8,5 kJ/mol |
|
|
Temperatura de fierbere |
||
|
Căldura de evaporare |
402 kJ/mol |
|
|
Volumul molar |
22,5 cm3/mol |
|
|
Proprietăți chimice |
||
|
raza covalentă |
||
|
Raza ionică |
101.(+3e) ora 18.00 |
|
|
Electronegativitatea |
||
|
Potențialul electrodului |
||
|
Stări de oxidare |
7, 6, 4, 3, 2, 0, -1 |
|
|
Celulă de cristal |
||
|
Structură cu zăbrele |
hexagonal |
|
|
Perioada de zăbrele |
||
|
raport c/a |
||
|
Debye temperatura |
Proprietăți chimice
În ceea ce privește proprietățile chimice, lantanul este obișnuit, dar extrem de refractar. În aer uscat, nu se schimbă - filmul de oxid protejează în mod fiabil împotriva oxidării în vrac. Dar dacă aerul este umed (și în condiții terestre obișnuite este aproape întotdeauna umed), lantanul metalic este oxidat treptat la hidroxid. În oxigen, atunci când este încălzit la 450 ° C, arde cu o flacără strălucitoare (în acest caz, se eliberează destul de multă căldură). Dacă este calcinat în atmosferă de azot, se formează nitrură neagră. În clor, lantanul se aprinde la temperatura camerei, în timp ce reacţionează cu bromul şi iodul numai când este încălzit. Se dizolvă bine în acizi minerali, nu reacționează cu soluțiile alcaline. În toți compușii, lantanul prezintă o valență de 3+.
Reacția cu hidrogen și lantan începe deja la temperatura camerei și continuă cu eliberarea de căldură. Se formează hidruri de compoziție variabilă, deoarece, în același timp, lantanul absoarbe hidrogenul - cu cât mai intens, cu atât temperatura este mai mare.
3. Aplicare
Producția de sticlă
Oxidul de lantan (de la 5 la 40%) este utilizat pentru topirea sticlei optice (sticlă de lantan), pentru fabricarea lentilelor și prismelor utilizate în echipamentele cinematografice și fotografice, precum și în scopuri astronomice.
Productie de incalzitoare electrice ceramice
Cromitul de lantan dopat cu calciu, stronțiu, magneziu este utilizat pentru producția de încălzitoare de cuptoare de înaltă temperatură (punct de topire Ї 2453 ° C, temperatura de funcționare - aproximativ 1780 de grade într-o atmosferă de oxigen). Odată cu creșterea temperaturii, rezistența electrică a cromitului de lantan scade brusc. Coeficientul de dilatare termică al cromitului de lantan este foarte scăzut și acest lucru predetermina durabilitatea încălzitoarelor electrice.
Supraconductivitate la temperaturi ridicate
Oxidul de lantan este utilizat pentru sinteza supraconductoarelor de înaltă temperatură pe bază de oxizi de lantan, ytriu, bariu, stronțiu, cupru etc.
metalermie
Ocazional, lantanul este folosit în metalotermie pentru a reduce elementele rare.
Acoperiri speciale din sticlă
Pe baza compușilor de lantan, sunt produse acoperiri pentru geamuri care permit scăderea temperaturii în cameră cu 5-7 grade.
Materiale termoelectrice
Monotelurura de lantan are o f.e.m. termică foarte mare (834 μV/K) și este utilizată în generatoarele termoelectrice cu randament ridicat.
Producerea acumulatorilor de hidrogen cu hidrură metalică
Hidrura de lantan nichel este utilizată pe scară largă ca stocare de hidrogen de mare capacitate (hidrură de metal de stocare a hidrogenului) pentru automobile.
Energie nucleară
Lantanul metalic de înaltă puritate are o importanță absolut excepțională în industria nucleară, și în special în tehnologia de reprocesare a combustibilului nuclear în vederea extragerii plutoniului. Lantanul topit este amestecat cu uraniu metalic topit, care are ca impuritate plutoniul metalic. Lantanul topit extrage complet izotopii de plutoniu din cea mai mare parte a uraniului într-un aliaj și plutește deasupra uraniului fără a se amesteca cu acesta. Aliajul rezultat este drenat și prelucrat prin tehnologie chimică. Se poate argumenta că lantanul ține pe „umerii” săi producția de arme nucleare.
Electronică
În ultimii ani, interesul pentru molibdatul de lantan, care are o conductivitate ridicată, a crescut semnificativ.
microscopia electronică
Utilizarea catozilor LaB 6 (hexaboridă de lantan) în microscoapele electronice a făcut posibilă creșterea rezoluției prin creșterea densității curentului cu un factor de 6 și, simultan, creșterea duratei de viață a catodului cu un factor de 5 (până la 500 de ore) în comparație cu wolfram. catozi.
Surse de curent chimic
Producția și cercetarea în domeniul bateriilor cu electrolit solid prezintă un mare interes pentru industrie și electronică. În acest domeniu, fluorura de lantan a devenit foarte importantă ca electrolit, iar cu metalul de lantan ca anod, catodul este de obicei bismut, plumb sau fluorură de cupru. Latura atractivă a unor astfel de surse de curent este o intensitate energetică specifică foarte mare în ceea ce privește volumul, o perioadă lungă de stocare a energiei, rezistență și durabilitate; în acest sens, mulți experți de top le văd ca o alternativă la orice alte tipuri de baterii.
4. Rolul biologic
clorură de lantan metal chimic
La mijlocul anilor 1930, omul de știință sovietic A. A. Drobkov a studiat efectul metalelor pământurilor rare asupra diferitelor plante. A experimentat cu mazăre, napi și alte culturi, a introdus metale din pământuri rare cu sau fără bor, mangan. Rezultatele experimentelor au spus că metalele pământurilor rare sunt necesare pentru dezvoltarea normală a plantelor. Dar a trecut un sfert de secol înainte ca aceste elemente să devină relativ accesibile. Răspunsul final la întrebarea cu privire la rolul biologic al lantanului încă nu a fost dat.
În medicină, carbonatul de lantan este utilizat în hiperfosfatemie ca medicament care împiedică absorbția fosfatului din alimente.
Concluzie
În rezumatul meu, am examinat proprietățile fizice și chimice ale lantanului, precum și unde este utilizat lantanul, în ce industrii și în medicină.
Bibliografie
1. Arefieva „Chimie ecologică”, 2006
2. Gelfman „Chimie”, 2004
3. Nekrasov „Chimie generală”, 2007
4. Knyazev „Chimie anorganică”, 2004
5. http://ru.wikipedia.org/wiki/%D0%9B%D0%B0%D0%BD%D1%82%D0%B0%D0%BD
Documente similare
Familia lantanului și lantanidelor, caracteristicile proprietăților lor fizice și chimice. Istoria descoperirii, metodele de obținere, aplicarea lantanului și a compușilor săi. Structura învelișurilor de electroni ale atomilor de lantan și lantanide. Valențe anormale ale lantanidelor.
rezumat, adăugat 18.01.2010
Natura conductibilității ionice în solide. Tipuri de electroliți de oxid solid, utilizarea lor în diverse dispozitive. Structura și proprietățile oxidului de bismut, precipitarea sa chimică comună cu oxidul de lantan. Analiza electrolitului solid sintetizat.
lucrare de termen, adăugată 12.06.2013
Bariu metal și abundența sa în natură. Obținerea bariului metalic. Electroliza clorurii de bariu. Descompunerea termică a hidrurii. Proprietăți chimice și fizice. Aplicație. Conexiuni (proprietăți generale). compuși anorganici.
Acrilamidă: proprietăți fizice și chimice, solubilitate. Prepararea și determinarea toxicității acrilamidei. Caracteristicile utilizării acrilamidei și a derivaților. Aplicarea și producerea polimerilor de acrilamidă. Caracterizarea proprietăților chimice ale poliacrilamidei.
lucrare de termen, adăugată 19.06.2010
Proprietățile fizice și chimice ale 2-metilbutadienei-1,3. Analiza tipurilor de efecte periculoase, toxicitate, clasa de pericol. Aplicație în industrie. Metode de producție, chimie și tehnologie de proces. Producția de izopren pe bază de izobutilenă și formaldehidă.
lucrare de termen, adăugată 03.09.2015
Element al subgrupului principal al celui de-al doilea grup, a patra perioadă a sistemului periodic de elemente chimice a lui D. I. Mendeleev. Istoria și originea numelui. Găsirea calciului în natură. Proprietati fizice si chimice. Utilizarea calciului metalic.
rezumat, adăugat la 12.01.2012
Proprietățile fizice ale peroxidului de hidrogen - un lichid transparent incolor, cu un miros ușor deosebit. Obținerea unei substanțe în condiții de laborator și industriale. Proprietăți reducătoare și oxidante ale peroxidului de hidrogen, proprietățile sale bactericide.
prezentare, adaugat 23.09.2014
Istoria descoperirii stronțiului. Găsirea în natură. Obținerea stronțiului prin metoda aluminotermă și stocarea acestuia. proprietăți fizice. Proprietăți mecanice. Caracteristici atomice. Proprietăți chimice. Proprietăți tehnologice. Domenii de utilizare.
rezumat, adăugat 30.09.2008
Proprietăți fizice și fizico-chimice ale feritelor. Structura spinelului normal și inversat. Prezentare generală a metodei de sinterizare și presare la cald. Cristale magnetice cu structură hexagonală. Utilizarea feritelor în electronica radio și tehnologia computerelor.
lucrare de termen, adăugată 12.12.2016
Clorura de calciu: proprietăți fizice și chimice. aplicare și materii prime. Obținerea clorurii de calciu topită din lichidul distilatorului de producție de sifon. Prepararea clorurii de calciu și a clorurii de hidroxil din lichidul mamă. Calciu anhidru din acid clorhidric.