Simyacılar ayrıca, kimyasal elementleri sistematize etmenin mümkün olacağı bir doğa kanunu bulmaya çalıştılar. Ancak elementler hakkında güvenilir ve ayrıntılı bilgilerden yoksundular. XIX yüzyılın ortalarında. kimyasal elementler hakkında bilgi yeterli hale geldi ve elementlerin sayısı o kadar arttı ki bilimde onları sınıflandırmak için doğal bir ihtiyaç ortaya çıktı. Elementleri metaller ve metal olmayanlar olarak sınıflandırmaya yönelik ilk girişimlerin savunulamaz olduğu kanıtlandı. D.I. Mendeleev'in (I.V. Debereiner, J.A. Newlands, L.Yu. Meyer) öncülleri, periyodik yasanın keşfini hazırlamak için çok şey yaptılar, ancak gerçeği kavrayamadılar. Dmitry Ivanovich, elementlerin kütlesi ile özellikleri arasında bir bağlantı kurdu.
Dmitry Ivanovich Tobolsk'ta doğdu. Ailenin on yedinci çocuğuydu. Kendi şehrinde bir spor salonundan mezun olduktan sonra, Dmitry Ivanovich, iki yıl boyunca altın madalya ile yurtdışında bilimsel bir geziye çıktığı mezun olduktan sonra St. Petersburg'daki Ana Pedagoji Enstitüsü'ne girdi. Döndükten sonra St. Petersburg Üniversitesi'ne davet edildi. Kimya dersleri okumaya başlayan Mendeleev, öğrencilere önerilebilecek hiçbir şey bulamadı. çalışma Rehberi. Ve yeni bir kitap yazmaya karar verdi - "Kimyanın Temelleri".
Periyodik yasanın keşfinden önce 15 yıllık sıkı çalışma yapıldı. 1 Mart 1869'da Dmitry Ivanovich, iş için eyalet için St. Petersburg'dan ayrılmayı planladı.
Periyodik yasa, atomun özellikleri temelinde keşfedildi - bağıl atom kütlesi .
Mendeleyev kimyasal elementleri atom kütlelerine göre artan düzende düzenledi ve elementlerin özelliklerinin belirli bir süre sonra tekrar ettiğini fark etti - bir süre, Dmitry Ivanovich periyotları alt alta yerleştirdi, böylece benzer elementler alt alta yerleştirildi. - Aynı düşeyde, yani periyodik sistem elemanları inşa edildi.
1 Mart 1869 Periyodik yasanın D.I. Mendeleyev.
Basit maddelerin özellikleri ve elementlerin bileşiklerinin formları ve özellikleri, elementlerin atom ağırlıklarının büyüklüğüne periyodik olarak bağımlıdır.
Ne yazık ki, ilk başta Rus bilim adamları arasında bile periyodik yasanın çok az destekçisi vardı. Özellikle Almanya ve İngiltere'de çok sayıda rakip var.
Periyodik yasanın keşfi, bilimsel öngörünün parlak bir örneğidir: 1870'de Dmitry Ivanovich, ekasilicium, ekaalüminyum ve ekabor adını verdiği o zamanlar bilinmeyen üç elementin varlığını öngördü. Ayrıca yeni elementlerin en önemli özelliklerini doğru bir şekilde tahmin edebildi. Ve 5 yıl sonra, 1875'te Fransız bilim adamı P.E. Dmitry Ivanovich'in çalışmaları hakkında hiçbir şey bilmeyen Lecoq de Boisbaudran, galyum adını verdiği yeni bir metal keşfetti. Bir dizi özellik ve keşif yönteminde galyum, Mendeleev tarafından tahmin edilen ekaalüminyum ile çakıştı. Ama ağırlığı tahmin edilenden azdı. Buna rağmen, Dmitry Ivanovich, tahmininde ısrar ederek Fransa'ya bir mektup gönderdi.
Bilim dünyası, Mendeleev'in özellikleri tahmin etmesi karşısında şaşkına döndü. ekaalüminyum
çok doğru çıktı. Bu andan itibaren periyodik yasa kimyada kendini göstermeye başlar.
1879'da İsveç'teki L. Nilson, Dmitry Ivanovich tarafından tahmin edilen skandiyumu keşfetti. ekabor
.
1886'da K. Winkler, Almanya'da germanyumu keşfetti, bu da ortaya çıktı. exasilikon
.
Ancak Dmitry Ivanovich Mendeleev'in dehası ve keşifleri sadece bu tahminler değil!
Periyodik sistemin dört yerinde, D. I. Mendeleev, elementleri artan atom kütlelerine göre sıraladı:
19. yüzyılın sonlarında, D.I. Mendeleev, görünüşe göre atomun daha küçük parçacıklardan oluştuğunu yazdı. 1907'de ölümünden sonra atomun aşağıdakilerden oluştuğu kanıtlandı. temel parçacıklar. Atomun yapısı teorisi, Mendeleev'in doğruluğunu doğruladı, bu elementlerin atomik kütlelerin büyümesine uygun olmayan permütasyonları tamamen haklı.
Periyodik yasanın modern formülasyonu.
Kimyasal elementlerin ve bunların bileşiklerinin özellikleri, dış değerlik elektron kabuğunun yapısının periyodik tekrarında ifade edilen atomlarının çekirdeklerinin yükünün büyüklüğüne periyodik olarak bağlıdır.
Ve şimdi, periyodik yasanın keşfinden 130 yıldan fazla bir süre sonra, dersimizin sloganı olarak alınan Dmitry Ivanovich'in sözlerine dönebiliriz: “Gelecek, periyodik yasayı yıkımla tehdit etmiyor, sadece bir üst yapı ve geliştirme sözü verildi.” Şimdiye kadar kaç kimyasal element keşfedildi? Ve bu sınırdan uzak.
Periyodik yasanın grafik gösterimi, kimyasal elementlerin periyodik sistemidir. Bu kısa özet elementlerin ve bunların bileşiklerinin tüm kimyası.
Periyottaki atom ağırlıklarının değerindeki artışla birlikte periyodik sistemdeki özelliklerdeki değişiklikler (soldan sağa):
1. Metalik özellikler azalır
2. Metalik olmayan özellikler artar
3. Yüksek oksitlerin ve hidroksitlerin özellikleri bazikten amfoterik ve asidik olarak değişir.
4. Daha yüksek oksitlerin formüllerindeki elementlerin değeri, BenceöncekiVII, ve uçucu hidrojen bileşiklerinin formüllerinde azalır IV öncekiBence.
Periyodik sistemin inşasının temel ilkeleri.|
karşılaştırma işareti |
D.I. Mendeleyev |
|
1. Elemanların sayılara göre sırası nasıl belirlenir? (PS'nin temeli nedir?) |
Elementler artan göreli atom kütlelerine göre sıralanmıştır. Ancak, istisnalar vardır. Ar - K, Co - Ni, Te - I, Th - Pa |
|
2. Öğeleri gruplar halinde birleştirme ilkesi. |
Kalite işareti. Basit maddelerin özelliklerinin benzerliği ve aynı tür kompleks. |
|
3. Öğeleri periyotlarda birleştirme ilkesi. |
Dünya bilim tarihinde güvenle devrimci olarak adlandırılabilecek keşifler var. Birçoğu yok, ama bilimi yeni sınırlara getiren onlardı, problem çözmede temelde yeni bir yaklaşım gösteren onlardı, büyük ideolojik ve metodolojik öneme sahiptiler, bilimsel resmi daha derinden ve tam olarak ortaya koydular. Dünya. Bunlar, örneğin Ch. Darwin'in türlerin kökeni teorisini, G. Mendel'in kalıtım yasalarını, A. Einstein'ın görelilik teorisini içerir. DIMendeleev'in periyodik yasası bu tür keşiflerden biridir.
Dünya bilim ve kültür tarihinde, D.I. Mendeleev'in adı, tüm zamanların ve halkların en büyük düşünce aydınları arasında en onurlu yerlerden birini işgal ediyor. O sadece fizik, kimya, meteoroloji, metroloji, teknoloji, çeşitli sanayi ve tarım dalları, ekonomi alanlarında sağlam ve özgün eserler bırakan parlak ve çok yönlü bir bilim adamı değil, aynı zamanda seçkin bir öğretmen, ileri bir halk figürüydü. tüm yaşamları, anavatanlarının ve bilimlerinin refahı ve refahı için yorulmadan çalışmaya.
Çalışmalarından herhangi biri, Kimyanın Temelleri üzerine klasik bir ders olsun, çözeltiler teorisi veya gaz elastikiyeti üzerine çalışmalar, vb., bilim adamının adını çağdaşlarına duyurmakla kalmadı, aynı zamanda üzerinde önemli bir iz bıraktı. bilim tarihi. Ama yine de, D.I. Mendeleev hakkında konuşurken aklımıza gelen ilk şey, onun tarafından keşfedilen periyodik yasa ve derlenen kimyasal elementler tablosudur. Günümüzün bir ders kitabından periyodik tablonun çarpıcı, tanıdık netliği, bilim adamının, maddelerin dönüşümleri hakkında kendisinden önce keşfedilen her şeyi anlama konusundaki devasa çalışmasını, yalnızca bir dehanın yapabileceği bir çalışmayı bizden gizler. Bilim tarihinde eşi olmayan bir keşif ortaya çıktı, bu sadece atom ve moleküler teorinin en büyük başarısı olmakla kalmadı, aynı zamanda birkaç yüzyıl boyunca biriken tüm gerçek kimya materyalinin geniş bir genellemesi olduğu ortaya çıktı. Bu nedenle, periyodik yasa, kimyanın ve diğer doğa bilimlerinin tüm gelişimi için sağlam bir temel haline geldi.
DI Mendeleev'in bu keşfin yolunu ilk çalışmaları ile başlattığı söylenebilir, örneğin, özelliklerin kompozisyon ile ilişkisini incelerken, önce tek tek elementlerin özelliklerini analiz etmeye başladığı İzomorfizm ve Spesifik Hacimler, sonra doğal gruplar ve basit olanlar da dahil olmak üzere tüm bileşik sınıfları. Ama bu soruna en çok Kimyanın Temelleri adlı ders kitabını yazarken geliyor. Gerçek şu ki, Rusça ve yabancı dillerdeki mevcut ders kitapları arasında hiçbiri onu tam olarak tatmin etmedi. Karlsruhe'deki Uluslararası Kongre'den sonra, kimyagerlerin çoğunluğu tarafından kabul edilen yeni ilkelere dayanan ve kimya teorisi ve pratiğindeki en son başarıları yansıtan bir kimya ders kitabı gerekliydi. Kimyanın Temelleri'nin ikinci bölümünün hazırlanma sürecinde bilim tarihinde eşi benzeri olmayan bir keşif yapıldı. Önümüzdeki iki yıl boyunca, D.I. Mendeleev, bu keşifle bağlantılı olarak ortaya çıkan bir dizi konunun açıklığa kavuşturulmasıyla ilgili önemli teorik ve deneysel araştırmalarla uğraştı. Bu çalışmanın sonucu, 1871'de yayınlanan Kimyasal Elementlerin Periyodik Yasası makalesiydi. Annals of Chemistry and Eczacılıkta. Keşfettiği yasanın tüm yönlerini geliştirdi ve tutarlı bir şekilde özetledi ve en önemli uygulamalarını formüle etti, yani. D.I. Mendeleev, geleceğin kimyasında yönlendirilmiş araştırma yöntemine dikkat çekti. DIMendeleev'den sonra kimyacılar bilinmeyeni nerede ve nasıl arayacaklarını biliyorlardı. Periyodik yasaya dayanan birçok önemli bilim adamı, bilinmeyen kimyasal elementleri ve özelliklerini öngördü ve tanımladı. Tahmin edilen her şey, yeni bilinmeyen elementler ve bunların özellikleri ve bileşiklerinin özellikleri, doğadaki davranışlarının yasaları - her şey bulundu, her şey doğrulandı. Bilim tarihi böyle bir zaferden başka bir şey bilmiyor. açık yeni yasa Doğa. Bilim, birbirinden farklı, ilgisiz maddeler yerine, Evrenin tüm unsurlarını tek bir bütün halinde birleştiren tek ve uyumlu bir sistemle karşı karşıya kaldı.
Ancak D.I. Mendeleev'in bıraktığı bilimsel antlaşma sadece yeninin keşfinde değildi. Bilimin önüne daha da iddialı bir görev koydu: tüm elementler arasındaki, fiziksel ve kimyasal özellikleri arasındaki karşılıklı ilişkiyi açıklamak. Periyodik yasanın keşfinden sonra, tüm elementlerin atomlarının tek bir plana göre inşa edildiği, yapılarının ancak periyodikliklerini belirleyen şekilde olabileceği anlaşıldı. kimyasal özellikler. D.I. Mendeleev yasası, atomun yapısı, maddelerin doğası hakkında bilginin gelişimi üzerinde büyük ve belirleyici bir etkiye sahipti. Buna karşılık, atom fiziğinin başarıları, yeni araştırma yöntemlerinin ortaya çıkması ve kuantum mekaniğinin gelişimi, periyodik yasanın özünü genişletti ve derinleştirdi ve bu güne olan ilgisini korudu.
10 Temmuz 1905'te günlüğüne yazdığı DI Mendeleev'in sözlerini alıntılamak istiyorum: Görünüşe göre gelecek, periyodik yasayı yıkımla tehdit etmiyor, sadece üst yapılar ve gelişme vaat ediyor (Yu. Solovyov. Kimya Tarihi ).
Kimya, başka hiçbir bilimde olmadığı kadar son yüzyıllar ağırlık ve önemi. Araştırma sonuçlarının pratik kullanımı insanların hayatlarını derinden etkilemiştir. Bu, bugün kimya tarihine olduğu kadar, aralarında abartısız Dmitri İvanoviç Mendeleev'in de bulunduğu büyük kimyagerlerin yaşamına ve çalışmalarına olan ilgiyle bağlantılıdır. O, üstlenemeyeceği herhangi bir işte önemli başarılar elde etmiş gerçek bir bilim adamının bir modelidir. Olağanüstü Rus bilim adamının bilimsel düşünceden bağımsız olması, yalnızca deneysel çalışmaların sonuçlarına güvenme, genel kabul görmüş fikirlerle çeliştiğinde bile sonuçlara varma cesareti gibi karakter özellikleri saygı uyandıramaz. Ancak periyodik yasanın ve derlenmiş elementler sisteminin onun en önemli eseri olduğu konusunda hemfikir olunamaz. Bu konu ilgimi çekti çünkü bu alandaki araştırmalar hala çok alakalı. Bu, Rus ve Amerikalı bilim adamları tarafından D.I. Mendeleev'in periyodik sisteminin 118 elementinin son keşfi ile değerlendirilebilir. Bu bilimsel olay, bir asırdan fazla tarihe rağmen, periyodik yasanın bilimsel araştırmanın temeli olmaya devam ettiğini bir kez daha vurgulamaktadır. Bu çalışma sadece bu büyük yasanın keşfini, bu olaydan önceki gerçekten devasa çalışmayı anlatmakla kalmayıp, aynı zamanda ön koşulları anlama, 1869'dan önceki kimyasal elementlerin sınıflandırılması ve sistemleştirilmesi ile mevcut durumu analiz etme girişimidir. ve ayrıca etkiler yakın tarih periyodiklik doktrini.
Periyodik yasanın keşfi için ön koşullar
Bilimdeki herhangi bir keşif, elbette, asla ani değildir, yoktan yoktan ortaya çıkmaz. Bu, birçok dikkate değer bilim insanının katkıda bulunduğu karmaşık ve uzun bir süreçtir. Periyodik kanunda da benzer bir durum söz konusudur. Ve, periyodik yasanın keşfi ve doğrulanması için gerekli koşulları yaratan ön koşulları daha açık bir şekilde sunmak için, 19. yüzyılın ortalarında kimya alanındaki ana araştırma yönleri dikkate alınmalıdır (ek. sekme. 1).
Bunu XIX yüzyılın ilk on yıllarında söylemeliyim. kimyanın gelişiminde hızlı ilerleme oldu. Yüzyılın başlarında ortaya çıkan kimyasal atomizm, teorik problemlerin gelişimi ve deneysel araştırmaların gelişimi için güçlü bir uyarıcıydı ve bu da temel kimyasal yasaların (çoklu oranlar yasası ve sabit oranlar yasası, tepkimeye giren gazların hacimleri yasası, Dulong ve Petit yasası, izomorfizm kuralı ve diğerleri). Elementlerin atom ağırlıklarının belirlenmesi, yeni elementlerin keşfi ve çeşitli kimyasal bileşiklerin bileşiminin incelenmesi ile bağlantılı, esas olarak kimyasal-analitik nitelikteki deneysel araştırmalarda da önemli ilerleme kaydedilmiştir. Ancak atom ağırlıklarının belirlenmesiyle, temel olarak en basit bileşiklerin (oksitler) kesin formüllerinin, araştırmacıların atom ağırlıklarını hesapladıkları temelinde bilinmemesi nedeniyle zorluklar ortaya çıktı. Bu arada, atom ağırlıklarının kesin değerlerini belirlemede önemli kriterler olarak hizmet edebilecek halihazırda keşfedilen bazı düzenlilikler çok nadiren kullanıldı (Gay-Lussac'ın hacim yasası, Avogadro yasası). Çoğu kimyager, katı bir olgusal temele sahip olmayan onları rastgele olarak kabul etti. Atom ağırlığı tanımlarının doğruluğuna olan bu güven eksikliği, sayısız atom ağırlığı ve eşdeğeri sisteminin ortaya çıkmasına neden oldu ve hatta kimyada atom ağırlığı kavramının kabul edilmesi gerektiği konusunda şüphelere yol açtı. Bu karışıklığın bir sonucu olarak, 19. yüzyılın ortalarında nispeten basit bileşikler bile tasvir edilmiştir. birçok formül, örneğin, su aynı anda dört formülle, asetik asit on dokuzla, vb. Ancak aynı zamanda, birçok kimyager, atom ağırlıklarını belirlemek için yeni yöntemlerin yanı sıra, oksitlerin analizinden elde edilen değerlerin doğruluğunu en azından dolaylı olarak doğrulamayı mümkün kılacak yeni kriterler aramaya devam etti. Gerard tarafından önerilen atom, molekül ve eşdeğeri kavramları zaten mevcuttu, ancak bunlar çoğunlukla genç kimyagerler tarafından kullanılıyordu. Berzelius, Liebig ve Dumas sayesinde 20'li ve 30'lu yıllarda bilime giren fikirleri eski nesillerin etkili kimyagerleri tuttu. Kimyagerler birbirlerini anlamaktan vazgeçtiğinde bir durum ortaya çıktı. Böyle zor bir ortamda, fikir en önde gelen bilim adamlarını bir araya getirmek için ortaya çıktı. Farklı ülkeler en çok fikirlerin birliği üzerinde anlaşmaya varmak Genel Konular kimya, özellikle - temel kimyasal kavramlar hakkında. Bu Uluslararası Kongre 1860'ta gerçekleşti. Karlsruhe'de. Yedi Rus kimyager arasında D.I. Mendeleev de buna katıldı. Kongrenin temel amacı - kimyanın temel kavramlarının - atom, molekül, eşdeğer - tanımlarında birliğe ulaşmaktı. Atom-moleküler teorinin temellerini özetleyen S. Cannizzaro'nun konuşması, D.I. Mendeleev de dahil olmak üzere kongre katılımcıları üzerinde özellikle büyük bir etki yarattı. Daha sonra, DI Mendeleev, genel olarak kimyanın ilerlemesi ve özellikle kimyasal elementlerin periyodik yasası fikrinin oluşumu için Karlsruhe'deki kongrenin büyük önemini defalarca kaydetti ve S. Cannizzaro selefini düşündü, çünkü . kurduğu atom kütleleri gerekli dayanağı sağladı.
O zamana kadar bilinen unsurları sistemleştirmeye yönelik ilk girişimler 1789'da yapıldı. A. Lavoisier kimya ders kitabında. Basit Cisimler Tablosu 35 basit madde içeriyordu. Ve periyodik yasa keşfedildiği zaman, zaten 63 tanesi vardı, bunu 19. yüzyılın ilk yarısında söylemeliyim. Bilim adamları, özelliklerinde benzer olan elementlerin çeşitli sınıflandırmalarını önerdiler. Bununla birlikte, atom ağırlığına bağlı olarak özelliklerde değişiklik kalıpları oluşturma girişimleri rastgele bir yapıya sahipti ve çoğu zaman doğru ilişkilerin bireysel gerçeklerini belirtmekle sınırlıydı. Sayısal değerler benzer elementlerden oluşan gruplardaki tek tek elementler arasındaki atom ağırlıkları. Örneğin, 1816 - 1829'da Alman kimyager I. Döbereiner. Bazı kimyasal olarak benzer elementlerin atom ağırlıklarını karşılaştırırken, doğada yaygın olarak dağılmış birçok element için bu sayıların oldukça yakın olduğunu ve Fe, Co, Ni, Cr, Mn gibi elementler için neredeyse aynı olduğunu buldum. Ayrıca, SrO'nun bağıl atom ağırlığının, CaO ve BaO'nun atom ağırlıklarının yaklaşık aritmetik ortalaması olduğunu kaydetti. Bu temelde, Debereiner, benzer kimyasal özelliklere sahip elementlerin, örneğin Cl, Br, J veya Ca, Sr, Ba gibi üç elementten (üçlüler) oluşan gruplara ayrılabileceğini belirten üçlüler yasasını önerdi. Bu durumda, üçlünün orta elementinin atom ağırlığı, uç elementlerin atom ağırlıklarının toplamının yarısına yakındır.
Debereiner ile eşzamanlı olarak, L. Gmelin de benzer bir problemle uğraştı. Bu nedenle, iyi bilinen referans kılavuzunda - Handbuch der anorganischen Chemie'de, gruplar halinde düzenlenmiş kimyasal olarak benzer elementlerin bir tablosunu verdi. kesin emir. Ancak masasını oluşturma ilkesi biraz farklıydı (uygulama sekmesi 2). Tablonun üst kısmında, element gruplarının dışında, üç temel element vardı - O, N, H. Altlarına üçlüler, tetradlar ve pentadlar yerleştirildi ve oksijenin altında metaloid grupları vardı (Berzelius'a göre), yani hidrojen - metaller altında elektronegatif elementler. Element gruplarının elektropozitif ve elektronegatif özellikleri yukarıdan aşağıya doğru azalır. 1853'te Gmelin'in tablosu, nadir toprak ve yeni keşfedilen elementleri (Be, Er, Y, Di, vb.) içeren I. G. Gledstone tarafından genişletildi ve geliştirildi. Gelecekte, bir dizi bilim adamı, örneğin E. Lenssen gibi üçlüler yasasını inceledi. 1857'de 20 üçlüden oluşan bir tablo derledi ve atom ağırlıklarını üç üçlüye veya eklere (dokuzlara) dayalı olarak hesaplamak için bir yöntem önerdi. Yasanın mutlak doğruluğundan o kadar emindi ki, bazı nadir toprak elementlerinin hala bilinmeyen atom ağırlıklarını hesaplamaya bile çalıştı.
Elementlerin fiziksel ve kimyasal özellikleri arasındaki ilişkiyi kurmaya yönelik diğer girişimler, atom ağırlıklarının sayısal değerlerinin karşılaştırmasına da indi. 1850'de M.I. Pettenkofer. bazı elementlerin atom ağırlıklarının 8'in katı kadar farklı olduğunu fark etti. Bu tür karşılaştırmaların nedeni, homolog organik bileşikler serisinin keşfiydi. Hesaplamalar yapan M. Pettenkofer, elementler için benzer sıraların varlığını belirlemeye çalışırken, bazı elementler için atom ağırlıklarındaki farkın 8, bazen 5 veya 18 olduğunu buldu. 1851'de. elementlerin atom ağırlıklarının değerleri arasında doğru sayısal ilişkilerin varlığına ilişkin benzer düşünceler J.B. Dumas tarafından ifade edildi.
XIX yüzyılın 60'larında. atomik ve eşdeğer ağırlıkların ve biraz farklı türdeki elementlerin kimyasal özelliklerinin karşılaştırılması ortaya çıktı. Gruplardaki elementlerin özelliklerinin karşılaştırılmasıyla birlikte, element gruplarının kendileri de birbirleriyle karşılaştırılmaya başlandı. Bu tür girişimler, bilinen öğelerin tümünü veya çoğunu birleştiren çeşitli tablo ve grafiklerin oluşturulmasına yol açmıştır. İlk tablonun yazarı V. Odling'di. 57 elementi (son versiyonda) 17 gruba ayırdı - monadlar, ikililer, üçlüler, tetradlar ve pentalar, bir dizi element içermeden. Bu tablonun anlamı oldukça basitti ve temelde yeni bir şeyi temsil etmiyordu. Birkaç yıl sonra, daha doğrusu 1862'de Fransız kimyager B. de Chancourtua, elementlerin atom ağırlıkları arasındaki oranları ifade etmeye çalıştı. geometrik şekil(uygulama sekmesi 3). Tüm elementleri, 45o'lik bir açıyla uzanan sarmal bir çizgi boyunca silindirin yan yüzeyinde atom ağırlıklarına göre artan düzende yerleştirdi. Silindirin yan yüzeyi 16 parçaya bölünmüştür (oksijen atom ağırlığı). Elementlerin atom ağırlıkları uygun bir ölçekte eğri üzerinde işaretlenir (hidrojenin atom ağırlığı birim olarak alınır). Silindiri genişletirseniz, yüzeyde (düzlem) birbirine paralel bir dizi doğru parçası elde edersiniz. Üstten ilk segmentte, atom ağırlığı 1 ila 16, ikinci - 16 ila 32, üçüncü - 32 ila 48, vb. olan elementler için noktalar vardır. L.A. Chugaev, Kimyasal Elementlerin Periyodik Tablosu adlı çalışmasında, de Chancourtois sisteminde, özelliklerin periyodik bir değişiminin açıkça ortaya çıktığını kaydetti ... Bu sistemin zaten periyodik yasanın tohumunu içerdiği açıktır. Ancak Chancourtua sistemi keyfiliğe geniş bir kapsam sağlar. Bir yandan, elementler arasında analoglar genellikle tamamen yabancı unsurlara rastlar. Yani oksijen ve kükürtün arkasında, S ve Te arasında titanyum karşımıza çıkıyor; Mn, Li, Na ve K analoglarının sayısına düşer; demir, Ca ile aynı generatrix üzerine yerleştirilir, vb. Öte yandan, aynı sistem karbon için iki yer verir: biri - atom ağırlığı 12 olan C için, diğeri 44 atom ağırlığına karşılık gelen (N. Figurovsky. Genel Kimya Tarihi Anahattı). Böylece, elementlerin atom ağırlıkları arasındaki bazı ilişkileri sabitleyen Sancourtua, açık bir genellemeye - periyodik yasanın kurulmasına - gelemedi.
Chancartois sarmalıyla neredeyse aynı anda, J.A.R. Newlands'ın oktavlar yasası olarak adlandırdığı ve Odling'in tablolarıyla pek çok ortak noktası olan tablo sistemi ortaya çıktı (ek. sekme 4). İçindeki 62 eleman, yatay olarak düzenlenmiş 8 sütun ve 7 grup halinde eşdeğer ağırlıklara göre artan sırada düzenlenmiştir. Elementlerin sembollerinin atom ağırlıkları yerine sayılara sahip olması karakteristiktir. Toplamda 56 tane var.Bazı durumlarda iki eleman aynı sayının altında. Newlands, kimyasal olarak benzer elementlerin sayılarının 7 (veya 7'nin katları) ile birbirinden farklı olduğunu, örneğin seri numarası 9 (sodyum) olan bir elementin, element 2'nin (lityum) özelliklerini tekrarladığını vurguladı. Başka bir deyişle, müzikal ölçekte olduğu gibi aynı resim gözlenir - sekizinci nota ilkini tekrar eder. Bu nedenle tablonun adı. Newlands'ın oktav yasası defalarca analiz edilmiş ve eleştirilmiştir. çeşitli noktalar görüş. Elementlerin özelliklerindeki değişikliklerin periyodikliği sadece gizli bir biçimde görülür ve tabloda tek bir tane kalmaması gerçeği boş alan henüz keşfedilmemiş elementler için, bu tabloyu elementlerin sadece biçimsel bir karşılaştırması yapar ve onu doğa yasasını ifade eden bir sistemin anlamından mahrum eder. L.A. Chugaev'in belirttiği gibi, Newlands tablosunu derlerken eşdeğerleri yerine kullansaydı en son değerler Son zamanlarda Gerard ve Cannizzaro tarafından kurulan atom ağırlıkları, birçok çelişkiden kaçınabilirdi.
XIX yüzyılın 60'larında elementlerin atom ağırlıklarının karşılaştırılmasıyla uğraşan diğer araştırmacılar arasında, çeşitli özelliklerini dikkate alarak Alman kimyager L. Meyer adını verebilir. 1864 yılında Hidrojen değerliklerine göre altı sütunda düzenlenmiş 44 elementten (o sırada bilinen 63) oluşan bir tablo içeren Modern Kimya Teorileri ve Kimyasal Statik için Önemleri'ni yayınladı. Bu tablodan, Meyer'in her şeyden önce, benzer element gruplarındaki atom ağırlıklarının değerlerindeki farklılıkların doğruluğunu tespit etmeye çalıştığı görülebilir. Bununla birlikte, elementler arasındaki iç bağlantının en temel özelliğini - özelliklerinin periyodikliğini - fark etmekten çok uzaktı. 1870'de bile, periyodik yasa hakkında DI Mendeleev'in birkaç raporunun ortaya çıkmasından sonra, atom hacimlerindeki periyodik değişimin eğrisini yayınlayan Meyer, periyodik yasanın ifadelerinden biri olan bu eğride göremedi, kanunun en önemli özelliği. Bu arada, D.I. Mendeleev'in kendisi tarafından keşfedilen periyodik yasa hakkındaki ilk raporlarının ortaya çıkmasından birkaç ay sonra, L. Meyer bu keşfin önceliği konusunda bir iddiada bulundu ve birkaç yıl boyunca ısrarla bu konudaki iddialarını dile getirdi.
En genel anlamda, D.I. Mendeleev'in periyodik yasa hakkındaki ilk raporlarının ortaya çıkmasından önce üstlenilen unsurlar arasında dahili bir bağlantı kurmaya yönelik ana girişimler bunlardır.
D.I. Mendeleev, ne periyodik yasaya ayrılmış makalelerde ne de otobiyografik notlarda, keşfin nasıl yapıldığından pek bahsetmez. Ancak periyodik yasanın keşfinden otuz yıl sonra bir gün, bir gazeteci ona: Periyodik sistemi nasıl buldunuz?, D.I. Mendeleev cevap verdi: Belki yirmi yıl düşündüm (N. Figurovsky. D. I. Mendeleyev. 1834 - 1907). Gerçekten de, önceki tüm bilimsel faaliyetlerinin D.I. Mendeleev'in periyodik yasasının keşfine yol açtığı kesinlikle söylenebilir. İzomorfizm ve belirli hacimler üzerine ilk çalışmalarında zaten bir başlangıç yapıldı. Silikon ve karbon, D.I. Mendeleev'in dikkat ettiği, bireysellikleri için diğerleri arasında öne çıkan ilk unsurlardı. Karbon ve silikonun en önemli ikili bileşiklerinin genel formülleri aynıydı, ancak bileşiklerinin özelliklerinin bileşime bağımlılığını incelerken, aşağıdaki farklılıklar ortaya çıktı: bileşimde - belirli bileşikler karbonun karakteristiğidir ve belirsizdir. olanlar - silikon için; bileşiklerin yapısında - kararlı radikallerin ve homozincirlerin yanı sıra karbonda doymamış veya doymamış bileşiklerin ve silikonda heterozincirlerin varlığı. Bu, bu iki elementin çoğu bileşiğinin özelliklerinde önemli farklılıklara yol açtı. Bilim adamı, silisyum dışında başka hangi elementlerin belirsiz bileşikler oluşturabildiğiyle ilgileniyordu. Her şeyden önce bor ve fosfordular. Farklı elementlerin tuz oluşturma yeteneğinden bahseden ve birçok bileşiğin bileşiminin belirsizliğini vurgulayan DI Mendeleev, 1864'te şunları kaydetti: Belirsiz bileşikler, benzerliğe göre bileşiklerdir (çözeltiler, alaşımlar, izomorfik karışımlar esas olarak benzer cisimler tarafından oluşturulur) ve doğru kimyasal bileşikler benzerliğe göre bileşiklerdir.fark - uzak özelliklere sahip cisimlerin bağlantısı (M. Mladentsev. D. I. Mendeleev. Hayatı ve eseri).
Bileşiklerin kristal formları ve bunların bileşim ile ilişkileri üzerine yapılan araştırmaya dayanarak, DI Mendeleev, belirli bir bileşiğin bireysel (bileşiminin) genel olana (birkaç bileşikte bulunan aynı kristal form) tabi olabileceği sonucuna varmıştır. . Gerçekten de, kristal form türlerinin sayısı, olası kimyasal bileşiklerin sayısından önemli ölçüde düşüktür. İzomorfizm fenomenini inceleyen D.I. Mendeleev, birey ve genel arasındaki ilişki hakkında bir sonuç daha çıkardı: iki farklı elementin bazı bileşiklerinin izomorfik olduğu ortaya çıktı. Bununla birlikte, bu izomorfizm, karşılaştırılan bileşiklerin tüm oksidasyon aşamaları için değil, sadece bazıları için ortaya çıktı. Ek olarak, maddelerden birinin konsantrasyonunun diğerinin konsantrasyonundan belirgin şekilde daha düşük olması durumunda izomorfik karışımların oluşumunun da mümkün olduğu kaydedilmiştir. Ayrıca D.I. Mendeleev, polimer izomorfizminin varlığına ve oksitlerin asidik özelliklerin gelişme derecesine göre yerleştirildiği K2O, Na2O, MgO, FeO, Fe2O3, Al2O3, SiO2 serilerine dikkat çekti. Bu pozisyona şu yorumla eşlik etti: Gruplarla yer değiştirirken, kenarlarda duran cisimlerin toplamı, aralarındaki cisimlerin toplamı ile değiştirilir.
Bu konuların dikkate alınması, D.I. Mendeleev'i, bileşik sınıfları veya genel formülleri olan serileri arasında bir bağlantı aramaya yöneltti. Aralarındaki farklılığın sebebini elementlerin tabiatında gördü.
Araştırmasının bir sonucu olarak, D.I. Mendeleev, elementlerin çeşitli özelliklerinin ilişkisinin genel (tek), özel (özel) ve bireysel (tek) kategorileri ile karakterize edildiği sonucuna varmıştır. Genel özellikler, öncelikle bir element kavramıyla ilgili olan ve aynı olan özelliklerdir. belirli özellikler bir bütün olarak atom. D.I. Mendeleev bu tür özellikleri temel olarak adlandırdı ve bir elementin atom ağırlığının (atom kütlesi) bunlardan ilki olduğunu düşündü. Bileşiklerin özelliklerine gelince, belirli bir bileşik kümesi içinde genellenebilirler ve çeşitli kriterler temel alınabilir. Bu tür özelliklere spesifik (özel), örneğin basit maddelerin metalik ve metalik olmayan özellikleri, bileşiklerin asit-baz özellikleri vb. Bireysel olarak, iki analog elementi veya aynı sınıftaki iki bileşiği ayıran benzersiz özellikleri anlıyoruz, örneğin magnezyum ve kalsiyum sülfatların farklı çözünürlüğü vb. Moleküllerin ve atomların iç yapısı hakkında gerekli verilerin olmaması, D.I. Mendeleev'i çalışmalarında dikkate almaya zorladı. atomik ve moleküler hacimler gibi belirli hacimler. Bu özellikler, genel (atomik ve moleküler kütleler) ve bileşiklerin spesifik özelliklerinden (basit veya karmaşık bir maddenin yoğunluğu) hesaplanmıştır. Bu tür özelliklerdeki değişimin doğasını analiz eden D.I. Mendeleev, değişim kalıplarının spesifik yer çekimi ve element dizisindeki atom hacimleri, moleküldeki atom sayısı ve atomların kalitesi veya kimyasal bileşiklerin formu ile ilişkili elementlerin fiziksel ve kimyasal yapısındaki değişikliklerden etkilenir. Bu nedenle, bu tür özellikler genel özelliklerle ilişkilendirilse de, kaçınılmaz olarak belirli özellikler arasında oldukları ortaya çıktı - öğelerin doğasındaki nesnel farklılıkları yansıttılar. Bu, üç tür özellik, birbirleriyle ilişkileri ve kalıp bulma yolları hakkında bir fikirdir. Genel ve bireysel tezahürler daha sonra periyodiklik doktrininin temelini oluşturdu.
Dolayısıyla, yukarıdakilerin tümünü özetleyerek, 19. yüzyılın ortalarında, biriken materyali sistemleştirme sorununun, diğer bilimlerde olduğu gibi kimyadaki ana görevlerden biri olduğunu söyleyebiliriz. Basit ve karmaşık maddeler, o zaman bilimde kabul edilen sınıflandırmalara göre incelendi: ilk olarak fiziksel özelliklere göre ve ikinci olarak kimyasal özelliklere göre. Er ya da geç, iki sınıflandırmayı birbirine bağlamaya çalışmak gerekliydi. Bu tür birçok girişim D.I. Mendeleev'den önce bile yapıldı. Ancak elementlerin atom ağırlıklarını karşılaştırırken bazı sayısal modeller bulmaya çalışan bilim adamları, elementler arasındaki kimyasal özellikleri ve diğer ilişkileri görmezden geldi. Sonuç olarak, sadece periyodik yasaya ulaşmakta başarısız olmakla kalmadılar, hatta karşılaştırmalardaki tutarsızlıkları da ortadan kaldıramadılar. Gerçekten de, Odling, Newlands, Chancourtua, Meyer ve diğer yazarlar tarafından listelenen girişimler, bilimsel bir teorinin işaretlerinden yoksun, elementlerin özellikleri arasındaki iç ilişkilerin varlığına dair yalnızca bir ipucu içeren yalnızca varsayımsal şemalardır ve dahası, bir yasadır. Doğa. Tüm bu yapılarda var olan eksiklikler, öğeler arasında, hatta yazarların kendi aralarında bile evrensel bir bağlantının varlığı fikrinin doğruluğu konusunda şüphe uyandırdı. Bununla birlikte, D.I. Mendeleev, Kimyanın Temelleri'nde, de Chancourtua ve Newlands yapılarında, periyodik yasanın bazı mikroplarının görünür olduğunu not eder. Kompozisyon, özellikler ve bazen bileşiklerin yapısı hakkındaki bilgilerin toplamına dayanan bir element sınıflandırması geliştirme görevi, D.I. Mendeleev'in çoğuna düştü. Özellikler ve bileşim arasındaki ilişkinin incelenmesi, önce bireysel elementlerin özelliklerini (izomorfizm çalışmasında, spesifik hacimlerde, karbon ve silikonun özelliklerini karşılaştırırken kendini gösterir), ardından doğal grupları (atomik kütleler ve kimyasal özellikler) analiz etmesini sağladı. basit maddeler dahil tüm bileşik sınıfları (bir dizi fizikokimyasal özellik). Ve bu tür bir aramanın itici gücü Dumas'ın çalışmasıydı. Bu nedenle, D.I. Mendeleev'in çalışmasında ortak yazarların olmadığını, yalnızca öncüllerinin olduğunu haklı olarak söyleyebiliriz. Ve öncekilerden farklı olarak, D.I. Mendeleev belirli kalıplar aramadı, ancak temel nitelikteki genel bir sorunu çözmeye çalıştı. Aynı zamanda, öncekilerden farklı olarak, doğrulanmış nicel verilerle çalıştı ve elementlerin şüpheli özelliklerini kişisel olarak deneysel olarak doğruladı.
Periyodik yasanın keşfi
Kimyasal elementlerin periyodik yasasının keşfi, bilim tarihinde sıradan bir fenomen değil, belki de istisnai bir fenomendir. Bu nedenle, hem kimyasal elementlerin özelliklerinin periyodikliği fikrinin ortaya çıkışının hem de bu fikri geliştirmenin yaratıcı sürecinin, kapsamlı bir doğa yasasında somutlaşmasının ilgi çekici olması doğaldır. Şu anda, D.I.Mendeleev'in kendi ifadelerine ve yayınlanmış materyal ve belgelere dayanarak, D.I.Mendeleev'in bir elementler sisteminin geliştirilmesiyle ilgili yaratıcı etkinliğinin ana aşamalarını yeterli güvenilirlik ve eksiksizlikle geri yüklemek mümkündür.
1867'de Dmitry Ivanovich, St. Petersburg Üniversitesi'nde kimya profesörü olarak atandı. Böylece, başkentin üniversitesinde kimya kürsüsünü almış, yani. özünde Rusya'daki üniversite kimyagerlerinin lideri haline gelen Mendeleev, St. Petersburg ve diğer Rus üniversitelerinde kimya öğretimini önemli ölçüde geliştirmek için elinden gelen tüm önlemleri aldı. Dmitry Ivanovich'ten önce bu yönde ortaya çıkan en önemli ve acil görev, o zamanın kimyasının en önemli başarılarını yansıtan bir kimya ders kitabının oluşturulmasıydı. Hem G.I. Hess'in ders kitabı hem de öğrenciler tarafından kullanılan çeşitli tercüme baskılar çok eskiydi ve doğal olarak D.I. Mendeleev'i tatmin edemedi. Bu yüzden kendi planına göre hazırlanmış tamamen yeni bir kurs yazmaya karar verdi. Dersin adı Kimyanın Temelleri idi. 1869 başlarında ders kitabının karbon ve halojen kimyasına ayrılmış ilk bölümünün ikinci baskısı üzerindeki çalışmalar sona erdi ve Dmitry Ivanovich ikinci bölüm üzerinde çalışmaya gecikmeden devam etmeyi amaçladı. İkinci bölümün planını düşünen DI Mendeleev, mevcut kimya ders kitaplarındaki elementler ve bileşikleri üzerindeki malzemenin sırasının büyük ölçüde rastgele olduğuna ve sadece kimyasal olarak farklı element grupları arasındaki ilişkiyi yansıtmadığına dikkat çekti. , ancak benzer öğeler arasında bile. Kimyasal olarak birbirine benzemeyen element gruplarının değerlendirilme sırası sorusu üzerine düşünerek, kursun ikinci kısmı için planın temeli olması gereken bilimsel olarak doğrulanmış bazı ilkelerin olması gerektiği sonucuna vardı. Böyle bir ilke arayışı içinde, D.I. Mendeleev, istenen modeli keşfetmek için kimyasal olarak benzer element gruplarını karşılaştırmaya karar verdi. Biraz sonra başarısızlıkla sonuçlanmış denemeler kartlara o dönemde bilinen elementlerin sembollerini, yanlarında ise temel fiziksel ve kimyasal özelliklerini yazdı. Bu kartların dağılımını birleştiren DI Mendeleev, bilinen tüm elementlerin atom kütlelerine göre artan düzende düzenlenmesi durumunda, tüm seriyi periyotlara bölerek ve alt alta koyarak kimyasal olarak benzer element gruplarını seçmenin mümkün olduğunu keşfetti. öğelerin sırasını değiştirmeden. Yani 1 Mart 1869. İlk önce parça parça ve sonra tamamen ilk tablo derlendi - bir elementler sistemi. D.I. Mendeleev'in kendisi daha sonra bunun hakkında nasıl konuştu. Bana defalarca soruldu: neye dayanarak, hangi düşünceye dayanarak, periyodik yasayı buldum ve savundum? Burada mantıklı bir cevap vereceğim. ... Enerjimi maddeyi incelemeye adadıktan sonra, onda böyle iki işaret veya özellik görüyorum: alanı kaplayan ve çekimde kendini gösteren kütle ve en açık veya en gerçekçi şekilde - ağırlıkta ve bireysellik, olarak ifade edilir. kimyasal dönüşümler ve en açık şekilde - kimyasal elementler kavramında formüle edilmiştir. Madde hakkında düşünürken, herhangi bir malzeme atomu fikrine ek olarak, benim için iki sorudan kaçınılamaz: ne kadar ve ne tür bir madde verilir, hangi kütle ve kimya kavramlarına karşılık gelir. Madde ile ilgili bilim tarihi, yani. kimya, ister istemez, sadece madde kütlesinin sonsuzluğunun değil, aynı zamanda kimyasal elementlerin sonsuzluğunun da tanınması gerekliliğine yol açar. Bu nedenle, elementlerin kütlesi ile kimyasal özellikleri arasında zorunlu olarak bir bağlantı olması gerektiği fikri istemeden ortaya çıkar ve maddenin kütlesi, mutlak olmasa da, yalnızca göreli olmasına rağmen, sonunda atomlar şeklinde ifade edildiğinden, elementlerin bireysel özellikleri ile atom ağırlıkları arasında işlevsel bir yazışma aramak için gereklidir. Bir şey aramak ... bakmak ve denemekten başka türlü mümkün değildir. Böylece, elementlerin atom ağırlıkları ve temel özellikleri, benzer elementler ve yakın atom ağırlıkları ile ayrı kartlara yazarak seçmeye başladım, bu da hızlı bir şekilde elementlerin özelliklerinin atom ağırlıklarına periyodik olarak bağımlı olduğu sonucuna vardım, dahası, şüphe birçok belirsizlik, rastgeleliği kabul etmek imkansız olduğu için, yapılan sonucun genelliğinden bir an için şüphe duymadım (N. Figurovsky. Dmitry Ivanovich Mendeleev).
Bilim adamı, ortaya çıkan tabloya atom ağırlıklarına ve kimyasal benzerliklerine dayanan bir elementler sisteminin deneyimi adını verdi. Bu tablonun yalnızca Kimyanın Temelleri dersinin ikinci bölümünün mantıksal planının temelini sağlamakla kalmayıp, her şeyden önce doğanın en önemli yasasını ifade ettiğini hemen gördü. Birkaç gün sonra, basılı tablo (Rusça ve Fransızca başlıklarıyla) birçok önde gelen Rus ve yabancı kimyagere gönderildi. Keşfinin ana hükümleri, sonuçları ve genellemeleri lehine argümanlar, D.I. Mendeleev, özelliklerin elementlerin atom ağırlığı ile korelasyonu makalesinde ortaya koymaktadır. Bu çalışma, öğeleri sınıflandırma ilkelerinin tartışılmasıyla başlar. bilim adamı verir tarihsel bakış XlX yüzyılda sınıflandırma girişiminde bulunur ve şu anda tek bir sınıflandırma olmadığı sonucuna varır. Genel prensip Elemanların göreceli özelliklerini değerlendirmede bir destek olarak hizmet edebilen ve az çok katı bir sistemde düzenlenmesine izin veren eleştiriye dayanan . Sadece bazı element gruplarıyla ilgili olarak, bir bütün oluşturduklarına, maddenin benzer tezahürlerinin doğal bir dizisini temsil ettiklerine şüphe yoktur (M. Mladentsev. D. I. Mendeleev. Hayatı ve eseri). Ayrıca, Dmitry Ivanovich, onu elementler arasındaki ilişkileri incelemeye iten nedenleri, Kimyanın Temelleri adlı bir kimya rehberi derlemesini üstlendikten sonra, bazı basit cisimler sisteminde durmak zorunda kalması gerçeğiyle açıklıyor. dağıtımlarının rastgele, içgüdüsel güdüler tarafından değil, kesinlikle kesin bir başlangıç tarafından yönlendirileceğini. Bu kesin başlangıçtır, yani. DIMendeleev'in sonucuna göre elementler sisteminin ilkesi, elementlerin atom ağırlıklarının büyüklüğüne dayanmalıdır. Daha sonra en küçük atom ağırlıklarına sahip elementleri karşılaştıran Mendeleev, periyodik sistemin ilk temel parçasını oluşturur (ek. tab. 8). Büyük atom ağırlıklarına sahip elementler için de benzer oranların gözlemlendiğini belirtiyor. Bu gerçek, atom ağırlığının büyüklüğünün elementin doğasını belirlediği gibi, parçacığın ağırlığının da karmaşık bir cismin özelliklerini ve birçok reaksiyonunu belirlediği gibi en önemli sonucu formüle etmeyi mümkün kılar. Bilinen tüm öğelerin olası karşılıklı düzenlenmesi sorununu tartıştıktan sonra, D.I. Mendeleev tablosunu Elemanlar sisteminin deneyimi .... Makale, periyodik yasanın ana hükümleri haline gelen kısa sonuçlarla sona ermektedir: Atom ağırlıklarına göre düzenlenmiş elementler, özelliklerin açık bir periyodikliğini temsil eder ... Elementlerin veya grupların atom ağırlıklarına göre karşılaştırılması, sözde atomitelerine karşılık gelir. ve bir dereceye kadar, kimyasal doğada bir farklılığa ... Kişi, örneğin 65 - 75'lik bir paya sahip Al ve Si'ye benzer elementler gibi daha fazla bilinmeyen basit cismin keşfini beklemelidir ... Bir elementin atom ağırlığı, analojileri bilinerek bazen düzeltilebilir. Öyleyse, Te payı 128 değil, 123 - 126 olmalı? (N. Figurovsky. Dmitry Ivanovich Mendeleev). Bu nedenle, özelliklerin elementlerin atom ağırlığı ile korelasyonu makalesi, DI Mendeleev'in periyodik elementler sisteminin oluşturulmasına yol açan sonuçlarının sırasını açık ve net bir şekilde yansıtır ve sonuçlar, bilim adamının keşfinin önemini aşağıdakilerden ne kadar doğru değerlendirdiğini gösterir. En başta. Makale Rus Kimya Derneği Dergisi'ne gönderildi ve Mayıs 1869'da basıldı. Buna ek olarak, Rus Kimya Derneği'nin 18 Mart'ta gerçekleşen bir sonraki toplantısında bir rapor sunulması amaçlandı. D.I. Mendeleev o sırada bulunmadığından, Kimya Derneği Sekreteri N.A. Menshutkin onun adına konuştu. Topluluğun protokollerinde, bu toplantının kuru bir kaydı kaldı: N. Menshutkin, D. Mendeleev adına atom ağırlıklarına ve kimyasal benzerliklerine dayanan bir elementler sistemi deneyimini rapor ediyor. D. Mendeleev'in yokluğunda, bu raporun tartışılması bir sonraki toplantıya ertelendi (Çocuk Ansiklopedisi). Bu periyodik elementler sistemini ilk kez duyan D.I.'nin çağdaşları olan bilim adamları, buna kayıtsız kaldılar, daha sonra bilimsel düşüncenin tüm gelişimini değiştiren yeni doğa yasasını hemen anlayamadılar.
Bu nedenle, başlangıçta belirlenen görevin - kesin başlangıcı bulmak, Kimyanın Temelleri'nin ikinci bölümünde malzemenin rasyonel dağılımı ilkesini bulmak - çözülmüş gibi görünüyor ve D.I. Mendeleev kurs üzerinde çalışmaya devam edebilirdi. Ancak şimdi bilim adamının dikkati, gelişimi ona kimya üzerine bir ders kitabı yazmaktan daha önemli ve önemli görünen, elementler sistemi ve ortaya çıkan yeni fikirler ve sorular tarafından tamamen ele geçirildi. Yaratılan sistemde doğanın yasasını gören Dmitry Ivanovich, bulduğu desendeki bazı belirsizlikler ve çelişkilerle ilgili araştırmalara tamamen geçti.
Bu sıkı çalışma, 1869'dan 1869'a kadar neredeyse iki yıl devam etti. 1871'e kadar Araştırmanın sonuçları, D.I. Mendeleev'in elementlerin atomik hacimleri gibi yayınlarıydı (basit maddelerin atomik hacimlerinin atomik kütlelerin periyodik bir fonksiyonu olduğu söylenir); hidroklorik oksitlerdeki oksijen miktarı üzerinde (bir elementin tuz oluşturan oksitteki en yüksek değerliliğinin, atom kütlesinin periyodik bir fonksiyonu olduğu gösterilmiştir); seryumun elementler sistemindeki yeri hakkında (92'ye eşit olan seryumun atom ağırlığının doğru olmadığı ve 138'e çıkarılması gerektiği kanıtlanmıştır ve elementler sisteminin yeni bir versiyonu da verilmiştir). Sonraki makalelerden ikisi, periyodik yasanın ana hükümlerinin geliştirilmesi için en büyük öneme sahipti - doğal sistem Rusça olarak yayınlanan keşfedilmemiş elementlerin özelliklerinin belirtilmesine yönelik elementler ve uygulanması ve Almanca olarak basılan Kimyasal Elementler için Periyodik Yasallık. Sadece D.I. Mendeleev tarafından toplanan ve alınan periyodik yasa hakkındaki tüm verileri değil, aynı zamanda çeşitli fikirler ve bulgular henüz yayınlanmadı. Her iki makale de bilim adamı tarafından yapılan muazzam araştırma çalışmasını tamamlıyor. Periyodik yasanın nihai resmileşmesini ve formülasyonunu bu makalelerde aldı.
İlk makalenin başında D.I. Mendeleev, bazı gerçeklerin daha önce periyodik sistem çerçevesine uymadığını belirtiyor. Böylece bazı elementler, yani serit elementler, uranyum ve indiyum bu sistemde kendilerine uygun yer bulamamışlardır. Ama ... şu anda, - D.I. Mendeleev ayrıca yazıyor, - periyodik yasallıktan bu tür sapmalar ... geçmişte mümkün olduğundan çok daha eksiksiz bir şekilde ortadan kaldırılabilir (N. Figurovsky. Dmitry Ivanovich Mendeleev). Uranyum, serit metalleri, indiyum vb. için sistemde önerdiği yerleri doğrular. Makaledeki merkezi konum, ilk versiyonlara kıyasla daha mükemmel bir biçimde periyodik sistem tablosu tarafından işgal edilir. Dmitry Ivanovich ayrıca yeni bir isim öneriyor - Doğal Elementler Sistemi, böylece periyodik sistemin elementlerin doğal bir düzenlemesi olduğunu ve hiçbir şekilde yapay olmadığını vurguluyor. Sistem, elementlerin atom ağırlıklarına göre dağılımına dayanır ve periyodiklik hemen fark edilir. Buna dayanarak, tabloda Romen rakamlarıyla gösterilen elementler için yedi grup veya yedi aile derlenir. Ayrıca potasyum ve rubidyum ile başlayan periyotlardaki bazı elementler sekizinci gruba atanır. Ayrıca, D.I. Mendeleev, periyodik sistemdeki bireysel kalıpları karakterize eder, içinde büyük periyotların varlığına, aynı grubun elemanlarının özelliklerindeki farklılıklara ve tek ve çift serilere işaret eder. Sistemin önemli özelliklerinden biri olarak, Dmitry Ivanovich en yüksek element oksitlerini alır ve her element grubu için tablo tip oksit formüllerine girer. Ayrıca, diğer element bileşiklerinin tipik formülleri konusunu, bu bileşiklerin özelliklerini, periyodik sistemdeki bireysel elementlerin yerlerinin gerekçesi ile bağlantılı olarak tartışır. Elementlerin bazı fiziksel ve kimyasal özelliklerini karşılaştırdıktan sonra D.I. Mendeleev, henüz keşfedilmemiş kimyasal elementlerin özelliklerini tahmin etme olasılığı sorusunu gündeme getiriyor. Periyodik tabloda, bilinen elementler tarafından işgal edilmeyen bir dizi hücrenin varlığının dikkat çekici olduğuna dikkat çekiyor. Bu, her şeyden önce, bor, alüminyum ve silikon gibi benzer elementlerin üçüncü ve dördüncü gruplarındaki boş hücreler için geçerlidir. D.I. Mendeleev, gelecekte keşfedildiklerinde tablodaki boş hücreleri işgal etmesi gereken doğadaki elementlerin varlığı hakkında cesur bir varsayımda bulunuyor. O sadece geleneksel isimler (ecabor, ekaalüminyum, ecasilicon) sunmakla kalmaz, aynı zamanda periyodik sistemdeki konumlarına göre bu elementlerin hangi fiziksel ve kimyasal özelliklere sahip olması gerektiğini de açıklar. Bildiri ayrıca tablonun diğer boş hücrelerini doldurabilen öğelerin varlığının olasılığı sorusunu da tartışıyor. Ve sanki söylenenleri özetler gibi, D.I. Mendeleev, önerilen elementler sisteminin hem kendilerinin hem de onların oluşturduğu bileşiklerin karşılaştırılmasına uygulanmasının, şimdiye kadar hiçbir bakış açısının vermediği faydalar sunduğunu yazıyor. kimyada kullanılan gözenekler.
İkinci kapsamlı çalışma - Periyodiklik yasası üzerine - bilim adamı tarafından 1871'de tasarlandı. Dünya bilim topluluğunun geniş çevrelerini onunla tanıştırmak için keşfin eksiksiz ve doğrulanmış bir sunumunu yapması gerekiyordu. Bu çalışmanın ana kısmı, Annals of Chemistry and Pharmacy'de yayınlanan Kimyasal Elementlerin Periyodik Yasası makalesiydi. Makale, bilim adamının iki yıldan fazla çalışmasının sonucuydu. Giriş bölümünden sonra, bazı önemli tanımların ve her şeyden önce bir element ve basit bir cisim kavramlarının tanımının yanı sıra elementlerin ve bileşiklerin özellikleri ve bunların karşılaştırma olasılıkları hakkında bazı genel değerlendirmeler ve Genellemeler, DI Mendeleev, periyodik yasanın hükümlerini ve ondan çıkan sonuçları kendi araştırmalarıyla bağlantılı olarak en önemli olarak değerlendirir. Dmitry Ivanovich, elementlerin atom ağırlıklarının, oksitlerinin ve oksit hidratlarının formüllerinin karşılaştırılmasına dayanan periyodiklik yasasının özünde, atom ağırlıkları ile elementlerin diğer tüm özellikleri arasında yakın ve düzenli bir ilişki olduğunu belirtir. Atom ağırlıklarına göre artan düzende düzenlenmiş elementlerin özelliklerinde düzenli bir değişimin ortak işareti, özelliklerin periyodikliğidir. Atom ağırlığı arttıkça elementlerin önce daha fazla değişken özelliklere sahip olduğunu ve daha sonra bu özelliklerin yeni bir düzende, yeni bir satırda ve birkaç elementte ve bir öncekiyle aynı sırada tekrarlandığını yazar. diziler. Bu nedenle, periyodiklik yasası şu şekilde formüle edilebilir: Elementlerin özellikleri ve dolayısıyla oluşturdukları basit ve karmaşık cisimlerin özellikleri, atom ağırlıklarına periyodik olarak bağlıdır (yani doğru bir şekilde tekrar ederler). Ayrıca, belirtilen temel konum, hem elementlerin hem de onlar tarafından oluşturulan bileşiklerin özelliklerinde çok sayıda periyodik değişiklik örneği ile gösterilmiştir. İkinci paragraf Periyodiklik yasasının elementlerin sistematiğine uygulanması, elementler sisteminin sadece pedagojik öneme sahip olmadığı, sadece çeşitli gerçeklerin çalışılmasını, onları düzene ve bağlantıya sokmayı kolaylaştırmakla kalmayıp, aynı zamanda tamamen bilimsel önem, analojiler açmak ve bu sayede yenilerini işaret etmek. unsurları keşfetmenin yolları. Burada, elementlerin periyodik sistemdeki (berilyum, vanadyum, talyum) konumuna, özellikle oranlar yöntemine dayalı olarak elementlerin atom ağırlıklarını ve bileşiklerinin özelliklerini hesaplamak için yöntemler listelenmiştir. Daha Az Bilinen Elementlerin Atom Ağırlıklarını Belirlemek İçin Periyodiklik Yasasının Uygulanması, bazı elementlerin periyodik tablodaki konumunu tartışır ve bir element sistemine dayalı olarak atom ağırlıklarını hesaplamak için bir yöntemi tanımlar. Gerçek şu ki, periyodik yasanın keşfi sırasında, D.I. Mendeleev'in belirttiği gibi, bir dizi elementin atom ağırlıkları, bazen çok titrek işaretlere dayanıyordu. Bu nedenle, bazı elementler, periyodik sisteme sadece o zaman kabul edilen atom ağırlığına göre yerleştirildiğinde, açıkça yersiz olduğu ortaya çıktı. Bu tür elementlerin fiziksel ve kimyasal özelliklerinin kompleksinin dikkate alınmasına dayanarak, D.I. Mendeleev sistemde özelliklerine karşılık gelen bir yer önerdi ve bazı durumlarda o zamana kadar kabul edilen atom ağırlıklarını revize etmek gerekiyordu. Böylece atom ağırlığı 75 olarak alınan ve buna göre ikinci gruba yerleştirilmesi gereken indiyum, atom ağırlığını 113 düzeltirken, bilim adamı üçüncü gruba geçti. Atom ağırlığı 120 olan uranyum için ve bileşiklerinin fiziksel ve kimyasal özelliklerinin ve özelliklerinin ayrıntılı bir analizine dayanarak üçüncü grupta bir pozisyon altıncı grupta bir yer teklif edildi ve atom ağırlığı iki katına çıkarıldı (240). Ayrıca, yazar, özellikle o zamanlar, nadir toprak elementlerinin periyodik sistemine - seryum, didymiyum, lantan, itriyum, erbiyum - yerleştirme konusunda çok zor bir soru düşündü. Ancak bu sorun ancak otuz yıldan fazla bir süre sonra çözüldü. Bu çalışma, belki de özellikle periyodik yasayı doğrulamak için önemli olan, henüz keşfedilmemiş elementlerin özelliklerinin belirlenmesine periyodiklik yasasının uygulanmasıyla sona ermektedir. Burada, D.I.Mendeleev, tablonun bazı yerlerinde, gelecekte açılması gereken birkaç unsurun açıkça eksik olduğuna dikkat çekiyor. Başta bor, alüminyum ve silikon analogları (ekabor, ekaalüminyum, ekasilikon) olmak üzere henüz keşfedilmemiş elementlerin özelliklerini tahmin eder. Henüz bilinmeyen elementlerin özelliklerine ilişkin bu tahminler, yalnızca parlak bir bilim insanının keşfettiği yasaya olan kesin güvenine dayanan bilimsel cesaretini değil, aynı zamanda bilimsel öngörünün gücünü de karakterize eder. Galyum, skandiyum ve germanyumun keşfinden birkaç yıl sonra, tüm tahminleri parlak bir şekilde doğrulandığında, periyodik yasa tüm dünyada kabul edildi. Bu arada makalenin yayımlanmasından sonraki ilk yıllarda bu tahminler bilim dünyası tarafından neredeyse fark edilmeden kaldı. Ayrıca makalede, bazı elementlerin atom ağırlıklarının periyodik yasaya göre düzeltilmesi ve elementlerin kimyasal bileşiklerinin formları hakkında ek veriler elde etmek için periyodik yasanın uygulanması konusuna değinildi.
Yani, 1871'in sonunda. D.I. Mendeleev tarafından yapılan periyodik yasanın tüm ana hükümleri ve ondan çok cesur sonuçlar sistematik bir sunumda yayınlandı. Bu makale, DI Mendeleev'in periyodik yasa hakkındaki araştırmasının ilk ve en önemli aşamasını tamamladı, ilk tablosunu derledikten sonra bilim adamının önünde ortaya çıkan çeşitli sorunları çözme konusunda iki yıldan fazla titanik çalışmanın meyvesi oldu. Mart 1869'da elementler. Sonraki yıllarda, Dmitry Ivanovich zaman zaman periyodik yasanın daha da geliştirilmesi ile ilgili bireysel sorunların geliştirilmesine ve tartışılmasına geri döndü, ancak artık 1869 - 1871'de olduğu gibi bu alanda uzun vadeli sistematik araştırmalarla uğraşmadı. D.I. Mendeleev'in 90'ların sonundaki çalışmalarını şöyle değerlendirdiği: Bu, daha sonra bu sistem hakkında çok şey yazılan, elementlerin periyodikliği ve orijinal hakkındaki görüşlerimin ve düşüncelerimin en iyi seti. Bilimsel şöhretimin ana nedeni bu, çünkü çok daha sonra haklı çıktı (R. Dobrotin. D. I. Mendeleev'in yaşam ve eserinin tarihi). Makale, keşfettiği yasanın tüm yönlerini geliştirdi ve tutarlı bir şekilde özetledi ve en önemli uygulamalarını formüle etti. Burada, DI Mendeleev, periyodik yasanın kanonik formülasyonu haline gelen rafine bir şey verir: ... elementlerin özellikleri (ve sonuç olarak, onlardan oluşan basit ve karmaşık cisimler) periyodik olarak atom ağırlıklarına bağlıdır (R. Dobrotin. D I. Mendeleev'in yaşamının ve çalışmalarının tarihi). Aynı makalede, bilim adamı ayrıca genel olarak doğa yasalarının temel doğası için bir ölçüt verir: Her doğa yasası, ancak, tabiri caizse, pratik sonuçları kabul ederse, yani. açıklanamayanları açıklayan ve şimdiye kadar bilinmeyen fenomenlere işaret eden bu tür mantıksal sonuçlar ve özellikle yasa, deneyimle test edilebilecek tahminlere yol açıyorsa. İkinci durumda, yasanın önemi açıktır ve en azından yeni bilim alanlarının gelişimini teşvik eden geçerliliğini doğrulamak mümkündür (R. Dobrotin. D. I. Mendeleev'in yaşam ve eserinin tarihi). Bu tezi periyodik yasaya uygulayan Dmitry Ivanovich, aşağıdaki uygulama olasılıklarını adlandırıyor: elementler sistemine; hala bilinmeyen elementlerin özelliklerini belirlemek; az çalışılmış elementlerin atom ağırlığının belirlenmesine; atom ağırlıklarının değerlerini düzeltmek için; kimyasal bileşiklerin formları hakkında bilgi doldurmak. Ek olarak, D.I. Mendeleev, periyodik yasanın uygulanabilirliği olasılığına işaret eder: sözde moleküler bileşiklerin doğru fikrine; inorganik bileşikler arasında polimerizm durumlarını belirlemek; karşılaştırmalı bir çalışmaya fiziksel özellikler basit ve karmaşık bedenler (R. Dobrotin. D. I. Mendeleev'in yaşam ve eserinin tarihi). Bu makalede bilim adamının, bu konuda geniş bir araştırma programını özetlediği söylenebilir. inorganik kimya periyodiklik teorisine dayanmaktadır. Gerçekten de, 19. yüzyılın sonunda - 20. yüzyılın başında, inorganik kimyanın birçok önemli alanı, aslında büyük Rus bilim adamı - DI Mendeleev'in ana hatlarıyla çizdiği yollar boyunca gelişti ve periyodik yasanın keşfi ve müteakip tanınması olarak kabul edilebilir. kimyanın gelişiminde bütün bir dönemin tamamlanması ve genelleştirilmesi.
Periyodik Kanunun Zaferi
Diğer tüm büyük keşifler gibi, ayrıca derin tarihsel kökleri olan periyodik yasa gibi büyük bir bilimsel genelleme, araştırmalarda tepkilere, eleştirilere, tanınmaya veya tanınmamaya, uygulamalara neden olmalıydı. Ancak garip görünse de, yasanın keşfinden sonraki ilk yıllarda, kimyagerlerin değerlendirmesini veren yanıtları ve konuşmaları aslında takip etmedi. Her halükarda, 1970'lerin başında, DIMendeleev'in makalelerine ciddi bir yanıt gelmedi. Kimyagerler, elbette, bu yasa hakkında hiçbir şey duymadıklarından veya anlamadıklarından değil, sessiz kalmayı tercih ettiler, ancak E. Rutherford'un daha sonra bu tutumu açıkladığı gibi, sadece zamanının kimyagerleri, gerçekleri toplamak ve çıkarmaktan daha meşguldü. ilişkilerini düşünmek. Bununla birlikte, D.I. Mendeleev'in konuşmaları, bireysel yabancı bilim adamlarının beklenmedik bir tepkisine neden olmalarına rağmen, tamamen fark edilmedi. Ancak yabancı dergilerde çıkan tüm yayınlar, D.I. Mendeleev'in keşfinin özüyle ilgili değildi, ancak bu keşfin önceliği sorusunu gündeme getirdi. Büyük Rus bilim adamının, elementlerin sistemleştirilmesi sorununun çözümüne yaklaşmaya çalışan birçok öncüsü vardı ve bu nedenle, DI Mendeleev, periyodik yasanın temel bir doğa yasası olduğunu gösterdiğinde, bazıları keşfinde öncelik iddiasında bulundu. bu yasa. Böylece, Londra'daki Alman Kimya Derneği muhabiri R. Gerstel, D.I. Mendeleev'in doğal elementler sistemi hakkındaki fikrinin ondan birkaç yıl önce W. Odling tarafından ifade edildiğini iddia ettiğini not etti. Bir süre önce, Alman kimyager H.W. Blomstrand'ın bir kitabı çıktı ve burada elementlerin hidrojen ve oksijen ile analojilerine göre bir sınıflandırmasını önerdi. Tüm elementler, yazar tarafından I.Ya'nın elektrokimyasal teorisi ruhunda elektriksel polarite temelinde iki büyük gruba ayrıldı. Berzelius. Önemli çarpıtmalarla birlikte, periyodik sistemin ilkeleri de G. Baumgauer'in broşüründe ortaya konmuştur. Ancak yayınların çoğu, tamamen D. M. Mendeleev'in iddia ettiği gibi 1864'te yayınlanmış olan doğal sistematiğinin ilkelerine dayanan L. Meyer'in elementler sistemine ayrılmıştı. L. Meyer, 19. yüzyılın 60'lı - 80'li yıllarında Almanya'da inorganik kimyanın önemli bir temsilcisiydi. Tüm çalışmaları esas olarak elementlerin fizikokimyasal özelliklerinin incelenmesine adanmıştır: atom kütleleri, ısı kapasitesi, atom hacimleri, değerlik, izomorfizm ve bunların belirlenmesi için çeşitli yöntemler. Araştırmasının ana amacını doğru deneysel veriler toplamada (atomik kütlelerin netleştirilmesi, fiziksel sabitlerin oluşturulması) gördü ve çeşitli fiziksel ve kimyasal özellikleri incelerken, DI Mendeleev'in aksine, birikmiş materyali genelleştirme konusunda geniş görevler belirlemedi. tüm elementler arasındaki ilişkiyi bulmaya, elementlerin özelliklerindeki değişimin doğasını bulmaya çalıştı. Bu konuşmalar, özünde, bilim dünyasının periyodik yasanın keşfine ilk tepkisi ve D.I. Mendeleev tarafından 1869 - 1871'de yayınlanan periyodik yasaya ilişkin ana makalelerle sınırlıdır. Temel olarak, keşfin yeniliği ve önceliği hakkında şüphe uyandırmayı ve aynı zamanda D.I. Mendeleev'in ana fikrini kendi element sistemleri yapıları için kullanmayı amaçladılar.
Ancak sadece dört yıl geçti ve tüm dünya periyodik yasadan D.I. Mendeleev'in parlak tahminlerini haklı çıkarmak için parlak bir keşif olarak konuşmaya başladı. En başından beri, keşfettiği yasanın özel bilimsel önemine tamamen güvenen Dmitry İvanoviç, birkaç yıl içinde keşfinin bilimsel zaferine tanık olacağını hayal bile edemezdi. Şubat 1874'te. Fransız kimyager P. Lecoq de Boisbaudran, Pireneler'deki Pierrefitte'deki bir metalurji tesisinden çinko blende kimyasal bir çalışma yaptı. Bu araştırma yavaş ilerledi ve 1875'teki keşifle sona erdi. yeni bir element - eski Romalıların Galya dediği Fransa'nın adını taşıyan galyum. Keşfin haberleri Paris Bilimler Akademisi Raporlarında ve bir dizi başka yayında yer aldı. Bilimsel literatürü yakından takip eden DIMendeleev, keşfin yazarının ilk raporunda galyumun yalnızca en genel terimlerle tanımlanmasına ve bazı özelliklerinin yanlış belirlenmesine rağmen, yeni elementte ekaalüminyumu hemen tanıdı. . Böylece, ekaalüminyumun özgül ağırlığının 5,9 ve açık elemanın özgül ağırlığının 4,7 olduğu varsayılmıştır. D.I. Mendeleev, L. De Boisbaudran'a sadece periyodik yasa üzerindeki çalışmalarına dikkat çekmekle kalmayıp aynı zamanda özgül ağırlığı belirlemede bir hataya işaret ettiği bir mektup gönderdi. Ne Rus bilim adamını ne de keşfettiği kimyasal elementlerin periyodik yasasını hiç duymamış olan Lecoq de Boisbaudran, bu konuşmayı memnuniyetsizlikle aldı, ancak daha sonra DI Mendeleev'in periyodik yasa hakkındaki makalesini öğrenince, sözlerini tekrarladı. deneyler ve gerçekten D.I. Mendeleev tarafından tahmin edilen özgül ağırlık değerinin L. de Boisbaudran tarafından deneysel olarak belirlenen değerle tam olarak örtüştüğü ortaya çıktı. Bu durum elbette hem Lecoq de Boisbaudran'ın kendisi hem de tüm bilim dünyası üzerinde en güçlü izlenimi bırakamadı. Böylece, D.I. Mendeleev'in tahmini mükemmel bir şekilde doğrulandı (uygulama sekmesi 5). O zamanın literatüründe ele alınan galyum bileşiklerinin keşfi ve incelenmesinin tüm tarihi, istemeden kimyagerlerin dikkatini çekti ve periyodik yasanın evrensel olarak tanınması için ilk itici güç oldu. DI Mendeleev'in ana çalışmasına olan talep, Annals of Liebig'de yayınlanan periyodik kimyasal elementler yasası o kadar büyüktü ki, onu İngilizce ve Fransızca'ya çevirmek gerekliydi ve birçok bilim adamı araştırmaya katkıda bulunmaya çalıştı. tarafından tahmin edilen ve açıklanan yeni, hala bilinmeyen elementler için. I. Mendeleyev. Bunlar V. Crooks, V. Ramsay, T. Carnelly, T. Thorp, G. Hartley - İngiltere'de; P. Lecoq de Boisbaudran, C. Marignac - Fransa'da; K. Winkler - Almanya'da; Y. Thomsen - Danimarka'da; I. Rydberg - İsveç'te; B. Brauner - Çek Cumhuriyeti'nde vb. D.I. Mendeleev onlara yasanın güçlendiricileri adını verdi. laboratuvarlarda çeşitli ülkeler kimyasal-analitik çalışmalara başladı.
Uppsala Üniversitesi'nde Analitik Kimya Profesörü L.F. Nilson, bu tür bilim adamlarının sayısı arasındaydı. Nadir toprak elementleri içeren mineral öksenit ile çalışarak, ana ürüne ek olarak bazı bilinmeyen toprak (oksit) elde etti. Mart 1879'da bu bilinmeyen toprakların dikkatli ve ayrıntılı bir çalışmasıyla. Nilson keşfetti yeni eleman, ana özellikleri 1871'de D.I. Mendeleev tarafından açıklanan özelliklerle çakıştı. ekabor. Bu yeni element, keşfedildiği ve D.I. Mendeleev tarafından tahmin edildiği gibi, kalsiyum ve titanyum arasındaki periyodik element tablosunun üçüncü grubundaki yerini bulduğu İskandinavya'nın onuruna skandiyum olarak adlandırıldı (uygulama sekmesi 6). Ekabor-skandiumun keşfinin tarihi, bir kez daha, sadece D.I. Mendeleev'in cesur tahminlerini değil, aynı zamanda onun tarafından keşfedilen periyodik yasanın bilimi için aşırı önemini de en açık şekilde doğruladı. Galyumun keşfinden sonra, periyodik yasanın kelimenin tam anlamıyla kimyanın yol gösterici yıldızı olduğu ve yeni, hala bilinmeyen kimyasal elementlerin araştırılmasının hangi yönde yapılması gerektiğini gösteren oldukça açık hale geldi.
Skandiyumun keşfinden birkaç yıl sonra, daha doğrusu 1886'da, periyodik yasa yeniden genel ilgi gördü. Almanya'da, Freiberg yakınlarında, Himmelsfürst Dağı bölgesinde, bir gümüş madeninde bilinmeyen yeni bir mineral bulundu. Bu minerali keşfeden Profesör A. Weisbach, ona argyrodite adını verdi. Yeni mineralin nitel analizi kimyager G.T.Richter tarafından, nicel analiz ise tanınmış kimyager-analist K.A.Winkler tarafından gerçekleştirildi. Araştırma sırasında Winkler beklenmedik ve garip bir sonuç aldı. Argyroditi oluşturan elementlerin toplam yüzdesinin olması gerektiği gibi %100 değil, sadece %93 olduğu ortaya çıktı. Açıkçası, mineralde önemli miktarda bulunan bazı elementler analizde gözden kaçırıldı. Büyük bir dikkatle gerçekleştirilen sekiz tekrarlı analiz aynı sonucu verdi. Winkler, henüz keşfedilmemiş bir elementle uğraştığını öne sürdü. Bu elemente germanyum adını verdi ve özelliklerini açıkladı. Germanyum ve bileşiklerinin özelliklerinin kapsamlı bir incelemesi, kısa süre sonra Winkler'i yeni elementin D.I. Germanyumun tahmin edilen ve ampirik olarak bulunan özelliklerinin alışılmadık derecede yakın bir tesadüfü bilim adamlarını şaşırttı ve Winkler'in kendisi, Alman Kimya Derneği'ndeki raporlarından birinde, DI Mendeleev'in tahminini gökbilimciler Adams ve Le Verrier'in tahminleriyle karşılaştırdı. Neptün gezegeninin varlığı, sadece hesaplamalara dayanarak yapılmıştır.
D.I. Mendeleev'in tahminlerinin parlak bir şekilde doğrulanması, kimyanın ve tüm doğa biliminin daha da geliştirilmesi üzerinde büyük bir etkiye sahipti. 80'lerin ortalarından beri. periyodik yasa elbette tüm bilim dünyası tarafından tanındı ve bilimsel araştırmanın temeli olarak bilimin cephaneliğine girdi. O zamandan beri, periyodik yasa temelinde, bilinen tüm elementlerin bileşiklerinin sistematik bir çalışması ve bilinmeyen, ancak yasa tarafından öngörülen bileşikler arayışı başladı. Periyodik yasanın keşfinden önce, çeşitli, özellikle yeni keşfedilen mineralleri inceleyen bilim adamları, özünde körü körüne çalıştılar, yeni, bilinmeyen elementleri nerede arayacaklarını ve özelliklerinin ne olması gerektiğini bilmiyorlarsa, o zaman, periyodik yasaya dayanarak , neredeyse hiç sürpriz olmadan yeni unsurları keşfetmek mümkün oldu. Periyodik yasa, atom ağırlıkları 1 ila 238 arasında değişen - hidrojenden uranyuma kadar henüz keşfedilmemiş elementlerin sayısını doğru ve açık bir şekilde belirlemeyi mümkün kıldı. Sadece on beş yıl içinde, Rus araştırmacının tüm tahminleri gerçekleşti ve o zamana kadar sistemdeki boş yerleri önceden hesaplanmış özelliklere sahip yeni unsurlar doldurmaya başladı. Bununla birlikte, D.I. Mendeleev'in hayatı boyunca bile, periyodik yasa iki kez ciddi şekilde test edildi. Yeni keşifler başlangıçta yalnızca periyodik yasa açısından açıklanamaz değil, hatta onunla çelişiyor gibi görünüyordu. Böylece, 90'larda, W. Ramsay ve J. W. Rayleigh, bütün bir soy gaz grubunu keşfettiler. D.I. Mendeleev için bu keşif başlı başına bir sürpriz değildi. Periyodik sistemin karşılık gelen hücrelerinde argon ve diğer elementlerin - analoglarının - varlığının olasılığını üstlendi. Ancak, yeni keşfedilen elementlerin özellikleri ve hepsinden önemlisi, inertlikleri (sıfır değerlik) periyodik sisteme yeni gazların yerleştirilmesinde ciddi zorluklara neden oldu. Bu elementler için periyodik sistemde yer olmadığı görülüyordu ve D.I. Mendeleev, periyodik sistemin sıfır grupla yenilenmesine hemen katılmadı. Ancak kısa süre sonra periyodik sistemin testten başarıyla çıktığı ve sıfır grubunun da dahil edilmesinden sonra daha uyumlu ve bitmiş bir form kazandığı ortaya çıktı. Radyoaktivite 19. ve 20. yüzyılların başında keşfedildi. Radyoaktif elementlerin özellikleri, elementler ve atomlar hakkındaki geleneksel fikirlerle o kadar örtüşmüyordu ki, periyodik yasanın geçerliliği hakkında şüpheler ortaya çıktı. Ek olarak, yeni keşfedilen radyoaktif elementlerin sayısı, göründüğü gibi, bu elementlerin periyodik sisteme yerleştirilmesinde aşılmaz zorluklar ortaya çıktı. Bununla birlikte, D.I. Mendeleev'in ölümünden hemen sonra olsa da, ortaya çıkan zorluklar tamamen ortadan kalktı ve periyodik yasa, bilimsel öneminin genişlemesine yol açan ek özellikler ve yeni bir anlam kazandı.
Yirminci yüzyılda, Mendeleev'in periyodiklik teorisi, maddenin yapısı ve özellikleri hakkındaki modern fikirlerin temellerinden biri olmaya devam ediyor. Bu doktrin iki merkezi kavram içerir - periyodiklik yasası ve periyodik elementler sistemi. Sistem, diğer birçok temel doğa yasasından farklı olarak, herhangi bir matematiksel denklem veya formül biçiminde ifade edilemeyen, periyodik yasanın bir tür grafik ifadesi olarak hizmet eder. Yirminci yüzyıl boyunca, periyodiklik doktrininin içeriği sürekli olarak genişledi ve derinleşti. Bu, doğada bulunan ve sentezlenen kimyasal elementlerin sayısındaki artıştır. Örneğin, öropyum, lutesyum, hafniyum, renyum yerkabuğunda bulunan kararlı elementlerdir; radon, fransiyum, protaktinyum - doğal radyoaktif elementler; teknesyum, prometyum, astatin - sentezlenmiş elementler. Bazı alt gruplarında (hafniyum, renyum, teknesyum, radon, astatin, vb.) düzenli boşluklar bulunduğundan, periyodik sisteme bazı yeni elementlerin yerleştirilmesi zorluklara neden olmadı. Lutetium, promethium, europium'un nadir toprak ailesinin üyeleri olduğu ortaya çıktı ve bunların yeri sorunu, nadir toprak elementlerinin dağılımı sorununun ayrılmaz bir parçası haline geldi. Transactinian unsurların yeri sorunu günümüzde bile tartışmalıdır. Bu nedenle, bazı durumlarda yeni elementler, periyodik sistemin yapısı hakkında ek fikirlerin geliştirilmesini gerektirdi. Elementlerin özelliklerinin ayrıntılı bir incelemesi, beklenmedik keşiflere ve yeni önemli kalıpların oluşturulmasına yol açtı. Periyodiklik olgusunun 19. yüzyılda göründüğünden çok daha karmaşık olduğu ortaya çıktı. Gerçek şu ki, D.I. Mendeleev tarafından kimyasal elementler için bulunan periyodiklik ilkesi, elementlerin atomlarına, maddenin organizasyonunun atomik seviyesine kadar genişletildi. Elementlerin özelliklerindeki periyodik değişiklikler, elektronik periyodikliğin varlığı, çekirdeklerinin yüklerinin değerleri arttıkça atomların benzer elektronik konfigürasyon türlerinin tekrarı ile açıklanır. Eğer elementel seviyede periyodik sistem ampirik gerçeklerin bir genellemesini temsil ediyorsa, o zaman atomik seviyede bu genelleme kabul edildi. teorik temel. Periyodiklik kavramının daha da derinleştirilmesi iki yönde ilerledi. Biri, kuantum mekaniğinin ortaya çıkması nedeniyle periyodik sistem teorisinin gelişmesiyle ilgilidir. Diğeri, izotopları sistematize etme ve nükleer modeller geliştirme girişimleriyle doğrudan ilgilidir. Bu yol boyunca nükleer (nükleon) periyodiklik kavramı ortaya çıktı. Nükleer periyodiklik, elektronik ile karşılaştırıldığında niteliksel olarak farklı bir karaktere sahiptir (eğer Coulomb kuvvetleri atomlarda etki ediyorsa, o zaman çekirdeklerde belirli nükleer kuvvetler ortaya çıkar). Burada, birçok spesifik özellik ile karakterize edilen nükleer (nükleon) periyodikliğin daha da derin bir tezahürü ile karşı karşıyayız.
Bu nedenle, periyodik yasanın tarihi, ilginç bir keşif örneği sunar ve bir keşfin ne olduğuna karar vermek için bir kriter sağlar. D.I. Mendeleev, öngörmeyi ve tahmin etmeyi mümkün kılan gerçek doğa yasasının rastgele gözlemlenen düzenliliklerden ve düzenliliklerden ayırt edilmesi gerektiğini defalarca tekrarladı. Bilim adamları tarafından tahmin edilen galyum, skandiyum ve germanyumun keşfi, sağlam bir teorik konumlar ve hesaplamalar temeline dayanan bilimsel öngörünün büyük önemini gösterdi. DIMendeleev bir peygamber değildi. Henüz keşfedilmemiş elementlerin özelliklerini tanımlamanın temeli, yetenekli bir bilim insanının sezgisi değil, geleceği öngörmek için özel bir yetenek değildi. Sadece keşfettiği periyodik yasanın geçerliliğine ve muazzam bilimsel önemine olan sarsılmaz bir güven, bilimsel öngörünün öneminin anlaşılması, ona cesur ve görünüşte inanılmaz tahminlerle bilim dünyasına konuşma fırsatı verdi. D.I. Mendeleev, keşfettiği evrensel doğa yasasının, insanlığın maddenin yapısının sırlarına nüfuz etme girişimleri için temel ve kılavuz olmasını tutkuyla diledi. Doğa yasalarının istisnalara müsamaha göstermediğini söyledi ve bu nedenle, açık bir yasanın doğrudan ve açık bir sonucunun ne olduğunu tam bir güvenle ifade etti. 19. yüzyılın sonunda ve 20. yüzyılda, periyodik yasa ciddi şekilde test edildi. Tekrar tekrar, yeni kurulan gerçeklerin periyodik yasayla çeliştiği görülüyordu. Soy gazların keşfi ve radyoaktivite, izotopi vb. fenomenleri de böyleydi. Nadir toprak elementlerinin sisteme yerleştirilmesi ile zorluklar ortaya çıktı. Ancak her şeye rağmen, periyodik yasa, onun gerçekten de doğanın temel büyük yasalarından biri olduğunu kanıtlamıştır. Kimyanın diğer tüm gelişimi, periyodik yasa temelinde gerçekleşti. Bu yasaya dayanarak, atomların iç yapısı kurulmuş ve davranış yasaları açıklığa kavuşturulmuştur. Periyodik yasa, sonsuz çeşitlilikteki maddelerin ve dönüşümlerinin en karmaşık labirentinde yönlendirilirken, kimya çalışmasında haklı olarak kılavuz yıldız olarak adlandırılır. Bu aynı zamanda Rus ve Amerikalı bilim adamları tarafından Dubna şehrinde (Moskova bölgesi) periyodik sistemin yeni bir 118 elementinin keşfiyle de doğrulanmaktadır. Ortak Nükleer Araştırma Enstitüsü Direktörü, Rusya Bilimler Akademisi Sorumlu Üyesi A. Sissakyan'a göre, bilim adamları bu elementi laboratuvardaki fiziksel hızlandırıcıların yardımıyla gördüler. 118. element, Dünya'da var olan periyodik sistemin tüm elementlerinin açık ara en ağırıdır. Bu keşif, periyodik yasanın - D. I. Mendeleev tarafından keşfedilen büyük doğa yasasının sarsılmaz kaldığı gerçeğini bir kez daha doğruladı.
Periyodik yasanın zaferi, DIMendeleev'in kendisi için de bir zaferdi. 1980'lerde, daha önce Batı Avrupalı bilim adamları arasında olağanüstü araştırmalarıyla tanınan kişi, dünya çapında yüksek prestij kazandı. Bilimin en önde gelen temsilcileri, bilimsel başarısına hayran kalarak ona her türlü saygı belirtisini gösterdi. D.I. Mendeleev, birçok yabancı bilim akademisi ve bilim derneğine üye seçildi, birçok onursal unvan, ayrım ve ödül aldı.
1869'da, büyük Rus kimyager D. I. Mendeleev, yalnızca kimyanın kendisinin değil, aynı zamanda diğer birçok bilimin daha da gelişmesini belirleyen bir keşif yaptı.
Periyodik yasanın keşfinin tüm tarihöncesi, sıradan tarihsel ve bilimsel fenomenlerin çerçevesinin ötesine geçen bir fenomen değildir. Bilim tarihinde, öncesinde uzun ve az çok karmaşık bir tarihöncesi olmayan büyük genellemelerin ortaya çıkışının bir örneğine işaret etmek pek mümkün değildir. D. I. Mendeleev'in kendisinin de belirttiği gibi, hemen temellendirilecek tek bir genel doğa yasası yoktur. Onun onaylanması her zaman birçok önseziden önce gelir ve yasanın tanınması, onun hakkında ilk düşüncenin ortaya çıktığı andan itibaren ve hatta tüm önemi ile tam olarak gerçekleştirildiği zaman değil, ancak sonuçlarının onaylanmasından sonra gelir. düşüncelerin ve görüşlerin en yüksek örneği olarak kabul edilmesi gereken deneyler. . Aslında, ilk başta yalnızca belirli, hatta bazen rastgele gözlem ve karşılaştırmaların görünümü belirtilebilir. Karşılaştırılan gerçek verilerin eşzamanlı genişlemesi ile bu tür karşılaştırmaların varyantları, bazen, ancak, doğa yasasının ana özelliklerinden yoksun olan belirli genellemelere yol açar. Newlands, Odling, Meyer, Chancourtua haritası ve diğerlerinin tabloları da dahil olmak üzere, tüm Dom-Deleian'ın öğeleri sistematize etmeye çalıştığı şey tam olarak budur. Seleflerinden farklı olarak, D. I. Mendeleev belirli kalıplar aramadı, ancak temel nitelikteki genel bir sorunu çözmeye çalıştı. Aynı zamanda, yine öncekilerden farklı olarak, doğrulanmış nicel verilerle çalıştı ve elementlerin deneysel olarak şüpheli özelliklerini kişisel olarak doğruladı. Daha önceki tüm bilimsel aktivitelerin onu periyodik yasanın keşfine götürdüğü, bu keşfin DI Mendeleev'in çeşitli maddelerin fiziksel ve kimyasal özelliklerini inceleme ve karşılaştırma fikrini tam olarak formüle etme girişimlerinin tamamlanması olduğu kesinlikle iddia edilebilir. çeşitli maddeler arasında yakın bir iç bağlantı ve Her şeyden önce - kimyasal elementler arasında. Bilim adamının izomorfizm, sıvılarda iç kohezyon, çözeltiler vb. üzerine yaptığı erken araştırmaları hesaba katmadan, periyodik yasanın ani keşfini açıklamak imkansız olurdu. Muazzam kargaşa içinde, kimyagerlerin önüne serilmiş dağınık gerçeklerin ve bilgilerin karmaşasında büyük birliği yakalamayı başaran D.I. Mendeleev'in dehasına hayran kalmamak elde değil. Maddenin yapısı hakkında neredeyse hiçbir şeyin bilinmediği bir zamanda kimyasal elementlerin doğal yasasını oluşturmayı başardı.
Böylece, 19. yüzyılın sonunda, periyodik yasanın keşfinin bir sonucu olarak, inorganik kimyanın gelişiminin aşağıdaki resmi gelişti. 1990'ların sonunda, yasa evrensel olarak kabul edildi, bilim adamlarının yeni keşifleri öngörmelerine ve birikmiş deneysel materyali sistematize etmelerine izin verdi, atom ve moleküler teoriyi doğrulamada ve daha da geliştirmede olağanüstü bir rol oynadı. Periyodik Kanun, yeni kimyasal elementlerin keşfini teşvik etti. Galyumun keşfinden bu yana, sistemin öngörü yetenekleri belirgin hale geldi. Ancak aynı zamanda, periyodikliğin fiziksel nedenlerinin cehaletinden ve sistemin yapısındaki belirli bir kusurdan dolayı hala sınırlıydılar. İngiliz bilim adamı W. Ramsay, Dünya'da helyum ve argonun keşfiyle birlikte, henüz bilinmeyen diğer soy gazları tahmin etmeye cesaret etti - kısa süre sonra neon, kripton ve ksenonu buldu. 1906'da Kimyanın Temelleri ders kitabının sekizinci baskısında yayınlanan periyodik sistemde, D. I. Mendeleev 71 element içeriyordu. Bu tablo, 37 yıl boyunca elementlerin geniş keşif, çalışma ve sistematiğini özetledi. Galyum, skandiyum, germanyum, radyum, toryum burada yerlerini bulmuşlar; beş asal gaz sıfır grubunu oluşturdu. Periyodik yasanın ışığında, genel ve inorganik kimyanın birçok kavramı daha kesin bir biçim (kimyasal element, basit cisim, değerlik) kazanmıştır. Periyodik sistem, varlığı gerçeğiyle, radyoaktivite çalışmasında elde edilen sonuçların doğru yorumlanmasına büyük ölçüde katkıda bulundu, tespit edilen elementlerin kimyasal özelliklerinin belirlenmesine yardımcı oldu. Bu nedenle, sistem olmadan, daha sonra en ağır asil gaz olan radon'un izotopları olduğu ortaya çıkan yayılımların eylemsiz doğası anlaşılamadı. Ancak klasik fizikokimyasal araştırma yöntemleri, periyodik yasadan çeşitli sapmaların nedenlerinin analizi ile ilgili sorunları çözemedi, ancak büyük ölçüde, elementin sistemdeki yerinin fiziksel anlamını ortaya çıkarmak için temel hazırladı. Elementlerin çeşitli fiziksel, mekanik, kristalografik ve kimyasal özelliklerinin incelenmesi, genel olarak atomların daha derin ve gizli iç özelliklerine bağımlılıklarını gösterdi. D. I. Mendeleev'in kendisi, basit ve karmaşık cisimlerin periyodik değişkenliğinin, doğası ve daha da önemlisi nedeni henüz kapsamanın yolu olmayan daha yüksek bir yasaya tabi olduğunun açıkça farkındaydı. Bilim henüz bu sorunu çözebilmiş değil.
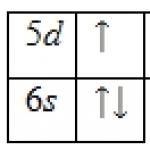
20. yüzyılın başında, periyodik sistem, radyo elementlerinin muazzam keşfi gibi ciddi bir engelle karşı karşıya kaldı. Periyodik tabloda onlar için yeterli yer yoktu. Bu zorluk, bilim adamının ölümünden altı yıl sonra, izotopi kavramlarının formülasyonu ve atom çekirdeğinin yükü, sayısal olarak periyodik sistemdeki elementin sıra sayısına eşit olması sayesinde aşıldı. Periyodiklik doktrini, gelişiminin yeni, fiziksel bir aşamasına girmiştir. En önemli başarı, elementlerin özelliklerindeki periyodik değişimin fiziksel nedenlerinin ve bunun sonucunda periyodik sistemin yapısının açıklanmasıydı. Atomların yapısı teorisinin geliştirilmesinde en önemli bilgi kaynağı olarak N. Bohr'a hizmet eden periyodik elementler sistemiydi. Ve böyle bir teorinin yaratılması, Mendeleev'in periyodiklik teorisinin yeni bir seviyeye - atomik veya elektronik - geçişi anlamına geliyordu. 19. yüzyılın kimyası için anlaşılmaz kalan çok çeşitli özelliklere sahip kimyasal elementlerin ve bunların bileşiklerinin tezahürünün fiziksel nedenleri netleşti. 1920'lerde ve 1930'larda, kimyasal elementlerin neredeyse tüm kararlı izotopları keşfedildi; şu anda sayıları yaklaşık 280'dir. Ayrıca doğada 40'ın üzerinde radyoaktif element izotopu bulunmuş ve yaklaşık 1600 yapay izotop sentezlenmiştir. Periyodik sistemdeki elementlerin dağılım kalıpları, izomorfizm olgusunu açıklamayı mümkün kıldı - minerallerin kristal kafeslerindeki atomların ve atom gruplarının diğer atomlar ve atomik gruplarla değiştirilmesi.
Jeokimyanın gelişiminde periyodiklik doktrini büyük önem taşımaktadır. Bu bilim, 19. yüzyılın son çeyreğinde, yerkabuğundaki elementlerin bolluğu sorununu ve çeşitli cevher ve minerallerdeki dağılım modellerini yoğun bir şekilde incelemeye başladıklarında ortaya çıktı. Periyodik sistem, birçok jeokimyasal düzenliliğin tanımlanmasına katkıda bulunmuştur. Jeokimyasal olarak benzer elementleri kapsayan belirli alan blokları belirlendi ve sistemin köşegenleri boyunca yer alan elementlerin benzerlikleri ve farklılıkları fikri geliştirildi. Buna karşılık, bu, yer kabuğunun jeolojik gelişimi ve bunların doğadaki ortak varlığı sırasında element seçimi yasalarını incelemeyi mümkün kıldı.
Yirminci yüzyıl, kimyada katalizin en yaygın kullanıldığı yüzyıl olarak adlandırılır. Ve burada periyodik sistem, katalitik özelliklere sahip maddelerin sistemleştirilmesinin temeli olarak hizmet eder. Bu nedenle, heterojen oksidasyon-redüksiyon reaksiyonları için tablonun yan alt gruplarının tüm elemanlarının katalitik bir etkiye sahip olduğu bulundu. Endüstriyel koşullar altında örneğin kraking, izomerizasyon, polimerizasyon, alkilasyon vb. içeren asit-baz kataliz reaksiyonları için alkali ve alkali toprak metalleri katalizörlerdir: Li, Na, K, Rb, Cs, Ca; asidik reaksiyonlarda - ikinci ve üçüncü periyotların (Ne ve Ar hariç) tüm p elementlerinin yanı sıra Br ve J.
Kozmokimyanın sorunları da periyodiklik hakkındaki nükleer fikir düzeyi temelinde çözülür. Göktaşlarının bileşiminin incelenmesi ve ay toprağı, Venüs ve Mars'taki otomatik istasyonlardan elde edilen veriler, bu nesnelerin Dünya'da bilinen aynı kimyasal elementleri içerdiğini gösteriyor. Bu nedenle, periyodiklik yasası Evrenin diğer bölgelerine de uygulanabilir.
Periyodik elementler sisteminin bilgi için gerekli bir araç olarak hareket ettiği daha birçok bilimsel araştırma alanı adlandırılabilir. Akademisyen S. I. Volfkovich'in, periyodik yasanın keşfinin yüzüncü yılına adanan Jubilee Mendeleev Kongresi'ndeki raporunda, periyodik yasanın kimya tarihindeki ana kilometre taşı olduğunu söylemesine şaşmamalı. Kimyagerlerin, fizikçilerin, jeologların, astronomların, filozofların, tarihçilerin sayısız çalışmasının kaynağıydı ve biyoloji, astronomi, teknoloji ve diğer bilimleri birçok yönden etkilemeye devam ediyor. Ve çalışmamı, Mendeleev'in düşünce ve içgörü cesaretinin her zaman hayranlık uyandıracağını yazan Alman fizikçi ve kimyager W. Meyer'in sözleriyle bitirmek istiyorum (Yu. Solovyov. Kimya Tarihi).
İster uzay nesneleri, ister sıradan karasal nesneler ya da canlı organizmalar olsun, doğada bizi çevreleyen her şey maddesel maddelerden oluşur. Bunların birçok çeşidi vardır. Eski zamanlarda bile insanlar, yalnızca fiziksel durumlarını değiştirmekle kalmayıp, aynı zamanda orijinallerine kıyasla başka özelliklere sahip başka maddelere dönüşebildiklerini fark ettiler. Ancak burada, maddenin bu tür dönüşümlerinin gerçekleştiği yasalar, bir kişi hemen anlamadı. Bunu yapabilmek için maddenin temelini doğru tespit etmek ve doğada var olan elementleri sınıflandırmak gerekiyordu. Bu ancak 19. yüzyılın ortalarında periyodik yasanın keşfiyle mümkün oldu. Yaratılış tarihi D.I. Mendeleev, uzun yıllar süren çalışmalardan önce geldi ve tüm insanlığın asırlık deneyimi bu tür bilgilerin oluşumuna katkıda bulundu.
Kimyanın temelleri ne zaman atıldı?
Eski zamanların ustaları, dönüşümlerinin birçok sırrını bilerek, çeşitli metalleri döküm ve eritmede oldukça başarılıydı. Bilgi ve deneyimlerini, Orta Çağ'a kadar kullanan torunlarına aktardılar. 16. yüzyıla kadar kimyagerlerin asıl görevi olan adi metalleri değerli metallere dönüştürmenin oldukça mümkün olduğuna inanılıyordu. Özünde, böyle bir fikirde, eski Yunan bilim adamlarının felsefi ve mistik fikirleri, tüm maddelerin, birbirini yeniden canlandırabilen belirli “birincil unsurlardan” oluştuğunu ortaya koydu. Bu yaklaşımın bariz ilkelliğine rağmen, Periyodik Kanunun keşfedildiği tarihte rol oynamıştır.

Her derde deva ve beyaz tentür
Temel prensibi araştıran simyacılar, iki fantastik maddenin varlığına sıkı sıkıya inanıyorlardı. Bunlardan biri, efsanelerde ünlü olan ve yaşam iksiri veya her derde deva olarak da adlandırılan filozof taşıydı. Böyle bir ilacın sadece cıva, kurşun, gümüş ve diğer maddeleri altına dönüştürmenin sorunsuz bir yolu olmadığına, aynı zamanda her türlü insan rahatsızlığını iyileştiren mucizevi evrensel bir ilaç olduğuna inanılıyordu. Beyaz tentür adı verilen başka bir element o kadar etkili değildi, ancak diğer maddeleri gümüşe dönüştürme yeteneğine sahipti.
Periyodik yasanın keşfinin tarihöncesini anlatırken, simyacıların biriktirdiği bilgilerden bahsetmemek mümkün değil. Sembolik düşünme modelini kişileştirdiler. Bu yarı-mistik bilimin temsilcileri, dünyanın belirli bir kimyasal modelini ve içinde yer alan süreçleri kozmik düzeyde yarattı. Her şeyin özünü anlamaya çalışırken, onlar en detaylı şekilde Deneyimlerini meslektaşlarına ve torunlarına aktarırken büyük bir titizlik ve özenle, kimyasal cam eşyalarla ilgili laboratuvar tekniklerini, ekipmanlarını ve bilgilerini kaydetmiştir.

sınıflandırma ihtiyacı
19. yüzyıla gelindiğinde, çok çeşitli kimyasal elementler hakkında önemli miktarda bilgi birikmişti, bu da bilim adamlarının bunları sistematik hale getirmeleri için doğal bir ihtiyaç ve istek uyandırdı. Ancak böyle bir sınıflandırma yapmak için, mistik değil, henüz var olmayan maddelerin yapısı ve maddenin yapısının temelinin özü hakkında gerçek bilgi kadar ek deneysel veriler gerekliydi. Ek olarak, o zaman bilinen kimyasal elementlerin atom kütlelerinin önemi hakkında, sistematikleştirmenin gerçekleştirildiği temelinde mevcut bilgiler, özellikle doğruluk açısından farklılık göstermedi.
Ancak doğa bilimciler arasında sınıflandırma girişimleri, şimdi modern bilimin temelini oluşturan şeylerin gerçek özünün kavranmasından çok önce defalarca yapıldı. Birçok bilim adamı bu yönde çalıştı. Mendeleev'in periyodik yasasını keşfetmenin ön koşullarından kısaca bahsederek, bu tür element kombinasyonlarının örneklerinden bahsetmeliyiz.
üçlüler
O zamanların bilim adamları, çok çeşitli maddelerin sergilediği özelliklerin, şüphesiz atom kütlelerinin büyüklüklerine bağlı olduğunu hissettiler. Bunu fark eden Alman kimyager Johann Döbereiner, maddenin temelini oluşturan elementler için kendi sınıflandırma sistemini önerdi. 1829'da oldu. Ve bu olay, gelişiminin o dönemi için bilimde oldukça ciddi bir ilerleme ve periyodik yasanın keşfi tarihinde önemli bir aşamaydı. Döbereiner, bilinen unsurları topluluklar halinde birleştirdi ve onlara "üçlüler" adını verdi. İle mevcut sistem bu durumda, uç elementlerin kütlesi, aralarında bulunan grup üyesinin atom kütlelerinin toplamının ortalamasına eşit olduğu ortaya çıktı.

Triadların sınırlarını genişletme girişimleri
Bahsedilen Döbereiner sisteminde yeterince eksiklik vardı. Örneğin, baryum, stronsiyum, kalsiyum zincirinde, yapı ve özelliklerde bunlara benzer magnezyum yoktu. Ve tellür, selenyum, kükürt topluluğunda yeterli oksijen yoktu. Diğer birçok benzer madde de üçlü sisteme göre sınıflandırılamadı.
Bu fikirler diğer birçok kimyager tarafından geliştirilmiştir. Özellikle, Alman bilim adamı Leopold Gmelin, sınıflandırılmış element gruplarını genişleterek, bunları elementlerin eşdeğer ağırlıkları ve elektronegatiflik sırasına göre dağıtarak "yakın" sınırları genişletmeye çalıştı. Yapıları sadece üçlüleri değil, aynı zamanda dörtlüleri, beşlileri de oluşturdu, ancak Alman kimyager periyodik yasanın özünü kavrayamadı.
Spiral de Chancourtois
Hatta daha fazla karmaşık şema Elemanların inşası Alexandre de Chancourtois tarafından icat edildi. Onları bir silindire katlanmış bir düzleme yerleştirdi ve artan atom kütleleri sırasına göre 45 ° eğimle dikeyler boyunca dağıttı. Beklendiği gibi, belirli bir hacmin eksenine paralel çizgiler boyunca geometrik şekil, benzer özelliklere sahip maddelerin bulunması gerekirdi.

Ama aslında, hiçbir şekilde ilişkili olmayan öğeler bazen aynı dikeye düştüğü için ideal bir sınıflandırma işe yaramadı. Örneğin, alkali metallerin yanında manganezin tamamen farklı bir kimyasal davranışa sahip olduğu ortaya çıktı. Ve bir "şirket" kükürt, oksijen ve onlardan tamamen farklı olan titanyum elementini aldı. Ancak böyle bir şema da katkıda bulunarak periyodik yasanın keşif tarihinde yerini aldı.
Sınıflandırma oluşturmaya yönelik diğer girişimler
Açıklananların ardından John Newlands, elde edilen serinin her sekizinci üyesinin atom kütlesindeki artışa göre düzenlenmiş elementlerin özelliklerinde benzerlikler gösterdiğine dikkat çekerek kendi sınıflandırma sistemini önerdi. Bilim adamının aklına, bulunan deseni müzik oktavlarının düzeninin yapısıyla karşılaştırmak geldi. Aynı zamanda, öğelerin her birine yatay sıralara yerleştirerek bir seri numarası atadı. Ancak böyle bir plan yine ideal olmadı ve bilim çevrelerinde çok şüpheci bir şekilde değerlendirildi.

1964'ten 1970'e kimyasal elementleri sıralayan tablolar da Odling ve Meyer tarafından oluşturulmuştur. Ancak bu tür girişimlerin yine dezavantajları vardı. Bütün bunlar, Mendeleev'in periyodik yasayı keşfetmesinin arifesinde oldu. Ve eksik sınıflandırma girişimleri olan bazı eserler, bugün hala kullandığımız tablo dünyaya sunulduktan sonra bile yayınlandı.
Mendeleev'in Biyografisi
Parlak bir Rus bilim adamı, 1834 yılında spor salonu müdürünün ailesinde Tobolsk şehrinde doğdu. Evde onun dışında on altı erkek ve kız kardeş daha vardı. Çocukların en küçüğü olan Dmitry Ivanovich, çok küçük yaşlardan itibaren olağanüstü yetenekleriyle herkesi şaşırttı. Ebeveynler, zorluklara rağmen, ona en iyi eğitimi vermeye çalıştı. Böylece, Mendeleev önce Tobolsk'taki spor salonundan, ardından başkentteki Pedagoji Enstitüsünden mezun olurken, ruhundaki bilimlere derin bir ilgi duydu. Ve sadece kimyaya değil, aynı zamanda fizik, meteoroloji, jeoloji, teknoloji, enstrümantasyon, havacılık ve diğerlerine de.
Yakında Mendeleev tezini savundu ve organik kimya üzerine ders verdiği St. Petersburg Üniversitesi'nde yardımcı doçent oldu. 1865 yılında "Alkolün su ile kombinasyonu üzerine" konulu doktora tezini meslektaşlarına sundu. Periyodik yasanın keşfedildiği yıl 1969'du. Ancak bu başarıdan önce 14 yıllık sıkı çalışma geldi.

Büyük keşif hakkında
Hataları, yanlışlıklar ve meslektaşlarının olumlu deneyimlerini dikkate alan Dmitry Ivanovich, kimyasal elementleri en uygun şekilde sistemleştirmeyi başardı. Ayrıca, bileşiklerin ve basit maddelerin özelliklerinin periyodik bağımlılığını, formlarının Mendeleev tarafından verilen periyodik yasanın formülasyonunda söylenen atomik kütlelerin değerine bağlı olduğunu fark etti.
Ancak bu tür ilerici fikirler, ne yazık ki, bu yeniliği çok dikkatli bir şekilde kabul eden Rus bilim adamlarının bile kalbinde hemen bir yanıt bulamadı. Ve yabancı bilimin figürleri arasında, özellikle İngiltere ve Almanya'da, Mendeleev yasası en ateşli muhalifleri buldu. Ama çok geçmeden durum değişti. Sebep neydi? Büyük Rus bilim adamının parlak cesareti bir süre sonra dünyaya onun parlak bilimsel öngörü yeteneğinin kanıtı olarak göründü.

Kimyada yeni elementler
Periyodik yasanın keşfi ve onun tarafından oluşturulan periyodik tablonun yapısı, sadece maddeleri sistematize etmeyi değil, aynı zamanda o sırada bilinmeyen birçok elementin doğada varlığı hakkında bir takım tahminlerde bulunmayı mümkün kıldı. Bu nedenle Mendeleyev, diğer bilim adamlarının kendisinden önce yapamadıklarını uygulamaya koymayı başardı.
Aradan sadece beş yıl geçti ve tahminler doğrulanmaya başladı. Fransız Lecoq de Boisbaudran, galyum adını verdiği yeni bir metal keşfetti. Özelliklerinin, Mendeleev tarafından teoride tahmin edilen ekaalüminyuma çok benzer olduğu ortaya çıktı. Bunu öğrenince o dönemin bilim dünyasının temsilcileri şaşkına döndü. Ancak şaşırtıcı gerçekler burada bitmedi. Ayrıca, İsveçli Nilsson, varsayımsal analogu ekabor olan skandiyumu keşfetti. Ve Winkler tarafından keşfedilen germanyum, ekasilicium'un ikizi oldu. O zamandan beri Mendeleev'in yasası kendini göstermeye ve giderek daha fazla yeni destekçi kazanmaya başladı.
Parlak öngörünün yeni gerçekleri
Yaratıcı, fikrinin güzelliğine o kadar kapılmıştı ki, geçerliliği daha sonra pratik deneylerle en parlak şekilde doğrulanan bazı varsayımlarda bulunma özgürlüğünü aldı. bilimsel keşifler. Örneğin Mendeleyev, tablosundaki bazı maddeleri atom kütlelerindeki artışa göre hiç düzenlemedi. Periyodikliğin daha derin bir anlamda, yalnızca elementlerin atom ağırlığındaki bir artışla bağlantılı olarak değil, aynı zamanda başka bir nedenle de gözlemlendiğini öngördü. Büyük bilim adamı, bir elementin kütlesinin, yapısındaki daha temel parçacıkların miktarına bağlı olduğunu tahmin etti.
Böylece periyodik yasa bir şekilde bilimin temsilcilerini atomun bileşenleri hakkında düşünmeye sevk etti. Ve 20. yüzyılın bilim adamları, görkemli keşifler yüzyılı, elementlerin özelliklerinin atom çekirdeği yüklerinin büyüklüğüne ve elektron kabuğunun yapısına bağlı olduğuna defalarca ikna oldular.

Periyodik hukuk ve modernite
Temelinde değişmeden kalan periyodik tablo, daha sonra birçok kez eklendi ve değiştirildi. İnert gazları içeren sözde sıfır element grubunu oluşturdu. Nadir toprak elementlerinin yerleştirilmesi sorunu da başarıyla çözüldü. Ancak eklemelere rağmen, Mendeleev'in periyodik yasasının orijinal versiyonda keşfinin önemini abartmak oldukça zordur.
Daha sonra, radyoaktivite fenomeni ile, böyle bir sistematikleştirmenin başarısının nedenleri ve çeşitli maddelerin elementlerinin özelliklerinin periyodikliği tam olarak anlaşıldı. Çok geçmeden radyoaktif elementlerin izotopları da bu tablodaki yerini aldı. Atom numarası, hücrelerin çok sayıda üyesinin sınıflandırılmasının temeli oldu. Ve 20. yüzyılın ortalarında, atomların yörüngelerinin çekirdeğin etrafında büyük bir hızla hareket eden elektronlarla doldurulmasına bağlı olarak, tablodaki elementlerin sırası nihayet doğrulandı.
Metaller ve silikatlar, oksitler ve karbonhidratlar, su ve proteinler Bileşim, özellik ve yapı bakımından ne kadar farklılık gösterirler. Çevremizdeki dünyayı oluşturan maddelerin çeşitliliği gerçekten şaşırtıcıdır. Ve doğada bulunmayan, ancak bilim adamları tarafından laboratuvarlarda elde edilen kimyasal bileşikleri hesaba katarsak, zaten bilinen maddeler listelerinde milyonlarca ismin yer alması gerekecektir. Ve bu listeler sürekli genişlemektedir.
Bilim adamlarının elinde güvenilir bir "pusula" olmasaydı, bu uçsuz bucaksız denizde gezinmek imkansız olurdu. Tüm maddeler sadece birkaç düzine kimyasal elementten oluşur ve elementlerin kendileri de sorgusuz sualsiz tek bir yasaya uyarlar. Bu önemli yasa, Periyodik Yasa, 1869'da keşfedildi. büyük Rus kimyager D. I. Mendeleev tarafından kimya biliminin dayandığı temelin temel taşlarından biri olarak hizmet vermektedir.
"D. I. Mendeleev ve Periyodik Kanun" konusu ilgimi çekti çünkü büyük bilim adamının Periyodik Kanun'u keşfinin kişiliğini ayrıntılı olarak bilmek ve anlamak istedim.
Açılış önkoşulları
D. I. Mendeleev'in periyodik yasası.
Uygarlığın şafağında bile, insanlar doğada bakır, demir, gümüş, altın vb. gibi bazı kimyasal elementler buldular. Bu metaller, özellikle bakır ve demir, insan yaşamında o kadar büyük öneme sahipti ki, tüm tarihsel dönemler adlandırıldı. onlardan sonra (Bronz ve Demir Çağları).
Atom öğretilerinin gelişimine önemli bir katkı, eski Yunan filozofları tarafından yapıldı: Demokritus (MÖ 460-370), Epicurus (MÖ 341-270), Aristoteles (MÖ 384-322). atom teorisi antik Yunan filozofları doğanın ilk ilkeleri hakkında, yaşamın en önemli ilkeleri hakkında kesinlikle mantıklı bir akıl yürütmenin sonucuydu. Çevredeki şeylerin çeşitliliğinde tek, değişmez, yok edilemez bulmak gerekiyordu. Böylece, herhangi bir şeyi oluşturan en küçük, bölünmez, yok edilemez cisimler (atomlar) hakkında fikir ortaya çıktı.
Ardından gelen din ve müstehcenliğin neredeyse bin yıllık egemenliği, atomistiğin unutulmasına ve ancak 17. yüzyılda yeniden canlandırılmasına neden oldu. niteliksel olarak yeni bir düzeyde.
İngiliz fizikçi ve kimyager Robert Boyle (1627-1691), kimyanın bir bilim olarak gelişmesine büyük katkı sağlamıştır. Ana liyakat Boyle, kimyasal elementleri bazı soyut kavramlar olarak değil, gerçek parçacıklar olarak görmeye başlamasıdır. Gerçekte birkaç kimyasal element olabileceğine inanıyordu - ve bu nedenle doğada aramalarını amaçladı. R. Boyle, atomlardan oluşan tamamen bireysel bir malzeme gövdesi olarak temelde yeni bir kimyasal element kavramı verdi. Boyle'un anahtar "bileşim - özellikler", istenen özelliklere sahip maddelerin kimyasal üretiminin yolunu açtı.
İsveçli kimyager Jacob Berzelius (1779-1848), 1818'de 45 kimyasal elementin atom kütlelerini belirledi. Bunları bir tablo şeklinde yayınladı. Aynı yıl, 2000 kimyasal bileşiğin yüzde bileşimini karşılaştırdı ve "atom ağırlıklarını" gösterdi ("molekül" kavramını kullanmadı, ancak molekülleri değişen derecelerde karmaşıklığa sahip atomlar olarak kabul etti). Kimyasal elementleri belirtmek için Berzelius, elementlerinin ilk harflerini kullanmayı önerdi. Latince isimler. Onun görüşüne göre, kimyasal bileşikleri belirtmek için harfler ve sayılar, kolayca yazılabilmeleri ve basılabilmeleri için kullanılmalıdır. Bileşiklerdeki elementlerin oranını görsel olarak yansıtmalı, nispi miktarları belirtmelidirler. oluşturan parçalar, bir madde oluşturmak ve son olarak analizin sayısal sonucunu ifade etmek cebirsel formüller kadar basit ve anlaşılırdır. Berzelius yeni kimyasal elementler keşfetti: seryum, selenyum ve toryum. Serbest halde silikon, titanyum, tantal, zirkonyum ve vanadyumu elde eden ilk kişiydi.
Alman kimyager Johann Debereiner (1780-1849), kimyasal olarak benzer bazı elementlerin atom ağırlıklarını karşılaştırırken, doğada yaygın olarak dağılmış birçok element için bu sayıların oldukça yakın olduğunu ve Fe, Co, Ni gibi elementler için bu sayıların oldukça yakın olduğunu buldu. Cr, Mn , pratik olarak aynıdırlar. Ek olarak, SrO'nun göreli "atom ağırlığının", CaO ve BaO'nun "atomik ağırlıklarının" yaklaşık aritmetik ortalaması olduğunu kaydetti. Bu temelde, Debereiner, benzer kimyasal özelliklere sahip elementlerin, örneğin Cl, Br, J veya Sr, Ca, Ba gibi üç elementten (üçlüler) oluşan gruplara ayrılabileceğini belirten "üçlüler kanunu"nu önerdi. Bu durumda, üçlünün orta elementinin atom ağırlığı, uç elementlerin atom ağırlıklarının toplamının yarısına yakındır.
Diğer kimyagerler, benzer element gruplarındaki atom kütlelerinin değerlerini değiştirmedeki düzenliliklerle ilgilendiler. Bu karşılaştırmalardan ilki, A. de Chancourtua'nın sözde "sarmal"ıydı. Mesajlarında, elementlerin özelliklerini bir eğri şeklinde eşleştirmeye çalıştı. o üzdü yan yüzey tabanına 45°'lik bir açıyla silindir hattı. Silindirin yüzeyi dikey çizgilerle 16 parçaya bölünmüştür (oksijen atom kütlesi 16'dır). Elementlerin atomik kütleleri ve basit cisimlerin moleküler kütleleri, uygun bir ölçekte bir sarmal üzerinde noktalar olarak gösterildi. Silindirin generatrisini genişletirseniz, düzlemde birbirine paralel bir dizi düz çizgi parçası elde edersiniz. Bu düzenleme ile benzer unsurlar her zaman birbirinin altında değildir. Böylece titanyum oksijen grubuna girer; manganez alkali metaller grubuna dahildir; demir alkali toprak grubuna aittir. Bununla birlikte, Chancourtua'nın "sarmalı", bir dizi elementin atom kütleleri arasındaki bazı doğru ilişkileri de düzeltir, ancak yine de elementlerin özelliklerinin periyodikliğini yansıtmaz.
Periyodik Kanunun keşfinin ön koşullarından biri, 1860 yılında Karlsruhe'deki Uluslararası Kimyagerler Kongresi'nin kararlarıydı. atom-moleküler doktrini nihayet kurulduğunda, şimdi göreceli atom kütlesi dediğimiz atom ağırlığının yanı sıra bir molekül ve bir atom kavramlarının ilk birleşik tanımları kabul edildi. D. I. Mendeleev'in sınıflandırmasını temel aldığı, kimyasal elementlerin atomlarının değişmez bir özelliği olarak bu kavramdı. Şöyle yazdı: "Bir maddenin kütlesi, diğer tüm özelliklerin bağlı olması gereken, onun böyle bir özelliğidir. Bu nedenle, bir yandan elementlerin özellikleri ve benzerlikleri arasında bir ilişki aramak en yakın veya en doğal olanıdır. ve diğer tarafta atom ağırlıkları.” D. I. Mendeleev'in öncülleri, yalnızca benzer elementleri birbirleriyle karşılaştırdılar ve bu nedenle Periyodik Yasayı keşfedemediler. Bunların aksine, D. I. Mendeleev, atom kütlelerinin artan değerlerine göre düzenlenmiş, kimyasal elementlerin özelliklerindeki değişimdeki periyodikliği, farklı elementler de dahil olmak üzere, bildiği her şeyi karşılaştırarak keşfetti.
D. I. Mendeleev, keşfinde açıkça formüle edilmiş başlangıç noktalarına dayanıyordu:
- Tüm kimyasal elementlerin atomlarının ortak değişmez özelliği, atom kütleleridir;
– Elementlerin özellikleri atomik kütlelerine bağlıdır;
– Bu bağımlılığın şekli periyodiktir.
Yukarıda tartışılan önkoşullar, koşullu oldukları için bilim adamının kişiliğinden bağımsız, yani nesnel olarak adlandırılabilir. tarihsel gelişim bir bilim olarak kimya.
Ama onsuz kişisel nitelikleri Periyodik Yasanın keşfinin öznel önkoşulunu oluşturan büyük kimyager, 1869'da hemen hemen keşfedilemezdi. Başka bir kimyager onu keşfetmiş olsaydı, muhtemelen çok daha sonra olacaktı. Bilginin ansiklopedik doğası, bilimsel sezgi, genelleme yeteneği, bilinmeyeni bilmenin sürekli arzusu, D. I. Mendeleev'in bilimsel öngörü armağanı, Periyodik Yasanın keşfinde önemli bir rol oynadı.
D. I. Mendeleev'in Keşfi
Periyodik yasa.
1 Mart 1969 Dünyanın dört bir yanındaki bilim topluluğu, dünyanın dört bir yanından birinin yüzüncü yılını kutladı. en büyük yasalar modern doğa bilimi- Kimyasal elementlerin periyodik kanunu. Bilim ve teknoloji bu dönemde dev atılımlar yaptı. D. I. Mendeleev'in Periyodik Yasasının öneminin, modern bilimin görkemli başarılarından önce solmuş olması gerekirdi. Aksine, bugün kimyasal elementlerin Periyodik yasası 100 yıl öncesine göre daha belirgin ve anlamlı görünmektedir.
Periyodik Kanunun keşfi, çeşitliliğe açıklık ve düzen getirdi ve elementlerin ve bunların bileşiklerinin doğası ve kimyasal özellikleri hakkında bilgi saçtı. Kimya, ampirik bir sanattan gerçek, kesin bir bilime dönüştürüldü. D. I. Mendeleev'in tablosunun olağan sadeliği ve netliği, şimdi D. I. Mendeleev'den önce bilinen her şeye hakim olma ve işleme konusundaki devasa ve özenli çalışmayı bizden saklıyor. Elementlerin özelliklerinin periyodiklik yasasının varlığına ilişkin varsayımı mümkün ve uygulanabilir kılmak için muazzam bir iş yapmak zorundaydı.
1869'a kadar sadece 63 element keşfedildi. Bunlardan sadece 48'i kesin olarak belirlenmiş atom kütleleriyle yeterince iyi çalışılmışken, kalan elementlerin atom kütlesi yanlış veya yanlış olarak belirlenmiştir. Elementleri yanlış veya yanlış belirlenmiş atom kütlelerine göre artan düzende sıralayarak, dünyadaki hiçbir kimyager özelliklerinde genel bir model keşfedemez. Yalnızca anlaşılmaz genelleme yeteneği, yasanın her şeyi kapsayan basitliğini görmeyi mümkün kıldı. Bu büyük bir bilimsel cesaret gerektirir ve D. I. Mendeleev bu bilimsel cesarete sahipti. Keşfettiği Periyodik Kanun en önemli gereksinimi karşıladı - yeniyi tahmin etme ve bilinmeyeni öngörme olasılığı. D. I. Mendeleev'in yasası bu konuda eşit değildir.
Nitekim kimyasal elementleri periyodik kanuna göre düzenlemek ve ilk Periyodik tablo, D. I. Mendeleev, içinde “boş” yerler bırakmak ve birçok element için yeni atomik kütle değerlerini kabul etmek zorunda kaldı, yani yeni elementleri tahmin etti. Bu, D. I. Mendeleev'i tüm öncekilerden ayıran yeni keşfedilen yasanın, cesaretin ve kararlılığın gerçeğine güvenmeyi gerektirir.
30 yıldan fazla bir süredir D. I. Mendeleev, Periyodik Yasanın keşfi ve geliştirilmesi üzerinde çalıştı. Yeni bir doğa kanunu keşfettiğinden emin olan D. I. Mendeleev, buna dayanarak, o zamanlar bilime bilinmeyen 12 elementin varlığını tahmin ediyor, bunlardan üçünü veriyor. Detaylı Açıklamaözellikleri ve ayrıca bileşiklerinin özellikleri ve hatta daha sonra elde edilme yolları.
D. I. Mendeleev tarafından Periyodik Kanun temelinde yapılan tüm tahminler ve elementlerin atomik kütlelerinin düzeltilmesi parlak bir şekilde doğrulandı.
Periyodik yasa, kimyada öngörü yasası haline geldi. D. I. Mendeleev'in çalışmaları, bilimin daha da gelişmesi için sağlam ve güvenilir bir temel sağladı. Atomların yapısını ve kombinasyonlarını açıklamak için temel oluşturdular. DI Mendeleev, “Hiçbir şekilde genel olarak tek bir doğa yasası yoktur” diye yazdı, “hemen dayandırılacak; onaylanmasından önce her zaman birçok önsezi gelir ve bir yasanın tanınması tam olarak gerçekleştiğinde gelmez. tüm anlamıyla tanınır, ancak yalnızca, doğa bilimcilerin, değerlendirmelerinin ve görüşlerinin en yüksek otoritesi olarak kabul etmeleri gereken deneylerle sonuçlarının doğrulanmasıyla. Bu kadar kapsamlı bir doğa yasasının keşfinden önce uzun bir "önseziler" aşamasının gelmesi oldukça doğaldır. D. I. Mendeleev'den önce, elementlerin özellikleri arasındaki ilişki üzerine kendi tablolarını ve element grafiklerini ve bireysel belirli kalıpları sunan birçok bilim adamı vardı. D. I. Mendeleev'in keşfinden sonra bazılarının, keşfin önceliği iddiasıyla öne çıkması tesadüf değildir. Kimyasal elementlerin periyodikliğini belirlemek için büyük önem taşıyan, "element" ve "basit gövde" temel kimyasal kavramlarının kesin tanımıydı. Bu kavramları tanımlamada büyük bir değer, öncekilerden farklı olarak, basit cisimler veya eşdeğerler değil, bir elementler sistemi yaratan D. I. Mendeleev'e aittir. “Çeşitli periyodik ilişkiler elementlere aittir” diye yazdı DI Mendeleev, “basit cisimlere değil ve bunu not etmek çok önemlidir, çünkü Periyodik Yasa, atom ağırlığına sahip oldukları için elementler ve karmaşık olanlar gibi basit cisimler için geçerlidir. , kısmi ağırlık. O zaman, D. I. Mendeleev'in hemen hemen tüm öncülleri araştırmalarında çok belirsiz bir element ve basit bir gövde kavramlarını kullandılar ve genellikle sadece gerçek atom kütleleriyle değil, eşdeğerleriyle de çalıştılar. "Atomik kütle", "moleküler kütle", "eşdeğer" gibi kavramların mevcut karışıklığı ile, elementler arasında kalıp arayışına giren birçok kimyager, doğal olarak, fiziksel ve kimyasal özellikleri arasında bir iç bağlantı bulamadı. Örneğin, 1865'te W. Odling. "Course of Practical Chemistry" adlı kitabında "Atom ağırlıkları ve elementlerin işaretleri" başlıklı bir tablo verdi. Bu tablo dışa doğru D. I. Mendeleev'in ilk tablosuna benziyordu. Bununla birlikte, benzerlik tamamen yereldi ve bu nedenle D. I. Mendeleev haklı olarak W. Odling'in tablosunun anlamı hakkında hiçbir şey söylemediğini ve hiçbir yerde bahsetmediğini belirtti.
D. I. Mendeleev'in tüm selefleri, kaydettikleri düzenliliklerden kapsamlı genellemeler yapamadılar.
Uzun yıllar boyunca D. I. Mendeleev devasa bir iş yaptı. Bu yıllarda dikkatinin odak noktası, o zamanın kimyacılarının üzerinde çalıştığı temel problem olan maddelerin kimyasal özellikleri ile fiziksel yapıları arasındaki ilişkinin incelenmesiydi.
Bu alandaki faaliyetler, D. I. Mendeleev'i elementlerin özelliklerindeki değişimde periyodik bir modelin keşfi için hazırladı. 1868'de inorganik kimya dersini okumak. 1869'da 1869'da yayınlanan "Kimyanın Temelleri" ders kitabını derlemeye başladı. Üzerinde çalışan D. I. Mendeleev, kursunun ikinci bölümünün materyalini dağıtmak için mantıklı bir temel arıyordu. Arama, onu benzer element gruplarını karşılaştırma fikrine götürdü. Aynı zamanda, tüm elementlerin artan atom kütleleri düzeninde düzenlenebileceğini ve onları gruplar halinde birleştirebileceğini fark etti. Böylece, "Atomik ağırlıklarına ve kimyasal benzerliklerine dayalı bir elementler sisteminin deneyimi" başlıklı ilk element tablosu ortaya çıktı. D. I. Mendeleev, bu tablonun sadece ders materyalinin mantıksal düzeni için bir gerekçe olarak hizmet etmediğini, aynı zamanda bilinen tüm unsurlar arasında yakın bir ilişki kuran belirli bir doğa yasasını yansıttığını hemen fark etti.
6 Mart 1869 D. I. Mendeleev tarafından derlenen tablo, Rus Kimya Derneği'nin bir toplantısında bildirildi ve ardından Rus Kimya Derneği dergisinde yayınlandı.
1871'de Periyodik Kanun üzerine iki klasik makale yayınladı: "Elementlerin Doğal Sistemi ve Keşfedilmemiş Elementlerin Özelliklerinin Belirlenmesine Uygulanması" ve "Kimyasal Elementlerin Periyodik Düzeni". Bu makaleler, D. I. Mendeleev tarafından keşfedilen yasanın formülasyonunu ve ondan en önemli sonuçları ve sonuçları netleştirmek için yaptığı muazzam çalışmanın bir genellemesiydi. Burada, bilim adamı ilk kez keşfini Periyodik Kanun olarak adlandırıyor.
Keşfettiği yasanın özünü özetleyerek, onu şu sözlerle formüle etti: "Basit cisimlerin özellikleri ile elementlerin bileşiklerinin biçimleri ve özellikleri, atom ağırlıklarının büyüklüğüne periyodik olarak bağımlıdır. elementler." Rus ve yabancı basında, DI Mendeleev'in periyodik yasaya ilişkin mesaj ve makalelerinin yanı sıra makalelerinin özetleri ve materyalin düzenlenmesinin temel alındığı tarihteki ilk ders olan Fundamentals of Chemistry'nin yayınlanması. Periyodik Kanun, dönemin önde gelen kimyacıları tarafından pek önemsenmemiştir.
Bununla birlikte, D. I. Mendeleev'in tahminlerinden bu yana sadece yaklaşık 4 yıl geçti, çünkü bunlardan biri parlak bir onay aldı. Ünlü Fransız analitik kimyager Lecoq de Boisbaudran 27 Ağustos 1875. galyum adını verdiği yeni bir elementin keşfini duyurdu ve özelliklerini açıkladı. Fransız bilim adamının çalışmalarına aşina olan D. I. Mendeleev, yeni elementin kendisi tarafından tahmin edilen eka-alüminyumdan başka bir şey olmadığı sonucuna vardı. Derhal Lecoq de Boisbaudran'a bir mektup ve bir Fransız dergisine ("Reports of the Paris Academy of Sciences") bir not gönderdi. Lecoq de Boisbaudran bu mektup ve dergide yayınlanan not karşısında şaşırmıştı. Kimyager D. I. Mendeleev'in varlığından haberdar değildi ve ayrıca onları keşfeden ve deneysel olarak inceleyen kendisinin yeni elementin özelliklerini daha iyi bilebileceğine inanıyordu. D. I. Mendeleev, Lecoq de Boisbordran'ın bu elementin yoğunluğuna ilişkin tanımının yanlış olduğunu yazdı; D. I. Mendeleev'in hesaplamalarına göre, galyum yoğunluğu 6'ya eşit olmalıdır. Lecoq de Boisbaudran, elementin yoğunluğunun belirlenmesini tekrarladı ve 5,96'ya eşit olduğunu buldu.
Galyumun keşfi, D. I. Mendeleev'in tahminlerinin parlak bir kanıtıydı ve bilim dünyasında büyük bir etki yarattı. Daha önce neredeyse gözden kaçan yazıları şimdi herkesin dikkatini çekti.
1879'da İsveçli kimyager L. Nilson, öksenit ve gadolinit minerallerini incelerken, skandiyum adını verdiği yeni bir element keşfetti. Bu elementin özelliklerinin, periyodik yasa temelinde D. I. Mendeleev tarafından tahmin edilenlerle tamamen aynı olduğu ortaya çıktı.
Ve son olarak, Alman kimyager, Freiberg Madencilik Akademisi profesörü K. A. Winkler, mineral argyroditi analiz ederek, içinde yeni bir bilinmeyen element keşfetti ve ona germanyum adını verdi. Germanyumun özellikleri, D. I. Mendeleev'in ecasilikonun özellikleriyle yaptığı tahminlerle çakıştı.
Bu keşifler, Periyodik Kanun için parlak bir zaferdi. Bazı bilim adamları arasında Periyodik Kanunla ilgili olarak var olan şüphecilik ve şüphelerin yerini, onun en büyük bilimsel önemine olan tam bir güven aldı. Periyodik yasa, dünyadaki çeşitli kimyagerler ve fizikçiler için sağlam bir temel haline geldi. Tüm unsurların ve olası yeni bağlantı türlerinin sistematik olarak incelenmesi dönemi geldi.
Geçen yüzyılın sonunda, Periyodik Kanun evrensel olarak kabul edilmişti. Ebediyet, atomların değişmezliği ve aynı elementin atomlarının göreli kütlesinin kesinlikle aynı olduğu kesinliği hakkında onun altında yatan fikirler sarsılmaz görünüyordu. Bilim adamları-kimyacılar, D. I. Mendeleev'in Periyodik Tablosunda boş hücreleri işgal etmesi gereken hala bilinmeyen elementleri keşfetmenin görevlerini düşündüler. Ancak bilim adamlarının yeni parlak buluşları, Periyodik Kanun'u ciddi testlere tabi tutmuştur. Yani, 1892'de. İngiliz fizikçi R. J. Rayleigh, hava gazlarının yoğunluğunu araştırırken, argon adı verilen yeni bir element buldu. Ertesi yıl, varlığı güneş atmosferinde çok daha önce spektroskopik olarak tespit edilmiş olan başka bir soy gaz, helyum keşfedildi. Bu keşifler D. I. Mendeleev'i biraz şaşırttı, çünkü bu elementlere Periyodik sistemde yer yoktu. Başka bir İngiliz fizikçi ve kimyager W. Ramsay, argon ve helyumu periyodik sisteme özel bir sıfır grubuna yerleştirmeyi önerdi. W. Ramsay aynı anda diğer inert gazların varlığını öngördü ve D. I. Mendeleev yöntemini kullanarak olası özelliklerini önceden açıkladı. Gerçekten de neon, kripton ve ksenon çok geçmeden keşfedildi. İnert elementlerin sıfır grubunu oluşturdular ve bu nedenle Periyodik Tabloya önemli bir katkı sağladılar. Şu anda, kripton ve ksenon için bileşikler elde edildiğinden, bu elementler resmi olarak inert olarak adlandırılamaz. Bu nedenle, artık Periyodik sistemin VIII grubuna yerleştirildiler.
Periyodik Kanunun önemli sonuçlarından biri, atomun yapısının modern doktrinidir.
19. yüzyılın sonunda elektron keşfedildi. Atomun yapısının ilk modelleri, pozitif ve negatif elektriğin düzgün dağılımı hipotezine dayanan ortaya çıktı. E. Rutherford, deneylerin yardımıyla, maddenin büyük kısmının bir atomun çekirdeğinde yoğunlaştığı sonucuna vardı. Bir atomun çekirdeği, tüm atomun hacmine kıyasla çok küçük bir hacme sahiptir. Tüm pozitif yükler çekirdekte yoğunlaşmıştır. Bir atomun pozitif yüklü çekirdeğinin etrafında, tek tek elektronlar, çekirdeğin yüküne eşit miktarda hareket eder. Deneysel verilere dayanarak, E. Rutherford bazı atomların çekirdeğinin yükünü hesapladı. Atom çekirdeğinin yükünü ölçmenin sonuçlarını karşılaştıran Van den Breck, şu varsayımı yaptı: Her bir kimyasal elementin atom çekirdeğinin yükünün, temel yük birimlerinde ölçülen değeri, atom numarasına eşittir, yani, bu elemanın Periyodik tabloda sahip olduğu seri numarası.
Bu sonuç nihayet D. I. Mendeleev'in Periyodik Yasasının gerçek doğasını anlamayı mümkün kıldı. D. I. Mendeleev'in tablosunun altında yatan şeyin ne olduğu, çeşitli kimyasal elementlerin atomlarının nasıl farklılaştığı ve kimyasal bireyselliklerini neyin belirlediği netleşti. Bu nedenle, tüm atomlar yapı olarak benzerdir, yani herhangi bir kimyasal elementin atomu, sayısı çekirdeğin yükü tarafından belirlenen bir çekirdek ve elektronlardan oluşur.
N. Bohr teorisine göre, bir atomdaki elektronlar katmanlar halinde düzenlenir ve bir elementin atomundaki katman sayısının Periyodik sistemin periyot sayısına karşılık geldiği bulundu.
Bu keşiflerin ışığında, D. I. Mendeleev'in Periyodik Yasası şu anda şu şekilde formüle edilmiştir: "Kimyasal elementlerin özellikleri, atom çekirdeklerinin yüklerine veya elementin sıra sayısına periyodik olarak bağlıdır."
Nispeten kısa bir sürede bilimde bu kadar büyük başarıların ana ve çıkış noktası, D. I. Mendeleev'in Periyodik Yasasının keşfidir. Aynı zamanda, bu keşifler sadece azalmakla kalmadı, tam tersine Periyodik Kanun'un ufkunu genişleterek onu doğa bilgisi için güçlü bir araç haline getirdi. Bilimin daha da gelişmesinin temeli oldu. 23 Mayıs 1889'da İngiliz Kimya Derneği'nde konuşulan D. I. Mendeleev'in kehanet sözleri gerçekleşti. Bir araç olarak görme ufkunu genişleten Periyodik Yasanın daha fazla iyileştirme gerektirdiğini, böylece daha yeni unsurların vizyonunun netliğinin tam bir kesinlik için yeterli olduğunu.
İngiliz meslektaşlarına seslenerek, Periyodik Kanunun sadece yeni uygulamalar değil, iyileştirmeler de beklediğini vurguladı.
başarılar modern kimya Atom ve nükleer fiziğin başarıları, yapay elementlerin sentezi Periyodik Kanun sayesinde mümkün oldu. Aynı zamanda, atom fiziğinin başarıları, yeni araştırma yöntemlerinin keşfi, kuantum mekaniğinin gelişimi, sırayla, Periyodik Yasanın özünü genişletti ve derinleştirdi. Bilimin gelişmesi, Periyodik Yasanın henüz tam olarak bilinmediğini ve tamamlanmadığını, D. I. Mendeleev'in yakın zamana kadar bilim adamlarının düşündüğünden çok daha geniş ve derin olduğunu varsaydığını göstermiştir. Böylece, sadece atomun dış kabuklarının yapısının değil, atom çekirdeğinin ince yapısının da periyodiklik yasasına uyduğu ortaya çıktı. Temel parçacıkların karmaşık ve büyük ölçüde henüz anlaşılmamış dünyasını yöneten kalıpların da periyodik bir karaktere dayandığı açıktır.
Periyodik Tablonun Geleceği.
Geleceğe bakmaya çalışalım. Tablonun alt kısmını, son yıllarda keşfedilen unsurları tanıtarak ayrıntılı olarak ele alalım.
1998 yılında elde edilen kimyasal özellikler. 114 numaralı element, Periyodik sistemdeki konumundan kabaca tahmin edilebilir. Karbon grubunda bulunan geçişsiz bir elementtir ve üzerindeki kurşunun özelliklerine benzemelidir. Bununla birlikte, yeni elementin kimyasal özellikleri doğrudan çalışma için mevcut değildir - element birkaç atom miktarında sabittir ve kısa ömürlüdür.
Öğe - No. 118 - yedi elektronik seviyenin tamamı tamamen doldurulmuştur. Bu nedenle, inert gazlar grubunda olması oldukça doğaldır - radon üzerinde bulunur. Böylece D. I. Mendeleev tablosunun 7. periyodu tamamlanmış oldu. Yüzyılın muhteşem finali!
XX yüzyıl boyunca. insanlık çoğunlukla bu yedinci dönemi doldurdu ve şimdi 87 numaralı element olan Fransa'dan uzanıyor. Başka bir sorunu çözmeye çalışalım. 8. periyotta kaç element olacak? Her elektronun eklenmesi yeni bir elementin görünümüne karşılık geldiğinden, s'den g'ye kadar tüm orbitallerdeki maksimum elektron sayısını toplamanız yeterlidir: 2+6+10+14+18=50. Uzun bir süre varsayıldı, ancak bilgisayar hesaplamaları 8. dönemde 50 değil 46 element olacağını gösteriyor. Böylece, 8. periyot #119 elementinden #164'e kadar uzayacaktır.
Periyodik sistemin dikkatli bir incelemesi, başka bir basit örüntüyü not etmemizi sağlar. p-elemanları ilk olarak 2. periyotta, d-elemanları - 4. periyotta, f-elemanları - 6. periyotta görünür. Bir dizi çift sayı ortaya çıktı: 2, 4, 6. Bu model, elektron kabuklarını doldurma kuralları tarafından belirlenir. 8. periyotta neden g-elemanlarının görüneceği şimdi anlaşıldı. Bir dizi çift sayının basit bir devamı! Daha uzun vadeli tahminler de var, ancak bunlar oldukça karmaşık hesaplamalara dayanıyor.
Periyodik Tablonun son elementinin teorik olarak var olup olmadığı çok ilginç? Modern hesaplamalar bu soruyu henüz cevaplayamıyor, bu yüzden henüz bilim tarafından çözülmedi.
Tahminlerimizde yeterince ileri gittik, belki de 22. yüzyıla kadar. , ancak bu oldukça anlaşılabilir bir durumdur. Uzak geleceğe bir bakış atmaya çalışmak, her insan için tamamen doğal bir arzudur.
Çözüm.
Periyodik Yasanın Önemi ve Kimyasal Elementlerin Periyodik Tablosu
D.I. Mendeleyev.
D. I. Mendeleev'in periyodik yasası son derece büyük önem taşımaktadır. Modern kimyanın temellerini attı, onu tek ve bütünsel bir bilim haline getirdi. Elementler, Periyodik sistemde işgal ettikleri yere bağlı olarak karşılıklı ilişki içinde ele alınmaya başlandı. N. D. Zelinsky'nin işaret ettiği gibi, Periyodik Kanun "evrendeki tüm atomların karşılıklı bağlantısının keşfi" idi.
Kimya, tanımlayıcı bir bilim olmaktan çıktı. Periyodik Yasanın keşfiyle, onda bilimsel öngörü mümkün oldu. Yeni elementleri ve bunların bileşiklerini tahmin etmek ve tanımlamak mümkün hale geldi. Bunun parlak bir örneği, D. I. Mendeleev'in kendi zamanında henüz keşfedilmemiş elementlerin varlığına ilişkin öngörüsüdür ve üçü için - Ga, Sc ve Ge - özelliklerinin doğru bir tanımını vermiştir.
D. I. Mendeleev yasasına göre, Z=1'den Z=92'ye kadar olan elementten onun sisteminin tüm boş hücreleri dolduruldu ve ayrıca uranötesi elementler de keşfedildi. Ve bugün bu yasa, yeni kimyasal elementlerin keşfi veya yapay olarak yaratılması için bir kılavuz görevi görüyor.
Periyodik yasa, elementlerin atom kütlelerini düzeltmenin temeli olarak hizmet etti. 20 element için D. I. Mendeleev atom kütlelerini düzeltti, ardından bu elementler Periyodik sistemdeki yerlerini aldı.
Büyük genel bilimsel ve felsefi anlam Periyodik yasa ve sistem, doğanın gelişiminin en genel yasalarını (karşıtların birliği ve mücadelesi, niceliğin niteliğe geçişi, olumsuzlamanın olumsuzlanması) doğrulamasından oluşur.
Atomun yapısı doktrini, atom enerjisinin keşfedilmesine ve insan ihtiyaçları için kullanılmasına yol açtı. 20. yüzyılın tüm kimya ve fizik keşiflerinin birincil kaynağının Periyodik Kanun olduğunu abartmadan söyleyebiliriz. Kimyaya bitişik diğer doğa bilimlerinin gelişmesinde olağanüstü bir rol oynadı.
Periyodik yasa ve sistem, kimya bilimi ve endüstrisinin modern sorunlarının çözümünün temelini oluşturur. D. I. Mendeleev'in periyodik kimyasal element sistemi dikkate alınarak, yeni polimer ve yarı iletken malzemeler, ısıya dayanıklı alaşımlar, istenen özelliklere sahip maddeler, nükleer enerji kullanımı, Dünya'nın içi, Evren elde etmek için çalışmalar devam etmektedir.
D. I. Mendeleev'in kehanet sözleri: “Bilimsel ekim, halkın hasadından payını getirecek” dedi. Tüm düşünceler ve arzular onların içindedir. Büyük bir bilim adamı ve vatansever, bizim için her zaman dürüstlüğün ve çalışkanlığın, halkın çıkarları için mücadelenin bir sembolü olarak kalacaktır. Biz, onun sadık takipçileri, Dmitri İvanoviç Mendeleev'in parlak adını sonsuza kadar onurlandıracağız. "Mendeleev fenomeni" nin uzun bir süre çeşitli uzmanlık bilim adamları tarafından çalışılacağına katılıyorum.
Bilim ve teknolojideki birçok icat ve keşif, coğrafi keşiflerin tarihi ile karşılaştırılabilir. Coğrafi keşifler nasıl yapıldı? Diyelim ki bir keşif seferi kıyıya indi ve kıtanın derinliklerine gitti. "Kıtanın derinliklerine gitti" ne anlama geliyor? Ve bu tam olarak şu anlama geliyor - sabah kalktılar, yediler ve adım adım yürüdüler. Bir milyon adım - ve coğrafi keşif hazır. İnsanlığın geri kalanı için, açıklamaları bir mucize gibidir. Ve onlar için - temel yürüyüş. Ana şey keşfedilmemiş bir alana inmek. Ve elbette, kendi alanında profesyonel olmalısın. Bilimde de. Mendeleev Periyodik Yasayı neden keşfetti? Her şeyden önce, çünkü çok az insan kimyasal elementlerin sınıflandırılmasını düşündü. 19. yüzyılda, o zamana kadar keşfedilen elementlerin tüm özelliklerini çok iyi bilen kaç yüksek nitelikli kimyager vardı? Evet, önde gelen Avrupa üniversitelerinden sadece birkaç profesör. Ve aralarında Mendeleev. Mendeleev kimya dersini okumak zorunda kaldı. Ancak kimyasal elementler hakkındaki bilgi kaosundan gerçekten hoşlanmadı. Benzer özelliklere sahip 2-3 grup element seçildi ve geri kalanının her biri hakkında ayrı ayrı anlatılması gerekiyordu. Hemen söylenmelidir ki, basit bir fikir - elementleri artan atom ağırlıklarına göre düzenlemek, o zaman işe yaramadı. Artık herhangi bir öğrenci, atom ağırlığı arttıkça kimyasal özelliklerdeki değişim modellerini görebilir. Ancak bu, yeni deneysel verilerin birikmesi nedeniyle Mendeleev'in keşfinden sonra mümkün oldu.
Mendeleev, atom ağırlıkları ve oksit formülleri dahil olmak üzere elementlerin temel özelliklerini kartlara yazdı. Ve nasıl gruplanabileceklerini düşünmeye başladım. O zaman alkali ve toprak alkali metal grupları zaten biliniyordu. Ve sonra, bu grupların elementlerinin, aynı sayıda atomik ağırlık birimine göre çiftler halinde farklılık gösterdiğini keşfetti! Potasyum 39, kalsiyum 40, sodyum 23, magnezyum 24. Bu, periyodik yasanın keşfi için ana itici güçtü. Bu nedenle, Mendeleev'in Periyodik Yasası'nın birincil anlayışındaki özü, benzer özelliklere sahip kimyasal element gruplarının olduğu ve bu grupların atom ağırlıklarına göre birbirine bağlı olduğudur. Ve bu düşünce geldiğinde, elementlerle ilgili diğer tüm bilgileri tek bir sisteme sığdırmak mümkün oldu.
Mendeleev'in keşfinin psikolojik mekanizması nedir? Ana şey, öncelikle, çağdaş kimyayı iyi bilen birkaç kimyagerden biriydi. İkincisi, elementlerin özellikleri hakkındaki bilgiyi sistematize etme görevini üstlenmesiydi. Diğer Avrupalı kimya profesörleri kendilerine böyle bir görev vermediler. Bir çözüm bulma sürecinin kendisi çok karmaşık değildi: benzer özelliklere sahip element gruplarının olduğu konusunda bir anlayışı vardı, o zaman elementlerin artan atom ağırlığındaki basit düzeninin basit olmasına rağmen, genel bir anlayışa sahipti. net düzenlilikler görmeye izin vermez, atom ağırlığı temel bir büyüklüktür ve her durumda dikkate alınması gerekir. Bu genel fikirlerin birleşimi, Periyodik Yasanın keşfine yol açtı.
Mendeleev'in Periyodik Sistem hakkında hayal ettiği efsaneye gelince, tarihin özü aşağıdaki gibidir. Mendeleev yasasını keşfettikten sonra, grupların yatay ve periyotların dikey olarak düzenlendiği tablonun ilk versiyonunu çizdi. Bir sabah uyandı ve anladı ki, bunun tersini yaparsanız, yani periyotları yatay, grupları dikey olarak düzenlerseniz, bu Periyodik Kanunun özünü daha açık bir şekilde yansıtacaktır. Periyodik Yasanın keşfinde uykunun rolüyle ilgili tüm hikaye budur.
Dolayısıyla, etkili düşünmenin yollarından biri, yüksek nitelikli bir uzmanın belirli bir dar yönde derinlemesine düşünmeye başlamasıdır. Literatürde bu doğrultuda bilgi toplar, zihinsel fikirlerinin gerçekliğini test etmek için deneyler kurar, gerçek olgulara ilişkin gözlemler yapar. Bu adımların her biri genellikle onun için neredeyse açıktır. Ancak onun için bu delil, daha önce düşünen ve bilgi toplayan tek kişinin kendisi olmasından kaynaklanmaktadır. Yavaş yavaş, soruna bir çözüm buluyor. Bunca yolu gitmeyen başkaları için, kararı bir tür doğaüstü içgörü gibi görünebilir. Kendisi bilinçli olarak her şeyi hatırlamayabilir. uzun Hikaye problem modelinin oluşturulması. Ve bazen yazar için bile, nihai çözüm anlaşılmaz bir şekilde nasıl ortaya çıkmış gibi görünüyor. Ayrıca soruna çözüm bulma anı, zirveye tırmanan bir tırmanıcının verdiği duyguya benzer bir şekilde neşeli bir haz yaşatır. Aydınlanma ile ilgili her türlü efsane bundan doğar. Ama gerçekten zor bir zirveyi fetheden bir dağcı için mi, asıl mesele, yükseliş sırasında binlerce hareket değil, son adım mı?