Yazımızda saf madde ve karışımların ne olduğuna, karışımları ayırma yöntemlerine bakacağız. İÇİNDE Gündelik Yaşam Her birimiz bunları kullanıyoruz. Doğada saf maddeler bulunur mu? Peki bunları karışımlardan nasıl ayırt edebiliriz?
Saf maddeler ve karışımlar: karışımları ayırma yöntemleri
Yalnızca belirli türde parçacıklar içeren maddelere saf denir. Bilim adamları, bunların doğada bulunmadığına inanıyorlar, çünkü hepsi önemsiz oranlarda da olsa yabancı maddeler içeriyor. Kesinlikle tüm maddeler suda da çözünür. Örneğin gümüş bir halka bu sıvıya daldırılsa bile bu metalin iyonları çözeltiye geçecektir.
Saf maddelerin bir işareti, bileşimin ve fiziksel özelliklerin sabitliğidir. Oluşumları sırasında enerji miktarı değişir. Üstelik hem artabilir hem de azalabilir. Saf bir madde ancak kimyasal reaksiyonla bileşenlerine ayrılabilir. Örneğin yalnızca damıtılmış su, bu madde için tipik olan kaynama ve donma noktasına sahiptir ve tadı ve kokusu yoktur. Ve içindeki oksijen ve hidrojen ancak elektrolizle ayrıştırılabilir.
Agregatlarının saf maddelerden farkı nedir? Kimya bu soruyu cevaplamamıza yardımcı olacaktır. Karışımları ayırma yöntemleri fizikseldir çünkü bir değişikliğe yol açmazlar kimyasal bileşim maddeler. Karışımlar, saf maddelerden farklı olarak değişken bileşim ve özelliklere sahiptir ve fiziksel yöntemlerle ayrıştırılabilirler.
Karışım nedir
Karışım, tek tek maddelerin birleşimidir. Bunun bir örneği deniz suyudur. Damıtılmışın aksine acı veya tuzlu bir tada sahiptir, daha yüksek sıcaklıkta kaynar ve daha düşük sıcaklıkta donar. Madde karışımlarını ayırma yöntemleri fizikseldir. Evet, itibaren deniz suyu Saf tuz, buharlaştırma ve ardından kristalleştirme yoluyla elde edilebilir.

Karışım türleri
Suya şeker katarsanız bir süre sonra içindeki parçacıklar eriyecek ve görünmez hale gelecektir. Sonuç olarak çıplak gözle ayırt edilmeleri imkansız hale gelecektir. Bu tür karışımlara homojen veya homojen denir. Bunların örnekleri ayrıca hava, benzin, et suyu, parfüm, tatlı ve tuzlu su, bakır ve alüminyum alaşımı. Gördüğünüz gibi farklı toplanma durumlarında olabilirler, ancak en yaygın olanı sıvılardır. Bunlara çözüm de denir.
Homojen olmayan veya heterojen karışımlarda, tek tek maddelerin parçacıkları ayırt edilebilir. Demir ve ahşap talaşı, kum ve sofra tuzu tipik örneklerdir. Heterojen karışımlara süspansiyon da denir. Bunlar arasında süspansiyonlar ve emülsiyonlar ayırt edilir. Birincisi bir sıvı ve bir katıdan oluşur. Yani emülsiyon su ve kum karışımıdır. Emülsiyon, farklı yoğunluklara sahip iki sıvının birleşimidir.
Özel isimler taşıyan heterojen karışımlar vardır. Dolayısıyla köpüğün bir örneği polistiren köpüktür ve aerosoller arasında sis, duman, deodorantlar, oda spreyleri ve antistatik maddeler bulunur.

Karışımları ayırma yöntemleri
Elbette birçok karışımda daha fazlası var değerli mülkler bileşimlerinde yer alan bireysel maddelerden daha fazladır. Ancak günlük yaşamda bile ayrılmaları gereken durumlar ortaya çıkar. Endüstride ise tüm üretimler bu sürece dayanmaktadır. Örneğin petrolün rafine edilmesi sonucunda benzin, gazyağı, gazyağı, akaryakıt, dizel ve motor yağı, roket yakıtı, asetilen ve benzen elde edilir. Katılıyorum, bu ürünleri kullanmak, akılsızca yağ yakmaktan daha karlı.
Şimdi bakalım böyle bir şey var mı? kimyasal yöntemler Karışımların ayrılması. Diyelim ki tuzun sulu çözeltisinden saf maddeler elde etmemiz gerekiyor. Bunu yapmak için karışımın ısıtılması gerekir. Bunun sonucunda su buhara dönüşecek ve tuz kristalleşecektir. Ancak bu durumda bazı maddelerin diğerlerine dönüşümü söz konusu olmayacaktır. Bu, bu sürecin temelinin fiziksel olgular olduğu anlamına gelir.
Karışımları ayırma yöntemleri, topaklanma durumuna, çözünürlüğe, kaynama noktası farklılığına, bileşenlerin yoğunluğuna ve bileşimine bağlıdır. Belirli örnekleri kullanarak her birine daha ayrıntılı olarak bakalım.

Filtrasyon
Bu ayırma yöntemi, bir sıvı ve bir çözünmeyen katı içeren karışımlar için uygundur. Örneğin su ve nehir kumu. Bu karışımın bir filtreden geçirilmesi gerekiyor. Sonuç olarak saf su içinden serbestçe geçecek ama kum kalacak.
Savunuculuk
Karışımları ayırmaya yönelik bazı yöntemler yerçekimine dayanır. Bu şekilde süspansiyonlar ve emülsiyonlar ayrılabilir. Bitkisel yağ suya karışırsa karışım önce çalkalanmalıdır. Daha sonra bir süreliğine bırakın. Sonuç olarak su kabın dibine ulaşacak ve yağ onu bir film şeklinde kaplayacaktır.
Laboratuar koşullarında çöktürme için kullanılırlar.İşlemi sonucunda daha yoğun olan sıvı kaba boşaltılır ve daha hafif olan sıvı kalır.
Yerleşim, sürecin düşük hızı ile karakterize edilir. Bir çökeltinin oluşması belirli bir süre alır. Endüstriyel şartlarda bu yöntem çökeltme tankı adı verilen özel yapılarda gerçekleştirilir.
Mıknatısla eylem
Karışım metal içeriyorsa mıknatıs kullanılarak ayrılabilir. Mesela demiri ayırmak ve peki bütün metallerin böyle özellikleri var mıdır? Hiç de bile. Bu yönteme yalnızca ferromıknatıs içeren karışımlar uygundur. Bunlar demirin yanı sıra nikel, kobalt, gadolinyum, terbiyum, disprosiyum, holmiyum ve erbiyumu içerir.

Damıtma
Bu isim tercüme edilmiştir Latin dili"düşürmek" anlamına gelir. Damıtma, maddelerin kaynama noktaları arasındaki farklara dayanarak karışımları ayırma yöntemidir. Böylece evinizde bile alkol ile suyu ayırabilirsiniz. İlk madde zaten 78 santigrat derece sıcaklıkta buharlaşmaya başlar. Soğuk bir yüzeye dokunulduğunda alkol buharları yoğunlaşır ve sıvı hal.
Sanayide petrol ürünleri, aromatik maddeler ve saf metaller bu yolla elde edilir.

Buharlaşma ve kristalleşme
Karışımları ayırmaya yönelik bu yöntemler sıvı çözeltiler için uygundur. Bunları oluşturan maddelerin kaynama noktaları farklılık gösterir. Bu sayede çözündükleri sudan tuz veya şeker kristalleri elde edilebilir. Bunu yapmak için çözeltiler ısıtılır ve doymuş bir duruma buharlaştırılır. Bu durumda kristaller biriktirilir. Temiz su elde edilmesi gerekiyorsa, çözelti kaynatılır ve ardından buharlar daha soğuk bir yüzeyde yoğunlaştırılır.

Gaz karışımlarını ayırma yöntemleri
Bu işlem özel ekipman gerektirdiğinden gazlı karışımlar laboratuvar ve endüstriyel yöntemlerle ayrılır. Doğal kökenli hammaddeler hava, kok fırını, jeneratör, ilgili ve hidrokarbonların birleşimi olan doğal gazdır.
Gaz halindeki karışımları ayırmak için kullanılan fiziksel yöntemler şunlardır:
- Yoğunlaşma, bileşenlerinin yoğunlaşmasının meydana geldiği bir karışımın kademeli olarak soğutulması işlemidir. Bu durumda öncelikle seperatörlerde toplanan yüksek kaynama noktalı maddeler sıvı hale geçer. Bu sayede karışımın reaksiyona girmemiş kısmından hidrojen elde edilir ve amonyak da ayrıştırılır.
- Emme, bazı maddelerin diğerleri tarafından emilmesidir. Bu işlem, reaksiyon sırasında aralarında dengenin kurulduğu zıt bileşenlere sahiptir. Doğrudan ve ters süreç gerekli çeşitli koşullar. İlk durumda bu kombinasyon yüksek basınç ve düşük sıcaklık. Bu işleme sorpsiyon denir. Aksi halde tam tersi koşullar kullanılır: yüksek sıcaklıkta düşük basınç.
- Membran ayırma, moleküllerin seçici olarak geçmesine izin vermek için yarı geçirgen bölmelerin özelliğini kullanan bir yöntemdir. çeşitli maddeler.
- Geri akış, karışımların yüksek kaynama noktalı kısımlarının soğutulması sonucu yoğunlaşması işlemidir. Bu durumda, bireysel bileşenlerin sıvı durumuna geçiş sıcaklığı önemli ölçüde farklı olmalıdır.
Kromatografi
Bu yöntemin adı “Renkli yazıyorum” şeklinde tercüme edilebilir. Suya mürekkep eklediğinizi hayal edin. Bir filtre kağıdının ucunu bu karışıma batırırsanız emilmeye başlayacaktır. Bu durumda su, bu maddelerin farklı derecelerdeki emiliminden dolayı mürekkepten daha hızlı emilecektir. Kromatografi sadece karışımları ayırmak için bir yöntem değil, aynı zamanda maddelerin difüzyon ve çözünürlük gibi özelliklerini incelemek için de bir yöntemdir.
Böylece “saf maddeler” ve “karışımlar” gibi kavramlarla tanıştık. Birincisi, yalnızca belirli bir türdeki parçacıklardan oluşan elementler veya bileşiklerdir. Bunlara örnek olarak tuz, şeker, damıtılmış su verilebilir. Karışımlar tek tek maddelerin birleşimidir. Bunları ayırmak için çeşitli yöntemler kullanılır. Ayrılma yöntemi, bileşenlerinin fiziksel özelliklerine bağlıdır. Başlıcaları çökeltme, buharlaştırma, kristalleştirme, filtrasyon, damıtma, manyetik etki ve kromatografiyi içerir.
İLE karışımları ayırma yöntemleri (hem heterojen hem de homojen), karışıma dahil edilen maddelerin bireysel özelliklerini koruduğu gerçeğine dayanmaktadır. Heterojen karışımlar bileşim ve faz durumu bakımından farklılık gösterebilir, örneğin: gaz + sıvı; katı+sıvı; iki karışmayan sıvı vb. Karışımları ayırmanın ana yöntemleri aşağıdaki şemada sunulmuştur. Her yöntemi ayrı ayrı ele alalım.
Heterojen karışımların ayrılması
İçin Heterojen karışımların ayrılması, Katı-sıvı veya katı-gaz sistemlerini temsil eden üç ana yöntem vardır:
- filtreleme,
- çökeltme (dekante etme,
- manyetik ayırma
FİLTRASYON
maddelerin farklı çözünürlüklerine dayanan yöntem ve farklı boyutlar Karışım bileşenlerinin parçacıkları. Filtrasyon, katıyı sıvı veya gazdan ayırmanıza olanak tanır.
Sıvıları filtrelemek için genellikle dörde katlanan ve cam bir huniye yerleştirilen filtre kağıdını kullanabilirsiniz. Huni, içinde biriktiği bir bardağa yerleştirilir. süzüntü- filtreden geçen sıvı.
Filtre kağıdındaki gözeneklerin boyutu, su moleküllerinin ve çözünen moleküllerin engellenmeden sızmasına izin verecek şekildedir. 0,01 mm'den büyük parçacıklar filtrede tutulur ve filtrelenmez.içinden geçerek bir tortu tabakası oluşturur.
Hatırlamak! Filtrasyon kullanarak, maddelerin gerçek çözeltilerini, yani çözünmenin molekül veya iyon düzeyinde meydana geldiği çözeltileri ayırmak imkansızdır.
Kimya laboratuvarlarında filtre kağıdına ek olarak özel filtreler de kullanılır.
farklı gözenek boyutları.
Gaz karışımlarının filtrelenmesi temel olarak sıvıların filtrelenmesinden farklı değildir. Tek fark, gazları askıda katı parçacıklardan (SPM) filtrelerken, gaz karışımını filtreden geçirmek için özel tasarımlı filtrelerin (kağıt, karbon) ve pompaların kullanılmasıdır, örneğin bir arabadaki veya egzoz davlumbazındaki havanın filtrelenmesi bir sobanın üzerinde.
Filtrelenerek ayrılabilir:
- tahıllar ve su,
- tebeşir ve su
- kum ve su vb.
- toz ve hava çeşitli tasarımlar elektrikli süpürgeler)
YERLEŞME
Yöntem, farklı ağırlıklara (yoğunluklara) sahip katı parçacıkların sıvı veya hava ortamında farklı çökelme hızlarına dayanmaktadır. Yöntem, suda (veya başka bir çözücüde) iki veya daha fazla katı, çözünmeyen maddeyi ayırmak için kullanılır. Çözünmeyen maddelerin karışımı suya konur ve iyice karıştırılır. Bir süre sonra yoğunluğu birden fazla olan maddeler kabın dibine çöker ve yoğunluğu birden az olan maddeler yüzeye çıkar. Karışımda farklı yerçekimine sahip birkaç madde varsa, o zaman daha ağır maddeler alt katmana, ardından daha hafif olanlara yerleşecektir. Bu tür katmanlar da ayrılabilir. Daha önce, altın içeren kayalardan altın taneleri bu şekilde izole ediliyordu. İçinden bir su akışının çıktığı eğimli bir hendek üzerine altın içeren kum yerleştirildi. Su akışı atık kayaları alıp götürdü ve ağır altın taneleri hendek dibine yerleşti. Gaz karışımlarında katı parçacıklar da sert yüzeylere yerleşir, örneğin toz mobilyalara veya bitki yapraklarına yerleşir.
Bu yöntem aynı zamanda karışmayan sıvıları ayırmak için de kullanılabilir. Bunu yapmak için bir ayırma hunisi kullanın.
Örneğin benzin ile suyu ayırmak için karışım bir ayırma hunisine konulur ve net bir faz sınırı görünene kadar beklenir. Daha sonra musluğu dikkatlice açın ve su bardağa aksın.
Karışımlar çökeltilerek ayrılabilir:
- nehir kumu ve kil,
- çözeltiden ağır kristal çökelti
- yağ ve su
- sebze yağı ve su vb.
MANYETİK AYIRMA
Yöntem, karışımın katı bileşenlerinin farklı manyetik özelliklerine dayanmaktadır. Bu yöntem, karışım ferromanyetik maddeler, yani demir gibi manyetik özelliklere sahip maddeler içerdiğinde kullanılır.
Manyetik alana bağlı olarak tüm maddeler üç büyük gruba ayrılabilir:
- feromanyetik: mıknatıs tarafından çekilen - Fe, Co, Ni, Gd, Dy
- paramıknatıslar: zayıf bir şekilde çekilmiş - Al, Cr, Ti, V, W, Mo
- diyamanyetik malzemeler: manyetik olarak soyulmuş - Cu, Ag, Au, Bi, Sn, pirinç
Manyetik ayırma ayrılabilir B:
- kükürt ve demir tozu
- kurum ve demir vb.
Homojen karışımların ayrılması
İçin sıvı homojen karışımların ayrılması (gerçek çözümler) aşağıdaki yöntemleri kullanın:
- buharlaşma (kristalleşme),
- damıtma (damıtma),
- kromatografi.
BUHARLAŞMA. KRİSTALLEŞME.
Yöntem, çözücünün ve çözünen maddenin farklı kaynama sıcaklıklarına dayanmaktadır. Çözünür katıları çözeltilerden ayırmak için kullanılır. Buharlaştırma genellikle şu şekilde gerçekleştirilir: çözelti porselen bir kaba dökülür ve çözelti sürekli karıştırılarak ısıtılır. Su yavaş yavaş buharlaşır ve bardağın dibinde katı bir madde kalır.
TANIM
Kristalleşme- bir maddenin gaz (buhar), sıvı veya katı amorf durumdan kristal durumuna faz geçişi.
Bu durumda buharlaşan madde (su veya solvent) daha soğuk bir yüzey üzerinde yoğunlaşma yoluyla toplanabilir. Örneğin, buharlaşma kabının üzerine soğuk bir cam slayt yerleştirirseniz yüzeyinde su damlacıkları oluşacaktır. Damıtma yöntemi de aynı prensibe dayanmaktadır.
DAMITMA. DAMITMA.
Şeker gibi bir madde ısıtıldığında ayrışırsa, su tamamen buharlaşmaz - çözelti buharlaşır ve ardından doymuş çözeltiden şeker kristalleri çökelir. Bazen sudaki tuz gibi solventlerdeki yabancı maddelerin uzaklaştırılması gerekebilir. Bu durumda solventin buharlaştırılması ve ardından buharının toplanıp soğutularak yoğunlaştırılması gerekir. Homojen bir karışımı ayırmaya yarayan bu yönteme denir. damıtma, veya damıtma.
Doğada su vardır saf formu(tuzsuz) oluşmaz. Okyanus, deniz, nehir, kuyu ve kaynak suları tuzların sudaki çözeltileridir. Ancak insanlar sıklıkla tuz içermeyen temiz suya ihtiyaç duyarlar (araba motorlarında kullanılır; kimyasal üretim Almak için çeşitli çözümler ve maddeler; fotoğraf çekerken). Bu suya denir damıtılmış, Laboratuvarda kimyasal deneyler yapmak için kullanılan şey budur.
Damıtma şu şekilde ayrılabilir:
- su ve alkol
- yağ (çeşitli fraksiyonlara)
- aseton ve su vb.
KROMATOGRAFİ
Madde karışımlarını ayırma ve analiz etme yöntemi. Dayalı farklı hızlar test maddesinin iki faz arasında dağılımı - sabit ve hareketli (eluent). Sabit faz, kural olarak, gelişmiş bir yüzeye sahip bir sorbenttir (alüminyum oksit veya çinko oksit veya filtre kağıdı gibi ince toz) ve mobil faz, bir gaz veya sıvı akışıdır. Mobil faz akışı bir emici katmandan filtrelenir veya emici katman boyunca, örneğin filtre kağıdının yüzeyi boyunca hareket eder.
Bağımsız olarak bir kromatogram elde edebilir ve yöntemin özünü pratikte görebilirsiniz. Birkaç mürekkebi karıştırmanız ve elde edilen karışımdan bir damla filtre kağıdına uygulamanız gerekir. Daha sonra renkli noktanın tam ortasına temiz suyu damla damla dökmeye başlayacağız. Her damla ancak bir önceki emildikten sonra uygulanmalıdır. Su, test maddesini emici gözenekli kağıttan aktaran bir eluent rolünü oynar. Karışımı oluşturan maddeler kağıt tarafından farklı şekillerde tutulur: bazıları kağıt tarafından iyi tutulur, bazıları ise daha yavaş emilir ve bir süre su ile birlikte yayılmaya devam eder. Yakında gerçek renkli bir kromatogram bir kağıt yaprağına yayılmaya başlayacak: merkezde çok renkli eşmerkezli halkalarla çevrelenmiş tek renkli bir nokta.
İnce tabaka kromatografisi özellikle organik analizlerde yaygınlaşmıştır. İnce tabaka kromatografisinin avantajı, en basit ve çok hassas tespit yöntemini (görsel inceleme) kullanabilmenizdir. Gözle görülmeyen lekeleri çeşitli reaktiflerin yanı sıra kullanarak ortaya çıkarabilirsiniz. morötesi ışık veya otoradyografi.
Kağıt kromatografisi organik ve inorganik maddelerin analizinde kullanılır. Nadir toprak elementleri, uranyum fisyon ürünleri, platin grubu elementleri gibi karmaşık iyon karışımlarının ayrılması için çok sayıda yöntem geliştirilmiştir.
SANAYİDE KULLANILAN KARIŞIMLARI AYIRMA YÖNTEMLERİ.
Endüstride kullanılan karışımları ayırma yöntemleri, yukarıda açıklanan laboratuvar yöntemlerinden çok az farklıdır.
Doğrultma (damıtma) çoğunlukla yağı ayırmak için kullanılır. Bu süreç konu başlığında daha ayrıntılı olarak açıklanmaktadır. "Petrol rafine etme".
Endüstride maddelerin saflaştırılması ve ayrılması için en yaygın yöntemler sedimantasyon, filtrasyon, sorpsiyon ve ekstraksiyondur. Filtrasyon ve sedimantasyon yöntemleri laboratuvar yöntemine benzer şekilde yürütülür, tek farkı çökeltme tankları ve büyük hacimli filtreler kullanılır. Çoğu zaman, bu yöntemler temizlik için kullanılır. Atıksu. Bu nedenle yöntemlere daha yakından bakalım çıkarma Ve içine çekme.
"Ekstraksiyon" terimi çeşitli faz dengelerine (sıvı-sıvı, gaz-sıvı, sıvı-katı, vb.) uygulanabilir, ancak daha sıklıkla sıvı-sıvı sistemlere uygulanır, bu nedenle çoğunlukla aşağıdaki tanım bulunabilir. :
TANIM
çıkarma Bir maddenin birbiriyle karışmayan iki solvent arasında dağıtılması işlemine dayanan, maddelerin ayrılması, saflaştırılması ve izolasyonu için bir yöntemdir.
Karışmayan çözücülerden biri genellikle su, ikincisi ise organik bir çözücüdür ancak bu gerekli değildir. Ekstraksiyon yöntemi çok yönlüdür; hemen hemen tüm elementlerin çeşitli konsantrasyonlarda izole edilmesi için uygundur. Ekstraksiyon, karmaşık çok bileşenli karışımları genellikle diğer yöntemlere göre daha verimli ve hızlı bir şekilde ayırmanıza olanak tanır. Ekstraksiyon ayırma veya ayırmanın gerçekleştirilmesi, karmaşık veya pahalı ekipman gerektirmez. Süreç otomatikleştirilebilir ve gerekirse uzaktan kontrol edilebilir.
TANIM
İçine çekme- emilime dayalı maddelerin izolasyonu ve saflaştırılması yöntemi sağlam vücut Gaz veya sıvı karışımlarından çeşitli maddelerin (sorbatların) (adsorpsiyonu) veya sıvı sorbenti (absorbsiyonu).
Endüstride çoğunlukla gaz-hava emisyonlarını toz veya duman parçacıklarından ve ayrıca toksik maddelerden arındırmak için emme yöntemleri kullanılır. gaz halindeki maddeler. Gaz halindeki maddelerin emilmesi durumunda, sorbent ile çözünmüş madde arasında kimyasal bir reaksiyon meydana gelebilir. Örneğin amonyak gazını emerkenNH3nitrik asit HNO3 çözeltisi amonyum nitrat NH4NO3 üretir(amonyum nitrat), oldukça etkili bir azotlu gübre olarak kullanılabilir.
Dağınık partiküllerin ortamdan yavaşça salınması durumunda veya heterojen bir sistemin önceden berraklaştırılması gerekiyorsa flokülasyon, flotasyon, sınıflandırma, pıhtılaşma vb. yöntemler kullanılır.
Pıhtılaşma, parçacıkların kolloidal sistemlerde (emülsiyonlar veya süspansiyonlar) agregat oluşumu ile yapışması işlemidir. Brownian hareketi sırasında parçacıkların çarpışması nedeniyle yapışma meydana gelir. Pıhtılaşma, daha düşük bir duruma geçme eğiliminde olan kendiliğinden bir süreci ifade eder. bedava enerji. Pıhtılaşma eşiği, uygulanan maddenin pıhtılaşmaya neden olan minimum konsantrasyonudur. Yapay pıhtılaşma, kolloidal sisteme özel maddeler - pıhtılaştırıcılar - eklenerek ve ayrıca sisteme uygulanarak hızlandırılabilir. Elektrik alanı(elektrokoagülasyon), mekanik etki (titreşim, karıştırma), vb.
Pıhtılaşma sırasında, parçacıkların yüzeyinde bulunan çift elektrik katmanının difüzyon kısmını azaltırken, çözünmüş kabukları yok eden ayrılmış heterojen karışıma genellikle pıhtılaştırıcı kimyasallar eklenir. Bu, parçacıkların toplanmasını ve agregat oluşumunu kolaylaştırır. Böylece dağılmış fazın daha büyük fraksiyonlarının oluşması nedeniyle parçacık birikmesi hızlanır. Pıhtılaştırıcı olarak demir, alüminyum tuzları veya diğer çok değerli metallerin tuzları kullanılır.
Peptizasyon, agregatların birincil parçacıklara ayrışması olan ters bir pıhtılaşma işlemidir. Peptizasyon, dispersiyon ortamına peptitleştirici maddelerin eklenmesiyle gerçekleştirilir. Bu süreç, maddelerin birincil parçacıklara ayrılmasını teşvik eder. Peptizanlar hümik asitler gibi yüzey aktif maddeler veya elektrolitler olabilir veya Demir klorür. Peptizasyon işlemi, macunlardan veya tozlardan sıvı dağılmış sistemler elde etmek için kullanılır.
Flokülasyon da bir tür pıhtılaşmadır. Bu süreçte, gaz veya sıvı ortamda süspanse edilen küçük parçacıklar, flok adı verilen topaklayıcı agregatlar oluşturur. Çözünebilir polimerler, örneğin polielektrolitler, topaklaştırıcı olarak kullanılır. Flokülasyon sırasında topak oluşturan maddeler, filtreleme veya çökeltme yoluyla kolaylıkla uzaklaştırılabilir. Flokülasyon, su arıtımında ve değerli maddelerin atık sudan ayrılmasının yanı sıra minerallerin zenginleştirilmesinde de kullanılır. Su arıtma durumunda, topaklaştırıcılar düşük konsantrasyonlarda (0,1 ila 5 mg/l arasında) kullanılır.
Sıvı sistemlerde agregaları yok etmek için, partiküllerin birbirine yaklaşmasını engelleyen yükleri tetikleyen katkı maddeleri kullanılır. Bu etki ortamın pH'ının değiştirilmesiyle de sağlanabilir. Bu yönteme deflokülasyon denir.
Flotasyon, katı hidrofobik parçacıkları sıvı ve gaz fazları arasındaki arayüzde (sıvı ve gazın temas yüzeyi veya sıvı fazdaki kabarcıkların yüzeyi) seçici olarak sabitleyerek sıvı sürekli fazdan ayırma işlemidir. katı parçacıklar ve gaz kalıntıları sıvı fazın yüzeyinden uzaklaştırılır. Bu işlem sadece dağılmış fazın parçacıklarını uzaklaştırmak için değil aynı zamanda ayırmak için de kullanılır. farklı parçacıklarıslanabilirliklerindeki farklılık nedeniyle. Bu işlemde hidrofobik parçacıklar arayüzde sabitlenir ve dibe çöken hidrofilik parçacıklardan ayrılır. En iyi sonuçlar parçacık boyutu 0,1 ile 0,04 mm arasında olduğunda yüzdürme meydana gelir.
Birkaç yüzdürme türü vardır: köpük, yağ, film vb. En yaygın olanı köpük yüzdürmedir. Bu işlem, reaktiflerle işlenen parçacıkların hava kabarcıkları kullanılarak su yüzeyine taşınmasını sağlar. Bu, stabilitesi bir köpük konsantresi kullanılarak ayarlanan bir köpük tabakasının oluşmasına izin verir.
Sınıflandırma değişken kesitli cihazlarda kullanılır. Onun yardımıyla büyük parçacıklardan oluşan ana üründen belirli sayıda küçük parçacığı ayırmak mümkündür. Sınıflandırma, merkezkaç kuvvetinin etkisinden dolayı santrifüjler ve hidrosiklonlar kullanılarak gerçekleştirilir.
Sistemin manyetik tedavisi kullanılarak süspansiyonların ayrılması çok umut verici bir yöntemdir. Manyetik alanda işlenen su, değişen özelliklerini, örneğin azaltılmış ıslatma kabiliyetini uzun süre korur. Bu işlem süspansiyonların ayrılmasını yoğunlaştırmayı mümkün kılar.
Konu: “Karışımları ayırma yöntemleri” (8.sınıf)Teorik blok.
Karışım kavramının tanımı 17. yüzyılda yapılmıştır. İngiliz bilim adamı Robert Boyle: “Karışım, heterojen bileşenlerden oluşan bütünsel bir sistemdir.”
Karışımın ve saf maddenin karşılaştırmalı özellikleri
|
Karşılaştırma işaretleri |
Saf madde |
Karışım |
|
Birleştirmek |
Devamlı |
Kararsız |
|
Maddeler |
Aynı |
Çeşitli |
|
Fiziki ozellikleri |
Kalıcı |
Kararsız |
|
Oluşum sırasındaki enerji değişimi |
Olay |
Olmuyor |
|
Ayrılma |
Kullanarak kimyasal reaksiyonlar |
Fiziksel yöntemlerle |
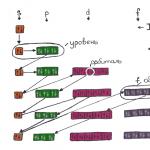
Karışımlar görünüş olarak birbirinden farklıdır.
Karışımların sınıflandırılması tabloda gösterilmektedir:
Süspansiyonlara (nehir kumu + su), emülsiyonlara (bitkisel yağ + su) ve çözeltilere (şişede hava, sofra tuzu + su, küçük değişim: alüminyum + bakır veya nikel + bakır) örnekler verelim.
Karışımları ayırma yöntemleri
Doğada maddeler karışımlar halinde bulunur. Laboratuvar araştırması için, endüstriyel üretim Farmakoloji ve tıp ihtiyaçları için saf maddelere ihtiyaç vardır.
Maddelerin saflaştırılmasında kullanılır çeşitli yollar karışımların ayrılması

Buharlaşma, bir sıvının içinde çözünmüş olan katı maddelerin buhara dönüştürülerek ayrılmasıdır.

Damıtma, sıvı karışımlarda bulunan maddelerin kaynama noktalarına göre ayrılması ve ardından buharın soğutulması işlemidir.
Doğada su saf haliyle (tuzsuz) oluşmaz. Okyanus, deniz, nehir, kuyu ve kaynak suları tuzların sudaki çözeltileridir. Ancak insanlar çoğu zaman tuz içermeyen temiz suya ihtiyaç duyarlar (araba motorlarında, çeşitli çözelti ve maddeler elde etmek için kimyasal üretiminde, fotoğraf yapımında kullanılır). Bu suya damıtılmış denir ve onu elde etme yöntemine damıtma denir.

Filtrasyon - sıvıları (gazları) katı yabancı maddelerden temizlemek için bir filtreden süzmek.

Bu yöntemler farklılıklara dayanmaktadır. fiziki ozellikleri karışımın bileşenleri.
Ayırma yöntemlerini göz önünde bulundurun heterojen
ve homojen karışımlar.
|
Karışım örneği |
Ayırma yöntemi |
|
Süspansiyon - nehir kumu ve su karışımı |
Savunuculuk Ayrılma savunmak dayalı çeşitli yoğunluklar maddeler. Daha ağır kum dibine yerleşir. Ayrıca emülsiyonu ayırabilirsiniz: yağı veya bitkisel yağı sudan ayırın. Laboratuvarda bu, ayırma hunisi kullanılarak yapılabilir. Petrol veya bitkisel yağ en üstteki daha hafif tabakayı oluşturur. Yerleşme sonucunda sisten çiy düşer, dumandan kurum yerleşir ve sütün içine krema yerleşir. Su ve bitkisel yağ karışımının çökeltilerek ayrılması
|
|
Kum karışımı ve sofra tuzu Suda |
Filtrasyon Heterojen karışımların ayrılmasının temeli nedir? filtreleme?Maddelerin sudaki farklı çözünürlükleri ve üzerinde çeşitli boyutlar parçacıklar. Filtrenin gözeneklerinden yalnızca bunlarla karşılaştırılabilecek madde parçacıkları geçer, daha büyük parçacıklar ise filtre üzerinde tutulur. Bu şekilde sofra tuzu ve nehir kumundan oluşan heterojen bir karışımı ayırabilirsiniz. Filtre olarak çeşitli gözenekli maddeler kullanılabilir: pamuk yünü, kömür, pişmiş kil, preslenmiş cam ve diğerleri. Filtreleme yöntemi işin temelidir Ev aletleri elektrikli süpürgeler gibi. Cerrahlar tarafından kullanılır - gazlı bez bandajları; sondajcılar ve asansör çalışanları - solunum maskeleri. Ilf ve Petrov'un çalışmalarının kahramanı Ostap Bender, çay yapraklarını filtrelemek için bir çay süzgeci kullanarak Ogress Ellochka'nın ("On İki Sandalye") sandalyelerinden birini almayı başardı. Nişasta ve su karışımının süzülerek ayrılması
|
|
Demir ve kükürt tozu karışımı |
Mıknatıs veya su ile etki Demir tozu mıknatıs tarafından çekildi, ancak kükürt tozu çekilmedi. Islanamayan kükürt tozu suyun yüzeyinde yüzüyordu ve ağır ıslanabilen demir tozu dibe çöküyordu. Kükürt ve demir karışımını mıknatıs ve su kullanarak ayırma
|
|
Tuzun sudaki çözeltisi homojen bir karışımdır |
Buharlaşma veya kristalleşme Su buharlaşır ve porselen fincanda tuz kristalleri kalır. Elton ve Baskunchak göllerinden su buharlaştırıldığında sofra tuzu elde edilir. Bu ayırma yöntemi, çözücünün ve çözünen maddenin kaynama noktaları arasındaki farka dayanır.Eğer bir madde, örneğin şeker, ısıtıldığında ayrışırsa, o zaman su tamamen buharlaşmaz - çözelti buharlaşır ve ardından şeker kristalleri çöker. Doymuş çözelti Bazen, örneğin tuzdan su gibi, daha düşük sıcaklıkta kaynatma ile çözücülerdeki yabancı maddelerin uzaklaştırılması gerekebilir. Bu durumda maddenin buharlarının toplanması ve soğutularak yoğunlaştırılması gerekir. Homojen bir karışımı ayırmaya yarayan bu yönteme denir. damıtma veya damıtma. Özel cihazlarda - damıtıcılarda, farmakoloji, laboratuvarlar ve araba soğutma sistemlerinin ihtiyaçları için kullanılan damıtılmış su elde edilir. Evde böyle bir damıtıcı inşa edebilirsiniz: Alkol ve su karışımını ayırırsanız, önce kaynama noktası = 78 °C olan alkol damıtılır (alıcı bir test tüpünde toplanır) ve test tüpünde su kalır. Damıtma, petrolden benzin, gazyağı ve gazyağı üretmek için kullanılır. Homojen karışımların ayrılması
|
Belirli bir madde tarafından farklı emilimlerine dayanan bileşenleri ayırmak için özel bir yöntem kromatografi.
Rus botanikçi M. S. Tsvet, kromatografiyi kullanarak bitkilerin yeşil kısımlarından klorofili izole eden ilk kişi oldu. Endüstride ve laboratuvarlarda kromatografi için filtre kağıdı yerine nişasta, kömür, kireçtaşı ve alüminyum oksit kullanılır. Aynı saflaştırma derecesine sahip maddelere her zaman ihtiyaç duyulur mu?
Farklı amaçlar için, farklı saflaştırma derecelerine sahip maddeler gereklidir. Pişirme suyu, kirleri ve dezenfekte etmek için kullanılan kloru uzaklaştırmak için yeterince bekletilmelidir. İçme suyu öncelikle kaynatılmalıdır. Kimya laboratuvarlarında ise çözelti hazırlamak ve deneyler yapmak için, tıpta, içinde çözünen maddelerden mümkün olduğunca arıtılmış damıtılmış suya ihtiyaç vardır. Özellikle saf maddeler, safsızlık içeriği yüzde milyonda birini aşmayan, elektronik, yarı iletken, nükleer teknoloji ve diğer hassas endüstrilerde kullanılmaktadır.
Karışımların bileşimini ifade etme yöntemleri.
Karışımdaki bileşenin kütle oranı- bileşenin kütlesinin tüm karışımın kütlesine oranı. Genellikle kütle oranı % olarak ifade edilir, ancak bu zorunlu değildir.
Karışımdaki bileşenin mol kesri- bir bileşenin mol sayısının (madde miktarının) karışımdaki tüm maddelerin toplam mol sayısına oranı. Örneğin, karışım A, B ve C maddelerini içeriyorsa:
Bileşenlerin molar oranı. Bazen bir karışımın problemleri, bileşenlerinin molar oranını gösterir. Örneğin:
Karışımdaki bileşenin hacim oranı (sadece gazlar için)- A maddesinin hacminin tüm gaz karışımının toplam hacmine oranı.
Pratik blok.
Metal karışımlarının reaksiyona girdiği üç problem örneğine bakalım. tuz asit:
Örnek 1.20 g ağırlığındaki bir bakır ve demir karışımı aşırı hidroklorik asite maruz bırakıldığında 5,6 litre gaz (no.) açığa çıktı. Karışımdaki metallerin kütle fraksiyonlarını belirleyin.
İlk örnekte bakır hidroklorik asitle reaksiyona girmez, yani asit demirle reaksiyona girdiğinde hidrojen açığa çıkar. Böylece hidrojenin hacmini bildiğimizde demirin miktarını ve kütlesini hemen bulabiliriz. Ve buna göre karışımdaki maddelerin kütle kesirleri.
Örnek 1'in çözümü.
Hidrojen miktarını bulma:
n = V / V m = 5,6 / 22,4 = 0,25 mol.
Reaksiyon denklemine göre:
Demir miktarı da 0,25 mol'dür. Kütlesini bulabilirsiniz:
m Fe = 0,25 56 = 14 gr.
Artık karışımdaki metallerin kütle kesirlerini hesaplayabilirsiniz:
ω Fe = m Fe /m tüm karışımın = 14 / 20 = 0,7 = %70
Örnek 2.11 g ağırlığındaki alüminyum ve demir karışımı aşırı hidroklorik asite maruz bırakıldığında 8,96 litre gaz (n.s.) açığa çıktı. Karışımdaki metallerin kütle fraksiyonlarını belirleyin.
İkinci örnekte reaksiyon şu şekildedir: ikisi birden metal Burada her iki reaksiyonda da asitten hidrojen zaten salınmıştır. Bu nedenle burada doğrudan hesaplama yapılamaz. Bu gibi durumlarda, x'i metallerden birinin mol sayısı, y'yi de ikincinin madde miktarı olarak alarak çok basit bir denklem sistemi kullanarak çözmek uygundur.
Örnek 2'nin çözümü.
Hidrojen miktarını bulma:
n = V / V m = 8,96 / 22,4 = 0,4 mol.
Alüminyum miktarı x mol, demir miktarı x mol olsun. O zaman açığa çıkan hidrojen miktarını x ve y cinsinden ifade edebiliriz:
Bu tür sistemleri, ilk denklemi 18 ile çarparak çıkarma yöntemini kullanarak çözmek çok daha uygundur:
27x + 18y = 7,2
ve ilk denklemi ikinciden çıkarırsak:
(56 − 18)y = 11 − 7,2
y = 3,8 / 38 = 0,1 mol (Fe)
x = 0,2 mol (Al)
Daha sonra karışımdaki metallerin kütlelerini ve kütle kesirlerini buluyoruz:
m Al = 0,2 27 = 5,4 g
ω Fe = m Fe/m karışımı = 5,6/11 = 0,50909 (%50,91),
sırasıyla,
ω Al = %100 − %50,91 = %49,09
Cevap: %50,91 demir, %49,09 alüminyum.
Örnek 3.16 g çinko, alüminyum ve bakır karışımı, fazla miktarda hidroklorik asit çözeltisi ile işlendi. Bu durumda 5,6 litre gaz (n.s.) açığa çıktı ve 5 g madde çözünmedi. Karışımdaki metallerin kütle fraksiyonlarını belirleyin.
Üçüncü örnekte iki metal reaksiyona giriyor ancak üçüncü metal (bakır) reaksiyona girmiyor. Bu nedenle 5 g'ın geri kalanı bakırın kütlesidir. Geriye kalan iki metalin (çinko ve alüminyum) miktarları (toplam kütlelerinin 16 − 5 = 11 g olduğuna dikkat edin), örnek 2'deki gibi bir denklem sistemi kullanılarak bulunabilir.
Örnek 3'ün Cevabı: %56,25 çinko, %12,5 alüminyum, %31,25 bakır.
Örnek 4.Demir, alüminyum ve bakırdan oluşan bir karışım, aşırı miktarda soğuk konsantre sülfürik asit ile işlendi. Bu durumda karışımın bir kısmı çözüldü ve 5,6 litre gaz (n.s.) açığa çıktı. Geriye kalan karışım, fazla miktarda sodyum hidroksit çözeltisi ile işleme tabi tutuldu. 3,36 litre gaz açığa çıktı ve 3 g çözünmemiş kalıntı kaldı. Başlangıçtaki metal karışımının kütlesini ve bileşimini belirleyin.
Bu örnekte şunu hatırlamamız gerekiyor. soğuk konsantre sülfürik asit demir ve alüminyumla reaksiyona girmez (pasivasyon), ancak bakırla reaksiyona girer. Bu, kükürt (IV) oksit açığa çıkarır.
alkali ile tepki verir sadece alüminyum- amfoterik metal (alüminyumun yanı sıra çinko ve kalay da alkalilerde çözünür ve berilyum da sıcak konsantre alkalide çözülebilir).
Örnek 4'ün çözümü.
Yalnızca bakır konsantre sülfürik asitle reaksiyona girer, gazın mol sayısı:
n SO2 = V / Vm = 5,6 / 22,4 = 0,25 mol
0,25
0,25
Cu+
2H2S04 (kons.) = CuS04 +
SO2 + 2H2O
(bu tür reaksiyonların elektronik terazi kullanılarak eşitlenmesi gerektiğini unutmayın)
Bakır ve kükürt dioksitin molar oranı 1:1 olduğundan bakır da 0,25 mol olur. Bir miktar bakır bulabilirsiniz:
m Cu = n M = 0,25 64 = 16 gr.
Alüminyum bir alkali çözeltiyle reaksiyona girerek alüminyum ve hidrojenden oluşan bir hidrokso kompleksinin oluşmasına neden olur:
2Al + 2NaOH + 6H20 = 2Na + 3H2
Al 0 − 3e = Al 3+
2
2H + + 2e = H2
3
Hidrojenin mol sayısı:
nH2 = 3,36 / 22,4 = 0,15 mol,
alüminyum ve hidrojenin molar oranı 2:3'tür ve bu nedenle
n Al = 0,15 / 1,5 = 0,1 mol.
Alüminyum ağırlığı:
m Al = n M = 0,1 27 = 2,7 g
Geri kalanı 3 g ağırlığında demirdir.Karışımın kütlesini bulabilirsiniz:
m karışım = 16 + 2,7 + 3 = 21,7 g.
Metallerin kütle kesirleri:
ω Al = 2,7 / 21,7 = 0,1244 (%12,44)
ω Fe = %13,83
Cevap: %73,73 bakır, %12,44 alüminyum, %13,83 demir.
Örnek 5.21.1 g çinko ve alüminyum karışımı, ağırlıkça %20 oranında nitrik asit içeren 565 ml nitrik asit çözeltisi içinde çözüldü. %HNO 3 ve yoğunluğu 1,115 g/ml'dir. Basit bir madde olan ve nitrik asidin indirgenmesinin tek ürünü olan açığa çıkan gazın hacmi 2.912 l (n.s.) idi. Elde edilen çözeltinin bileşimini kütle yüzdesi olarak belirleyin. (RHTU)
Bu problemin metni, nitrojen indirgenmesinin ürününü - "basit bir madde" - açıkça göstermektedir. Metalli nitrik asit hidrojen üretmediğinden nitrojendir. Her iki metal de asitte çözüldü.
Sorun, metallerin başlangıçtaki karışımının bileşimini değil, reaksiyonlardan sonra ortaya çıkan çözeltinin bileşimini soruyor. Bu da görevi daha da zorlaştırıyor.
Örnek 5'in çözümü.
Gaz maddesi miktarını belirleyin:
n N2 = V / Vm = 2,912 / 22,4 = 0,13 mol.
Nitrik asit çözeltisinin kütlesini, çözünmüş HNO3'ün kütlesini ve miktarını belirleyin:
m HNO3 = ω m çözelti = 0,2 630,3 = 126,06 g
n HNO3 = m / M = 126,06 / 63 = 2 mol
Metaller tamamen çözündüğü için bunun şu anlama geldiğini lütfen unutmayın: kesinlikle yeterli asit vardı(bu metaller suyla reaksiyona girmez). Buna göre kontrol edilmesi gerekecek Çok fazla asit var mı? ve sonuçta ortaya çıkan çözeltideki reaksiyondan sonra ne kadarının kaldığı.
Reaksiyon denklemlerini oluşturuyoruz ( elektronik terazinizi unutmayın) ve hesaplamaların kolaylığı için çinko miktarını 5x, alüminyum miktarını ise 10y olarak alıyoruz. Daha sonra denklemlerdeki katsayılara göre, ilk reaksiyondaki nitrojen x mol ve ikinci - 3y mol olacaktır:
|
5x |
X | ||
|
5Zn |
+ 12HNO3 = 5Zn(NO3)2 + |
N 2 |
+6H2O |
|
Zn 0 − 2e = Zn 2+ |
|
5 |
|
2N +5 + 10e = N2 |
1 |
|
10 yıl |
3 yıl | ||
|
10Al |
+ 36HNO3 = 10Al(NO3)3 + |
3N 2 |
+ 18H20 |
Bu sistemi, birinci denklemi 90 ile çarparak ve birinci denklemi ikinciden çıkararak çözmek uygundur.
x = 0,04, yani n Zn = 0,04 5 = 0,2 mol
y = 0,03, yani n Al = 0,03 10 = 0,3 mol
Karışımın kütlesini kontrol edelim:
0,2 65 + 0,3 27 = 21,1 gr.
Şimdi çözümün bileşimine geçelim. Reaksiyonları yeniden yazmak ve reaksiyona giren ve oluşan tüm maddelerin (su hariç) miktarlarını reaksiyonların üzerine yazmak uygun olacaktır:
|
0,2 |
0,48 |
0,2 |
0,03 | |
|
5Zn |
+ 12HNO3 = |
5Zn(NO 3) 2 |
+N2+ |
6H2O |
|
0,3 |
1,08 |
0,3 |
0,09 | |
|
10Al |
+ 36HNO3 = |
10Al(NO 3) 3 |
+3N2+ |
18H2O |
Bir sonraki soru şu: Çözeltide nitrik asit kaldı mı ve ne kadar kaldı?
Reaksiyon denklemlerine göre reaksiyona giren asit miktarı:
nHNO3 = 0,48 + 1,08 = 1,56 mol,
onlar. asit fazlaydı ve çözeltideki geri kalanını hesaplayabilirsiniz:
n HNO3 geri kalanı. = 2 − 1,56 = 0,44 mol.
Yani, içinde son çözümşunları içerir:
m Zn(NO3)2 = n M = 0,2 189 = 37,8 g
0,3 mol miktarında alüminyum nitrat:
m Al(NO3)3 = n M = 0,3 213 = 63,9 g
0,44 mol miktarında fazla nitrik asit:
m HNO3 dinlenme. = n M = 0,44 63 = 27,72 g
Nihai çözümün kütlesi nedir?
Nihai çözeltinin kütlesinin, karıştırdığımız bileşenler (çözeltiler ve maddeler) eksi çözeltiden ayrılan reaksiyon ürünlerinden (çökeltiler ve gazlar) oluştuğunu hatırlayalım:
yeniyim çözelti = asit çözeltisinin kütlesi + metal alaşımının kütlesi - nitrojenin kütlesi
m N2 = n M = 28 (0,03 + 0,09) = 3,36 g
yeniyim çözüm = 630,3 + 21,1 − 3,36 = 648,04 g
Artık ortaya çıkan çözümdeki maddelerin kütle kesirlerini hesaplayabilirsiniz:
O zaman görevimiz için:
ωAl(NO 3) 3 = m hacim / m çözelti = 63,9 / 648,04 = 0,0986
ω HNO3 dinlenme. = m su / m çözelti = 27,72 / 648,04 = 0,0428
Cevap: %5,83 çinko nitrat, %9,86 alüminyum nitrat, %4,28 nitrik asit.
Örnek 6.17,4 g bakır, demir ve alüminyum karışımı, aşırı miktarda konsantre nitrik asit ile işlendiğinde, 4,48 litre gaz (n.o.) açığa çıktı ve bu karışım, aynı miktarda fazla hidroklorik asit miktarına maruz bırakıldığında, 8.96 litre gaz açığa çıktı. gaz (n.o.) serbest bırakıldı.y.). İlk karışımın bileşimini belirleyin. (RHTU)
Bu sorunu çözerken öncelikle aktif olmayan metal (bakır) içeren konsantre nitrik asidin NO 2 ürettiğini ve demir ve alüminyumun bununla reaksiyona girmediğini unutmamalıyız. Hidroklorik asit ise bakırla reaksiyona girmez.
Örnek 6'nın cevabı: %36,8 bakır, %32,2 demir, %31 alüminyum.
Bağımsız çözüm için problemler.
1. İki karışım bileşeniyle ilgili basit problemler.
1-1. 20 g ağırlığındaki bir bakır ve alüminyum karışımı,% 96'lık bir nitrik asit çözeltisi ile işlendi ve 8,96 litre gaz (n.e.) açığa çıktı. Karışımdaki alüminyumun kütle oranını belirleyin.
1-2. 10 g ağırlığındaki bir bakır ve çinko karışımı, konsantre bir alkali çözelti ile işlendi. Bu durumda 2,24 litre gaz (n.y.) açığa çıktı. Başlangıç karışımındaki çinkonun kütle fraksiyonunu hesaplayın.
1-3. 6,4 g ağırlığındaki bir magnezyum ve magnezyum oksit karışımı, yeterli miktarda seyreltik sülfürik asit ile işlendi. Bu durumda 2,24 litre gaz (n.s.) açığa çıktı. Karışımdaki magnezyumun kütle fraksiyonunu bulun.
1-4. 3,08 g ağırlığında çinko ve çinko oksitten oluşan bir karışım seyreltik sülfürik asit içerisinde çözüldü. 6,44 g ağırlığında çinko sülfat elde ettik Orijinal karışımdaki çinkonun kütle fraksiyonunu hesaplayın.
1-5. 9,3 g ağırlığındaki demir ve çinko tozlarından oluşan bir karışım, aşırı bakır (II) klorür çözeltisine maruz bırakıldığında 9,6 g bakır oluştu. İlk karışımın bileşimini belirleyin.
1-6. Hidrojen 4,48 l (n.s.) hacimde salınırsa, 20 g çinko ve çinko oksit karışımını tamamen çözmek için% 20'lik hidroklorik asit çözeltisinin hangi kütlesi gerekli olacaktır?
1-7. Seyreltikte çözündüğünde Nitrik asit 3,04 g demir ve bakır karışımı, 0,896 l (n.s.) hacimde nitrojen oksit (II) açığa çıkarır. İlk karışımın bileşimini belirleyin.
1-8. 1,11 g demir ve alüminyum talaşı karışımı %16'lık hidroklorik asit çözeltisi (ρ = 1,09 g/ml) içinde çözüldüğünde, 0,672 litre hidrojen (n.s.) açığa çıktı. Karışımdaki metallerin kütle oranlarını bulun ve tüketilen hidroklorik asit hacmini belirleyin.
2. Görevler daha karmaşıktır.
2-1. 18,8 g ağırlığındaki bir kalsiyum ve alüminyum karışımı, fazla miktarda grafit tozu ile hava olmadan kalsine edildi. Reaksiyon ürünü seyreltik hidroklorik asit ile işlendi ve 11,2 litre gaz (n.o.) açığa çıktı. Karışımdaki metallerin kütle fraksiyonlarını belirleyin.
2-2. 1,26 g magnezyum-alüminyum alaşımını çözmek için 35 ml %19,6 sülfürik asit çözeltisi (ρ = 1,1 g/ml) kullanıldı. Fazla asit, 1,4 mol/1 konsantrasyona sahip 28,6 ml potasyum bikarbonat çözeltisi ile reaksiyona girdi. Alaşımdaki metallerin kütle fraksiyonlarını ve alaşımın çözünmesi sırasında açığa çıkan gazın hacmini (no.) belirleyin.
2-3. 27,2 g demir ve demir (II) oksit karışımı sülfürik asit içinde çözüldüğünde ve çözelti kuruyana kadar buharlaştırıldığında, 111,2 g demir sülfat - demir (II) sülfat heptahidrat - oluştu. İlk karışımın kantitatif bileşimini belirleyin.
2-4. 28 g ağırlığındaki demir klor ile reaksiyona girdiğinde 77,7 g ağırlığında bir demir (II) ve (III) klorür karışımı oluştu.Elde edilen karışımdaki demir (III) klorürün kütlesini hesaplayın.
2-5. Bu karışımın fazla klor ile işlenmesi sonucunda potasyum klorürün kütle fraksiyonunun% 80 olduğu bir karışım oluşturulmuşsa, lityum ile karışımındaki potasyumun kütle oranı neydi?
2-6. Toplam kütlesi 10.2 g olan bir potasyum ve magnezyum karışımının fazla brom ile işlenmesinden sonra, elde edilen katı karışımın kütlesinin 42.2 g'a eşit olduğu ortaya çıktı.Bu karışım, fazla miktarda sodyum hidroksit çözeltisi ile işlendi, ardından çökelti ayrıldı ve sabit ağırlığa kadar kalsine edildi. Ortaya çıkan kalıntının kütlesini hesaplayın.
2-7.
2-8. Bir alüminyum-gümüş alaşımı, aşırı miktarda konsantre nitrik asit çözeltisi ile işlendi, kalıntı, içinde çözüldü. asetik asit. Her iki reaksiyonda da aynı koşullar altında ölçülen gazların hacimlerinin eşit olduğu ortaya çıktı. Alaşımdaki metallerin kütle kesirlerini hesaplayın.
3. Üç metal ve karmaşık problemler.
3-1. 8,2 g bakır, demir ve alüminyum karışımı aşırı miktarda konsantre nitrik asit ile işlendiğinde 2,24 litre gaz açığa çıktı. Aynı kütledeki aynı karışım fazla miktarda seyreltik sülfürik asit (DS) ile işlendiğinde aynı hacimde gaz açığa çıkar. Başlangıç karışımının bileşimini kütle yüzdesi olarak belirleyin.
3-2. Fazla miktarda seyreltik sülfürik asit ile etkileşime giren 14,7 g demir, bakır ve alüminyum karışımı, 5,6 litre hidrojen (n.s.) açığa çıkarır. Karışımın aynı örneğinin klorlanması için 8,96 litre klor (n.s.) gerekiyorsa, karışımın bileşimini kütle yüzdesi olarak belirleyin.
3-3. Demir, çinko ve alüminyum talaşları 2:4:3 molar oranında (listelenen sıraya göre) karıştırılır. Bu karışımın 4,53 gramı fazla klor ile işleme tabi tutuldu. Elde edilen klorür karışımı 200 ml su içerisinde çözüldü. Ortaya çıkan çözeltideki maddelerin konsantrasyonlarını belirleyin.
3-4. 6 g ağırlığında bir bakır, demir ve çinko alaşımı (tüm bileşenlerin kütleleri eşittir) 160 g ağırlığında% 18,25'lik bir hidroklorik asit çözeltisine yerleştirildi.Sonuçta elde edilen çözeltideki maddelerin kütle fraksiyonlarını hesaplayın.
3-5. Silikon, alüminyum ve demirden oluşan 13,8 g karışım ısıtıldığında fazla sodyum hidroksit ile işlendi ve 11,2 litre gaz (n.s.) açığa çıktı. Böyle bir karışım kütlesi aşırı hidroklorik asite maruz kaldığında 8,96 litre gaz (n.s.) açığa çıkar. Orijinal karışımdaki maddelerin kütlelerini belirleyin.
3-6. Çinko, bakır ve demir karışımı aşırı miktarda konsantre alkali çözelti ile işlendiğinde gaz açığa çıktı ve çözünmemiş kalıntının kütlesinin orijinal karışımın kütlesinden 2 kat daha az olduğu ortaya çıktı. Bu kalıntı fazla miktarda hidroklorik asit ile muamele edildi, salınan gazın hacminin ilk durumda salınan gazın hacmine eşit olduğu ortaya çıktı (hacimler aynı koşullar altında ölçüldü). İlk karışımdaki metallerin kütle kesirlerini hesaplayın.
3-7. Bileşenlerin molar oranı 3:2:5 (listelenen sıraya göre) olan bir kalsiyum, kalsiyum oksit ve kalsiyum karbür karışımı vardır. 55,2 g ağırlığındaki böyle bir karışımla kimyasal reaksiyona girebilecek minimum su hacmi nedir?
3-8. Toplam 7.1 g kütleye sahip bir krom, çinko ve gümüş karışımı seyreltik hidroklorik asit ile işlendi, çözünmemiş kalıntının kütlesi 3.2 g olduğu ortaya çıktı Çökelti ayrıldıktan sonra çözelti alkalin bir ortamda brom ile işlendi ve reaksiyonun sonunda fazla baryum nitrat ile muamele edildi. Oluşan çökeltinin kütlesinin 12.65 g'a eşit olduğu ortaya çıktı İlk karışımdaki metallerin kütle fraksiyonlarını hesaplayın.
Bağımsız çözüm için sorunlara cevaplar ve yorumlar.
1-1. %36 (alüminyum konsantre nitrik asitle reaksiyona girmez);
1-2. %65 (yalnızca amfoterik metal - çinko - alkalide çözünür);
1-5. %30,1 Fe (bakırın yerini alan demir, +2 oksidasyon durumuna girer);
1-7. %36,84 Fe (nitrik asitteki demir +3'e çıkar);
1-8. %75,68 Fe (demir, hidroklorik asitle +2'ye reaksiyona girer); 12.56 ml HC1 çözeltisi.
2-1. %42,55 Ca (grafitli (karbon) kalsiyum ve alüminyum, CaC2 ve Al4C3 karbürlerini oluşturur; su veya HCl ile hidrolize edildiğinde sırasıyla asetilen C2H2 ve metan CH4 açığa çıkar);
2-3. %61,76 Fe (demir sülfat heptahidrat - FeS047H20);
2-7. %5,9 Li2S04, %22,9 Na2S04, %5,47 H202 (lityum oksijenle oksitlendiğinde oksidi oluşur ve sodyum oksitlendiğinde, hidrolize olan Na202 peroksit oluşur) sudan hidrojen peroksite ve alkaliye);
3-1. %39 Cu, %3,4 Al;
3-2. %38,1 Fe, %43,5 Cu;
3-3. %1,53 FeCl3, %2,56 ZnCl2, %1,88 AlCl3 (demir, klor ile oksidasyon durumu +3'e reaksiyona girer);
3-4. %2,77 FeCl2, %2,565 ZnCl2, %14,86 HCl (bakırın hidroklorik asitle reaksiyona girmediğini, dolayısıyla kütlesinin yeni çözeltinin kütlesine dahil olmadığını unutmayın);
3-5. 2,8 g Si, 5,4 g Al, 5,6 g Fe (silikon metal değildir, alkali çözeltiyle reaksiyona girerek sodyum silikat ve hidrojen oluşturur; hidroklorik asitle reaksiyona girmez);
3-6. %6,9 Cu, %43,1 Fe, %50 Zn;
3-8. %45,1 Ag, %36,6 Cr, %18,3 Zn (krom, hidroklorik asit içinde çözüldüğünde krom (II) klorüre dönüşür; bu, alkali bir ortamda bromine maruz bırakıldığında kromata dönüşür; baryum tuzu eklendiğinde çözünmez kromat baryumdan oluşur)
Test bloğu
Bölüm A
1. Kum ve tuz şunları ifade eder:
A. basit maddelere
B. kimyasal bileşiklere
C. homojen sistemlere
D. heterojen sistemlere
2. Sis şunları temsil eder:
A. aerosol
B. emülsiyon
C. çözüm
D. süspansiyon
3. Doğal yağdan benzin elde etmek için aşağıdaki yöntemi kullanın:
A. sentez
B. süblimasyon
C. filtreleme
D. damıtma
4. Belirtin en iyi yol Benzin ve su karışımının ayrılması:
A. filtreleme
B. damıtma
C. süblimasyon
D. yerleşme
5. Yağ ve su karışımının ayrılması aşağıdakilere dayanmaktadır:
A. iki sıvının yoğunluk farkı üzerine
B. bir sıvının diğerindeki çözünürlüğü hakkında
C. renk farkı hakkında
D. sıvıların benzer bir toplanma durumu hakkında
6. Bakır ve demir talaşlarının bir karışımı ayrılabilir:
A. filtreleme
B. mıknatısın etkisiyle
C. kromatografi
D. damıtma (damıtma)
7. Karışımın aksine saf madde nedir:
Ve dökme demir
Gıda karışımında
Havadan
D deniz suyu
8. Heterojen karışımlara ne uygulanır:
Oksijen ve nitrojen karışımı
Çamurlu nehir suyunda
Karlı bir kabukla
9. Katı karışım nedir:
Bir glikoz çözeltisi
Alkol solüsyonu ile
D potasyum sülfat çözeltisi
10.Heterojen bir karışımı saflaştırma yönteminin adı nedir:
Ve damıtma
Filtrelemede
Buharlaşma ile
D jöle ısıtma
Bölüm B
1. Sofra tuzu ve nehir kumu karışımını ayırmak için doğru sırayı oluşturun:
A) filtre
B) bir filtre cihazı monte edin
B) suda çözülür
D) Çözeltiyi buharlaştırmak
D) buharlaştırma cihazını monte edin
2. Ayrılacak madde çiftinin sayısını seçin
1) buharlaşma
2) filtreleme
A) nehir kumu ve su
B) şeker ve su
B) demir ve kükürt
D) su ve alkol
3. Önerilen karışım örneklerini bir veya başka bir grupla (sis, duman, gazlı içecekler, nehir ve deniz çamuru, havanlar, merhem, maskara, ruj, alaşımlar, mineraller), tabloyu doldururken:
|
Maddelerin toplam durumu |
Karışım örnekleri |
|
Zor zor | |
|
Katı-sıvı | |
|
Katı-gaz halinde | |
|
Sıvı-sıvı | |
|
Sıvı-katı | |
|
Sıvı-gaz halinde | |
|
Gazlı-gazlı | |
|
Gaz-sıvı | |
|
Gaz halindeki katı |
Test görevi bloğu
|
1. Görev 1. Tabloyu doldurun |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Cevap: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
2. Bulmacayı çözün Dikey sütunlardaki cevaplar - belirtilen karışımı ayırma yöntemi
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Cevap: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
3. Kamp koşullarında doğal suyu arıtmanın birkaç yolunu önerin. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Cevap: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
4. Anagramlar. Bu dersin ana terimlerini oluşturacak şekilde kelimelerdeki harfleri yeniden düzenleyin. Cevabınıza bu terimleri yazın. MIESSE, CONGREEPA, ZUPENSİYAS, TAXOCHI, RIFOLIFANTE
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Cevap: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
5. Önerilen kavramları 2 gruba ayırın. HAVA, DENİZ SUYU, ALKOL, OKSİJEN, ÇELİK, DEMİR Cevabınızı tabloya girin. Sütunlara ad verin
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Cevap: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
6. Muhteşem kimya Ünlü masallarda üvey anne veya diğer kötü ruhlar, kahramanı bazı karışımları ayrı bileşenlere ayırmaya zorladı. Bunların hangi karışımlar olduğunu ve hangi yöntemle ayrıştırıldığını hatırlıyor musunuz? 2-3 masal hatırlamak yeterlidir. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Cevap: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
7. Soruları kısaca cevaplayın 1. Madencilik ve işleme tesislerinde cevher kırıldığında içine demir alet parçaları düşer. Madenlerden nasıl çıkarılabilirler? 2. Elektrikli süpürge toz içeren havayı emer ve temiz havayı serbest bırakır. Neden? 3. Büyük garajlarda araba yıkandıktan sonra suyun kirlendiği ortaya çıkıyor makine yağı. Kanalizasyona boşaltmadan önce ne yapmalısınız? 4. Un elenerek kepekten arındırılır. Bunu neden yapıyorlar? |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Cevap: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Teorik blok.
Karışım kavramının tanımı 17. yüzyılda yapılmıştır. İngiliz bilim adamı Robert Boyle: “Karışım, heterojen bileşenlerden oluşan bütünsel bir sistemdir.”
Karışımın ve saf maddenin karşılaştırmalı özellikleri
Karşılaştırma işaretleri | Saf madde | Karışım |
Devamlı | Kararsız |
|
Maddeler | Aynı | Çeşitli |
Fiziki ozellikleri | Kalıcı | Kararsız |
Oluşum sırasındaki enerji değişimi | Olay | Olmuyor |
Ayrılma | Kimyasal reaksiyonlar yoluyla | Fiziksel yöntemlerle |
Karışımlar görünüş olarak birbirinden farklıdır.
Karışımların sınıflandırılması tabloda gösterilmektedir:
Süspansiyonlara (nehir kumu + su), emülsiyonlara (bitkisel yağ + su) ve çözeltilere (şişede hava, sofra tuzu + su, küçük değişim: alüminyum + bakır veya nikel + bakır) örnekler verelim.
Karışımları ayırma yöntemleri
Doğada maddeler karışımlar halinde bulunur. Laboratuvar araştırmaları, endüstriyel üretim, farmakoloji ve tıp ihtiyaçları için saf maddelere ihtiyaç vardır.
Maddeleri saflaştırmak için karışımları ayırmak için çeşitli yöntemler kullanılır.
Buharlaşma, bir sıvının içinde çözünmüş olan katı maddelerin buhara dönüştürülerek ayrılmasıdır.

Damıtma- damıtma, sıvı karışımlarda bulunan maddelerin kaynama noktalarına göre ayrılması ve ardından buharın soğutulması.
Doğada su saf haliyle (tuzsuz) oluşmaz. Okyanus, deniz, nehir, kuyu ve kaynak suları tuzların sudaki çözeltileridir. Ancak insanlar çoğu zaman tuz içermeyen temiz suya ihtiyaç duyarlar (araba motorlarında, çeşitli çözelti ve maddeler elde etmek için kimyasal üretiminde, fotoğraf yapımında kullanılır). Bu suya damıtılmış denir ve onu elde etme yöntemine damıtma denir.

Filtrasyon - sıvıları (gazları) katı yabancı maddelerden temizlemek için bir filtreden süzmek.

Bu yöntemler karışımın bileşenlerinin fiziksel özelliklerindeki farklılıklara dayanmaktadır.
Ayırma yöntemlerini göz önünde bulundurun heterojenve homojen karışımlar.
Karışım örneği | Ayırma yöntemi |
Süspansiyon - nehir kumu ve su karışımı | Savunuculuk Ayrılma savunmak farklı madde yoğunluklarına dayanmaktadır. Daha ağır kum dibe çöker. Ayrıca emülsiyonu ayırabilirsiniz: yağı veya bitkisel yağı sudan ayırın. Laboratuvarda bu, ayırma hunisi kullanılarak yapılabilir. Petrol veya bitkisel yağ en üstteki daha hafif tabakayı oluşturur. Yerleşme sonucunda sisten çiy düşer, dumandan kurum yerleşir ve sütün içine krema yerleşir. Su ve bitkisel yağ karışımının çökeltilerek ayrılması |
Suda kum ve sofra tuzu karışımı | Filtrasyon Heterojen karışımların ayrılmasının temeli nedir? filtreleme?Maddelerin sudaki farklı çözünürlükleri ve farklı parçacık boyutları üzerine. Filtrenin gözeneklerinden yalnızca bunlarla karşılaştırılabilecek madde parçacıkları geçer, daha büyük parçacıklar ise filtre üzerinde tutulur. Bu şekilde sofra tuzu ve nehir kumundan oluşan heterojen bir karışımı ayırabilirsiniz. Filtre olarak çeşitli gözenekli maddeler kullanılabilir: pamuk yünü, kömür, pişmiş kil, preslenmiş cam ve diğerleri. Filtreleme yöntemi, elektrikli süpürgeler gibi ev aletlerinin çalışmasının temelidir. Cerrahlar tarafından kullanılır - gazlı bez bandajları; sondajcılar ve asansör çalışanları - solunum maskeleri. Ilf ve Petrov'un çalışmalarının kahramanı Ostap Bender, çay yapraklarını filtrelemek için bir çay süzgeci kullanarak Ogress Ellochka'nın ("On İki Sandalye") sandalyelerinden birini almayı başardı. Nişasta ve su karışımının süzülerek ayrılması |
Demir ve kükürt tozu karışımı | Mıknatıs veya su ile etki Demir tozu mıknatıs tarafından çekildi, ancak kükürt tozu çekilmedi. Islanamayan kükürt tozu suyun yüzeyinde yüzüyordu ve ağır ıslanabilen demir tozu dibe çöküyordu. Kükürt ve demir karışımını mıknatıs ve su kullanarak ayırma |
Tuzun sudaki çözeltisi homojen bir karışımdır | Buharlaşma veya kristalleşme Su buharlaşır ve porselen fincanda tuz kristalleri kalır. Elton ve Baskunchak göllerinden su buharlaştırıldığında sofra tuzu elde edilir. Bu ayırma yöntemi, çözücü ve çözünen maddenin kaynama noktaları arasındaki farka dayanmaktadır. Şeker gibi bir madde ısıtıldığında ayrışırsa, su tamamen buharlaşmaz - çözelti buharlaşır ve ardından doymuş çözeltiden şeker kristalleri çökelir. Bazen sudan tuz gibi daha düşük kaynama noktasına sahip solventlerdeki yabancı maddelerin uzaklaştırılması gerekebilir. Bu durumda maddenin buharlarının toplanması ve soğutularak yoğunlaştırılması gerekir. Homojen bir karışımı ayırmaya yarayan bu yönteme denir. damıtma veya damıtma. Özel cihazlarda - damıtıcılarda, farmakoloji, laboratuvarlar ve araba soğutma sistemlerinin ihtiyaçları için kullanılan damıtılmış su elde edilir. Evde böyle bir damıtıcı inşa edebilirsiniz: Alkol ve su karışımını ayırırsanız, önce kaynama noktası = 78 °C olan alkol damıtılır (alıcı bir test tüpünde toplanır) ve test tüpünde su kalır. Damıtma, petrolden benzin, gazyağı ve gazyağı üretmek için kullanılır. Homojen karışımların ayrılması |
Belirli bir madde tarafından farklı emilimlerine dayanan bileşenleri ayırmak için özel bir yöntem kromatografi.
Rus botanikçi, kromatografiyi kullanarak ilk önce bitkilerin yeşil kısımlarından klorofili izole etti. Endüstride ve laboratuvarlarda kromatografi için filtre kağıdı yerine nişasta, kömür, kireçtaşı ve alüminyum oksit kullanılır. Aynı saflaştırma derecesine sahip maddelere her zaman ihtiyaç duyulur mu?
Farklı amaçlar için, farklı saflaştırma derecelerine sahip maddeler gereklidir. Pişirme suyu, kirleri ve dezenfekte etmek için kullanılan kloru uzaklaştırmak için yeterince bekletilmelidir. İçme suyu öncelikle kaynatılmalıdır. Kimya laboratuvarlarında ise çözelti hazırlamak ve deneyler yapmak için, tıpta, içinde çözünen maddelerden mümkün olduğunca arıtılmış damıtılmış suya ihtiyaç vardır. Özellikle saf maddeler, safsızlık içeriği yüzde milyonda birini aşmayan, elektronik, yarı iletken, nükleer teknoloji ve diğer hassas endüstrilerde kullanılmaktadır.
Karışımların bileşimini ifade etme yöntemleri.
· Karışımdaki bileşenin kütle oranı- bileşenin kütlesinin tüm karışımın kütlesine oranı. Genellikle kütle oranı % olarak ifade edilir, ancak bu zorunlu değildir.
ω ["omega"] = mbileşen / karışım
· Karışımdaki bileşenin mol kesri- bir bileşenin mol sayısının (madde miktarının) karışımdaki tüm maddelerin toplam mol sayısına oranı. Örneğin, karışım A, B ve C maddelerini içeriyorsa:
χ ["chi"] bileşen A = nbileşen A / (n(A) + n(B) + n(C))
· Bileşenlerin molar oranı. Bazen bir karışımın problemleri, bileşenlerinin molar oranını gösterir. Örneğin:
nbileşen A: nbileşen B = 2: 3
· Karışımdaki bileşenin hacim oranı (sadece gazlar için)- A maddesinin hacminin tüm gaz karışımının toplam hacmine oranı.
φ ["phi"] = Vbileşeni / Vkarışımı
Pratik blok.
Metal karışımlarının reaksiyona girdiği üç problem örneğine bakalım. tuz asit:
Örnek 1.20 g ağırlığındaki bir bakır ve demir karışımı aşırı hidroklorik asite maruz bırakıldığında 5,6 litre gaz (n.e.) açığa çıktı. Karışımdaki metallerin kütle fraksiyonlarını belirleyin.
İlk örnekte bakır hidroklorik asitle reaksiyona girmez, yani asit demirle reaksiyona girdiğinde hidrojen açığa çıkar. Böylece hidrojenin hacmini bildiğimizde demirin miktarını ve kütlesini hemen bulabiliriz. Ve buna göre karışımdaki maddelerin kütle kesirleri.
Örnek 1'in çözümü.
n = V / Vm = 5,6 / 22,4 = 0,25 mol.
2. Reaksiyon denklemine göre:
3. Demir miktarı da 0,25 mol'dür. Kütlesini bulabilirsiniz:
mFe = 0,25 56 = 14 gr.
Cevap: %70 demir, %30 bakır.
Örnek 2.11 g ağırlığındaki bir alüminyum ve demir karışımı aşırı hidroklorik asite maruz bırakıldığında 8,96 litre gaz (no.) açığa çıktı. Karışımdaki metallerin kütle fraksiyonlarını belirleyin.
İkinci örnekte reaksiyon şu şekildedir: ikisi birden metal Burada her iki reaksiyonda da asitten hidrojen zaten salınmıştır. Bu nedenle burada doğrudan hesaplama yapılamaz. Bu gibi durumlarda, x'i metallerden birinin mol sayısı, y'yi de ikincinin madde miktarı olarak alarak çok basit bir denklem sistemi kullanarak çözmek uygundur.
Örnek 2'nin çözümü.
1. Hidrojen miktarını bulun:
n = V / Vm = 8,96 / 22,4 = 0,4 mol.
2. Alüminyum miktarı x mol, demir miktarı x mol olsun. O zaman açığa çıkan hidrojen miktarını x ve y cinsinden ifade edebiliriz:
2HCl = FeCl2 + |
4. Toplam hidrojen miktarını biliyoruz: 0,4 mol. Araç,
1,5x + y = 0,4 (bu sistemdeki ilk denklemdir).
5. Bir metal karışımı için şunları ifade etmeniz gerekir: kitleler maddelerin miktarı aracılığıyla.
m = Mn
Yani alüminyumun kütlesi
mAl = 27x,
demir kütlesi
mFe = 56у,
ve tüm karışımın kütlesi
27x + 56y = 11 (bu sistemdeki ikinci denklemdir).
6. İki denklemden oluşan bir sistemimiz var:
7. Bu tür sistemleri, ilk denklemi 18 ile çarparak çıkarma yöntemini kullanarak çözmek çok daha uygundur:
27x + 18y = 7,2
ve ilk denklemi ikinciden çıkarırsak:
8. (56 − 18)y = 11 − 7,2
y = 3,8 / 38 = 0,1 mol (Fe)
x = 0,2 mol (Al)
mFe = n M = 0,1 56 = 5,6 g
mAl = 0,2 27 = 5,4 g
ωFe = mFe / karışım = 5,6 / 11 = %0,50,91,
sırasıyla,
ωAl = %100 − %50,91 = %49,09
Cevap: %50,91 demir, %49,09 alüminyum.
Örnek 3.16 g çinko, alüminyum ve bakır karışımı, fazla miktarda hidroklorik asit çözeltisi ile işlendi. Bu durumda 5,6 litre gaz (n.o.) açığa çıktı ve 5 g madde çözünmedi. Karışımdaki metallerin kütle fraksiyonlarını belirleyin.
Üçüncü örnekte iki metal reaksiyona giriyor ancak üçüncü metal (bakır) reaksiyona girmiyor. Bu nedenle 5 g'ın geri kalanı bakırın kütlesidir. Geriye kalan iki metalin (çinko ve alüminyum) miktarları (toplam kütlelerinin 16 − 5 = 11 g olduğuna dikkat edin), örnek 2'deki gibi bir denklem sistemi kullanılarak bulunabilir.
Örnek 3'ün Cevabı: %56,25 çinko, %12,5 alüminyum, %31,25 bakır.
Örnek 4.Demir, alüminyum ve bakırdan oluşan bir karışım, aşırı miktarda soğuk konsantre sülfürik asit ile işlendi. Bu durumda karışımın bir kısmı çözüldü ve 5,6 litre gaz (n.o.) açığa çıktı. Geriye kalan karışım, fazla miktarda sodyum hidroksit çözeltisi ile işleme tabi tutuldu. 3,36 litre gaz açığa çıktı ve 3 g çözünmemiş kalıntı kaldı. Başlangıçtaki metal karışımının kütlesini ve bileşimini belirleyin.
Bu örnekte şunu hatırlamamız gerekiyor. soğuk konsantre sülfürik asit demir ve alüminyumla reaksiyona girmez (pasivasyon), ancak bakırla reaksiyona girer. Bu, kükürt (IV) oksit açığa çıkarır.
alkali ile tepki verir sadece alüminyum- amfoterik metal (alüminyumun yanı sıra çinko ve kalay da alkalilerde çözünür ve berilyum da sıcak konsantre alkalide çözülebilir).
Örnek 4'ün çözümü.
1. Yalnızca bakır konsantre sülfürik asitle reaksiyona girer, gazın mol sayısı:
nSO2 = V / Vm = 5,6 / 22,4 = 0,25 mol
2H2SO4 (kons.) = CuSO4 + |
2. (bu tür reaksiyonların elektronik denge kullanılarak eşitlenmesi gerektiğini unutmayın)
3. Bakır ve kükürt dioksitin molar oranı 1:1 olduğundan bakır da 0,25 mol olur. Bir miktar bakır bulabilirsiniz:
mCu = n M = 0,25 64 = 16 gr.
4. Alüminyum bir alkali çözeltiyle reaksiyona girerek alüminyum ve hidrojenden oluşan bir hidrokso kompleksinin oluşmasına neden olur:
2Al + 2NaOH + 6H2O = 2Na + 3H2
Al0 − 3e = Al3+ | ||
5. Hidrojenin mol sayısı:
nH2 = 3,36 / 22,4 = 0,15 mol,
alüminyum ve hidrojenin molar oranı 2:3'tür ve bu nedenle
nAl = 0,15 / 1,5 = 0,1 mol.
Alüminyum ağırlığı:
mAl = n M = 0,1 27= 2,7 g
6. Geri kalan kısım demirdir ve ağırlığı 3 g'dır. Karışımın kütlesini bulabilirsiniz:
karışım = 16 + 2,7 + 3 = 21,7 g.
7. Metallerin kütle kesirleri:
ωCu = mCu / karışım = 16 / 21,7 = %0,7,73
ωAl = 2,7 / 21,7 = %0,1,44
ωFe = %13,83
Cevap: %73,73 bakır, %12,44 alüminyum, %13,83 demir.
Örnek 5.21.1 g çinko ve alüminyum karışımı, ağırlıkça %20 oranında nitrik asit içeren 565 ml nitrik asit çözeltisi içinde çözüldü. % NNO3 olup yoğunluğu 1,115 g/ml'dir. Basit bir madde olan ve nitrik asidin indirgenmesinin tek ürünü olan açığa çıkan gazın hacmi 2.912 l (no.) idi. Elde edilen çözeltinin bileşimini kütle yüzdesi olarak belirleyin. (RHTU)
Bu problemin metni, nitrojen indirgenmesinin ürününü - "basit bir madde" - açıkça göstermektedir. Metalli nitrik asit hidrojen üretmediğinden nitrojendir. Her iki metal de asitte çözüldü.
Sorun, metallerin başlangıçtaki karışımının bileşimini değil, reaksiyonlardan sonra ortaya çıkan çözeltinin bileşimini soruyor. Bu da görevi daha da zorlaştırıyor.
Örnek 5'in çözümü.
1. Gaz maddesi miktarını belirleyin:
nN2 = V / Vm = 2,912 / 22,4 = 0,13 mol.
2. Nitrik asit çözeltisinin kütlesini, çözünmüş HNO3'ün kütlesini ve miktarını belirleyin:
mçözüm = ρ V = 1,115 565 = 630,3 g
mHNO3 = ω mçözelti = 0,2 630,3 = 126,06 g
nHNO3 = m / M = 126,06 / 63 = 2 mol
Metaller tamamen çözündüğü için bunun şu anlama geldiğini lütfen unutmayın: kesinlikle yeterli asit vardı(bu metaller suyla reaksiyona girmez). Buna göre kontrol edilmesi gerekecek Çok fazla asit var mı? ve sonuçta ortaya çıkan çözeltideki reaksiyondan sonra ne kadarının kaldığı.
3. Reaksiyon denklemlerini oluşturuyoruz ( elektronik terazinizi unutmayın) ve hesaplamaların kolaylığı için çinko miktarını 5x, alüminyum miktarını ise 10y olarak alıyoruz. Daha sonra denklemlerdeki katsayılara göre, ilk reaksiyondaki nitrojen x mol ve ikinci - 3y mol olacaktır:
12HNO3 = 5Zn(NO3)2 + |
Zn0 − 2e = Zn2+ | ||
36HNO3 = 10Al(NO3)3 + |
Al0 − 3e = Al3+ | ||
5. O halde metal karışımının kütlesinin 21,1 g olduğu dikkate alındığında, bunların molar kütleler- Çinko için 65 g/mol ve alüminyum için 27 g/mol, aşağıdaki denklem sistemini elde ederiz:
6. Bu sistemi birinci denklemi 90 ile çarpıp birinci denklemi ikinciden çıkararak çözmek uygundur.
7. x = 0,04, yani nZn = 0,04 5 = 0,2 mol
y = 0,03, yani nAl = 0,03 10 = 0,3 mol
8. Karışımın kütlesini kontrol edin:
0,2 65 + 0,3 27 = 21,1 gr.
9. Şimdi çözümün bileşimine geçelim. Reaksiyonları yeniden yazmak ve reaksiyona giren ve oluşan tüm maddelerin (su hariç) miktarlarını reaksiyonların üzerine yazmak uygun olacaktır:
10. Sonraki soru: Çözeltide nitrik asit kaldı mı ve ne kadar kaldı?
Reaksiyon denklemlerine göre reaksiyona giren asit miktarı:
nHNO3 = 0,48 + 1,08 = 1,56 mol,
yani asit fazlaydı ve çözeltideki geri kalanını hesaplayabilirsiniz:
nHNO3res. = 2 − 1,56 = 0,44 mol.
11. Yani son çözümşunları içerir:
0,2 mol miktarında çinko nitrat:
mZn(NO3)2 = n M = 0,2 189 = 37,8 g
0,3 mol miktarında alüminyum nitrat:
mAl(NO3)3 = n M = 0,3 213 = 63,9 g
0,44 mol miktarında fazla nitrik asit:
mHNO3geri kalanı. = n M = 0,44 63 = 27,72 g
12. Nihai çözümün kütlesi nedir?
Nihai çözeltinin kütlesinin, karıştırdığımız bileşenler (çözeltiler ve maddeler) eksi çözeltiden ayrılan reaksiyon ürünlerinden (çökeltiler ve gazlar) oluştuğunu hatırlayalım:
13.
O zaman görevimiz için:
14. mnew çözelti = asit çözeltisinin kütlesi + metal alaşımının kütlesi - nitrojenin kütlesi
mN2 = n M = 28 (0,03 + 0,09) = 3,36 g
yeni çözüm = 630,3 + 21,1 − 3,36 = 648,04 g
ωZn(NO3)2 = mv-va / mr-ra = 37,8 / 648,04 = 0,0583
ωAl(NO3)3 = mv-va / mr-ra = 63,9 / 648,04 = 0,0986
ωHNO3geri kalan. = mv-va / mr-ra = 27,72 / 648,04 = 0,0428
Cevap: %5,83 çinko nitrat, %9,86 alüminyum nitrat, %4,28 nitrik asit.
Örnek 6.17,4 g bakır, demir ve alüminyum karışımı, aşırı miktarda konsantre nitrik asitle işlendiğinde, 4,48 litre gaz (n.e.) açığa çıktı ve bu karışım, aynı kütlede fazla hidroklorik asitle maruz bırakıldığında, 8.96 litre gaz açığa çıktı. gaz (n.e.) serbest bırakıldı.y.). İlk karışımın bileşimini belirleyin. (RHTU)
Bu sorunu çözerken öncelikle aktif olmayan bir metal (bakır) içeren konsantre nitrik asidin NO2 ürettiğini, ancak demir ve alüminyumun onunla reaksiyona girmediğini unutmamalıyız. Hidroklorik asit ise bakırla reaksiyona girmez.
Örnek 6'nın cevabı: %36,8 bakır, %32,2 demir, %31 alüminyum.
Bağımsız çözüm için problemler.
1. İki karışım bileşeniyle ilgili basit problemler.
1-1. 20 g ağırlığındaki bir bakır ve alüminyum karışımı,% 96'lık bir nitrik asit çözeltisi ile işlendi ve 8,96 litre gaz (n.e.) açığa çıktı. Karışımdaki alüminyumun kütle oranını belirleyin.
1-2. 10 g ağırlığındaki bir bakır ve çinko karışımı, konsantre bir alkali çözelti ile işlendi. Bu durumda 2,24 litre gaz (n.y.) açığa çıktı. Başlangıç karışımındaki çinkonun kütle fraksiyonunu hesaplayın.
1-3. 6,4 g ağırlığındaki bir magnezyum ve magnezyum oksit karışımı, yeterli miktarda seyreltik sülfürik asit ile işlendi. Bu durumda 2,24 litre gaz (n.o.) açığa çıktı. Karışımdaki magnezyumun kütle fraksiyonunu bulun.
1-4. 3,08 g ağırlığında çinko ve çinko oksitten oluşan bir karışım seyreltik sülfürik asit içerisinde çözüldü. 6,44 g ağırlığında çinko sülfat elde ettik Orijinal karışımdaki çinkonun kütle fraksiyonunu hesaplayın.
1-5. 9,3 g ağırlığındaki demir ve çinko tozlarından oluşan bir karışım, aşırı bakır (II) klorür çözeltisine maruz bırakıldığında 9,6 g bakır oluştu. İlk karışımın bileşimini belirleyin.
1-6. Hidrojen 4,48 l (no.) hacimde salınırsa, 20 g çinko ve çinko oksit karışımını tamamen çözmek için% 20'lik hidroklorik asit çözeltisinin hangi kütlesi gerekli olacaktır?
1-7. Seyreltik nitrik asitte 3,04 g demir ve bakır karışımı çözüldüğünde, 0,896 l (no.) hacimde nitrojen oksit (II) açığa çıkar. İlk karışımın bileşimini belirleyin.
1-8. 1,11 g demir ve alüminyum talaşı karışımı %16'lık bir hidroklorik asit çözeltisi (ρ = 1,09 g/ml) içinde çözüldüğünde, 0,672 litre hidrojen (n.e.) açığa çıktı. Karışımdaki metallerin kütle oranlarını bulun ve tüketilen hidroklorik asit hacmini belirleyin.
2. Görevler daha karmaşıktır.
2-1. 18,8 g ağırlığındaki bir kalsiyum ve alüminyum karışımı, fazla miktarda grafit tozu ile hava olmadan kalsine edildi. Reaksiyon ürünü seyreltik hidroklorik asit ile işlendi ve 11,2 litre gaz (n.o.) açığa çıktı. Karışımdaki metallerin kütle fraksiyonlarını belirleyin.
2-2. 1,26 g magnezyum-alüminyum alaşımını çözmek için 35 ml %19,6 sülfürik asit çözeltisi (ρ = 1,1 g/ml) kullanıldı. Fazla asit, 1,4 mol/1 konsantrasyona sahip 28,6 ml potasyum bikarbonat çözeltisi ile reaksiyona girdi. Alaşımdaki metallerin kütle fraksiyonlarını ve alaşımın çözünmesi sırasında açığa çıkan gazın hacmini (no.) belirleyin.