Baris yra antrosios grupės, D. I. Mendelejevo periodinės cheminių elementų sistemos šeštojo periodo, pagrindinio pogrupio elementas, kurio atominis skaičius 56. Jis žymimas simboliu Ba (lot. baris). Paprasta medžiaga yra minkštas, plastiškas sidabro baltumo šarminių žemių metalas. Pasižymi dideliu cheminiu aktyvumu.
Bario atradimo istorijaBarį oksido BaO pavidalu 1774 m. atrado Karlas Scheele. 1808 m. anglų chemikas Humphrey Davy pagamino bario amalgamą šlapiojo bario hidroksido elektrolizės būdu gyvsidabrio katodu; išgarinęs gyvsidabrį kaitinant, jis išskyrė bario metalą.
1774 m. švedų chemikas Carlas Wilhelmas Scheele'as ir jo draugas Johanas Gottliebas Hahnas ištyrė vieną sunkiausių mineralų, sunkųjį BaSO 4. Jiems pavyko izoliuoti anksčiau nežinomą „sunkiąją žemę“, kuri vėliau buvo pavadinta baritu (iš graikų kalbos βαρυς – sunkioji). Ir po 34 metų Humphry Davy, elektrolizavęs šlapią barito žemę, iš jos gavo naują elementą - barį. Reikia pažymėti, kad tais pačiais 1808 m., kiek anksčiau nei Davy, Jene Jacob Berzelius ir jo bendradarbiai gavo kalcio, stroncio ir bario amalgamas. Taip gimė elementas baris.
Senovės alchemikai kalcinavo BaSO 4 medžiu arba medžio anglimi ir išgaudavo fosforescuojančius „Bolognės brangakmenius“. Tačiau chemiškai šie brangakmeniai yra ne BaO, o bario sulfidas BaS.
vardo kilmė
Jis gavo savo pavadinimą iš graikų barys - "sunkus", nes jo oksidas (BaO) buvo apibūdinamas kaip neįprastai didelis tankis tokioms medžiagoms.
Bario radimas gamtojeŽemės plutoje yra 0,05% bario. Tai gana daug – daug daugiau nei, tarkime, švinas, alavas, varis ar gyvsidabris. Grynos formos žemėje jo nėra: baris yra aktyvus, įtrauktas į šarminių žemių metalų pogrupį ir, žinoma, gana tvirtai surištas su mineralais.
Pagrindiniai bario mineralai yra jau minėtas sunkusis sparnas BaSO 4 (dažniau vadinamas baritu) ir biteris BaCO3, pavadintas anglo Williamo Witheringo (1741 ... 1799), kuris šį mineralą atrado 1782 m., vardu. Bario druskos randamos nedidelė koncentracija daugelyje mineralinių vandenų ir jūros vandens. Mažas kiekis šiuo atveju yra pliusas, o ne minusas, nes visos bario druskos, išskyrus sulfatą, yra nuodingos.
Bario nuosėdų rūšysPagal mineralų asociacijas barito rūdos skirstomos į monomineralines ir kompleksines. Kompleksiniai kompleksai skirstomi į barito-sulfido (turi švino, cinko, kartais vario ir geležies pirito sulfidų, rečiau Sn, Ni, Au, Ag), barito-kalcito (turi iki 75% kalcito), geležies-baritą (turi magnetito). , hematitas ir goetitas bei hidrogoetitas viršutinėse zonose) ir baritas-fluoritas (išskyrus baritą ir fluoritą, juose dažniausiai yra kvarco ir kalcito, o cinko, švino, vario ir gyvsidabrio sulfidų kartais būna smulkių priemaišų pavidalu).
Praktiniu požiūriu didžiausią susidomėjimą kelia hidroterminių venų monomineraliniai, barito-sulfido ir barito-fluorito telkiniai. Kai kurios metasomatinės lakštų nuosėdos ir eluvialiniai įdėklai taip pat turi pramoninę reikšmę. Nuosėdinės nuosėdos, kurios yra tipiškos cheminės vandens baseinų nuosėdos, yra retos ir nevaidina reikšmingo vaidmens.
Paprastai barito rūdose yra kitų naudingų komponentų (fluorito, galenito, sfalerito, vario, aukso pramoninėmis koncentracijomis), todėl jos naudojamos kartu.
Bario izotopaiNatūralų barį sudaro septynių stabilių izotopų mišinys: 130 Ba, 132 Ba, 134 Ba, 135 Ba, 136 Ba, 137 Ba, 138 Ba. Pastarasis yra dažniausias (71,66 proc.). Taip pat žinomi radioaktyvieji bario izotopai, kurių svarbiausias yra 140 Ba. Jis susidaro skylant uranui, toriui ir plutoniui.
Bario gavimasMetalą galima gauti įvairiais būdais, ypač elektrolizės būdu iš išlydyto bario chlorido ir kalcio chlorido mišinio. Barį galima gauti atkuriant jį iš oksido aliuminoterminiu būdu. Norėdami tai padaryti, viteritas kūrenamas anglimi ir gaunamas bario oksidas:
BaCO 3 + C → BaO + 2CO.
Tada BaO mišinys su aliuminio milteliais kaitinamas vakuume iki 1250°C. Redukuoto bario garai kondensuojasi šaltose vamzdžio dalyse, kuriose vyksta reakcija:
3BaO + 2Al → Al 2 O 3 + 3Ba.
Įdomu tai, kad bario peroksidas BaO 2 dažnai įtraukiamas į aliuminotermijos uždegimo mišinių sudėtį.
Išgauti bario oksidą paprasčiausiai kalcinuojant viteritą yra sunku: viteritas suyra tik aukštesnėje nei 1800°C temperatūroje. BaO lengviau gauti kalcinuojant bario nitratą Ba (NO 3) 2:
2Ba (NO 3) 2 → 2BaO + 4NO 2 + O 2.
Elektrolizė ir aliuminio redukcija sukuria minkštą (kietesnį už šviną, bet minkštesnį už cinką) blizgantį baltą metalą. Tirpsta 710°C, verda 1638°C, tankis 3,76 g/cm 3 . Visa tai visiškai atitinka bario padėtį šarminių žemės metalų pogrupyje.
Yra septyni natūralūs bario izotopai. Dažniausias iš jų yra baris-138; tai daugiau nei 70 proc.
Baris yra labai aktyvus. Nuo smūgio savaime užsidega, lengvai skaido vandenį, sudarydamas tirpų bario oksido hidratą:
Ba + 2H 2O → Ba (OH) 2 + H2.
Vandeninis bario hidroksido tirpalas vadinamas barito vandeniu. Šis „vanduo“ naudojamas analitinėje chemijoje CO 2 dujų mišiniuose nustatyti. Bet tai jau iš istorijos apie bario junginių naudojimą. Metalinis baris praktiškai nerandamas. Itin mažais kiekiais jis dedamas į guolius ir spausdinimo lydinius. Radijo lempose naudojamas bario ir nikelio lydinys, grynas baris naudojamas tik vakuuminėje technologijoje kaip geteris (geteris).
Bario metalas gaunamas iš oksido redukuojant aliuminį vakuume 1200-1250°C temperatūroje:
4BaO + 2Al \u003d 3Ba + BaAl 2 O 4.
Baris išvalomas vakuuminiu distiliavimu arba zoniniu lydymu.
Bario titano paruošimas. Jį gauti gana lengva. Witheritas BaCO 3 700 ... 800 ° C temperatūroje reaguoja su titano dioksidu TYu 2, pasirodo, kaip tik tai, ko jums reikia:
BaCO 3 + TiO 2 → BaTiO 3 + CO 2.
Pagrindinis išleistuvės. metalinio bario gavimo iš BaO metodas yra jo redukcija A1 milteliais: 4BaO + 2A1 -> 3Ba + BaO * A1 2 O 3. Procesas vykdomas reaktoriuje 1100-1200°C temperatūroje Ar atmosferoje arba vakuume (pageidautina pastarasis būdas). BaO:A1 molinis santykis yra (1,5-2:1). Reaktorius dedamas į krosnį taip, kad jo „šaltos dalies“ temperatūra (joje kondensuojasi susidarę bario garai) būtų apie 520 °C. Distiliuojant vakuume baris išvalomas iki mažiau nei 10 ~ 4 priemaišų. % masės, o naudojant zoninį lydymą – iki 10 ~ 6 %.
Nedideli bario kiekiai taip pat gaunami redukuojant BaBeO 2 [sintetinamas suliejus Ba (OH) 2 ir Be (OH) 2] 1300 ° C temperatūroje su titanu, taip pat skaidant 120 ° C temperatūroje Ba (N 3) 2, susidaręs keičiantis bario druskų p- katijoms su NaN 3 .
Acetatas Ba (OOCHN 3), - bespalvis. kristalai; lyd.p. 490°С (skilimas); tankus 2,47 g/cm3; sol. vandenyje (58,8 g 100 g 0 ° C temperatūroje). Žemesnėje kaip 25 ° C temperatūroje trihidratas kristalizuojasi iš vandeninių tirpalų, 25–41 ° C temperatūroje - monohidratas, aukštesnėje kaip 41 ° C - bevandenė druska. Gaukite sąveiką. Ba (OH) 2, VaCO 3 arba BaS su CH 3 CO 2 H. Naudojamas kaip kandiklis dažant vilną ir chintzą.
Manganatas(VI) BaMnO 4 - žali kristalai; nesuyra iki 1000°C. Gaunamas kalcinuojant Ba(NO 3) 2 mišinį su MnO 2 . Pigmentas (kaselio arba mangano žalias), dažniausiai naudojamas freskų tapybai.
Chromatas (VI) ВаСrO 4 - geltoni kristalai; lyd.p. 1380°C; - 1366,8 kJ/mol; sol. inorg. iki max, o ne sol. vandenyje. Gaukite sąveiką. vandeniniai Ba (OH) 2 arba BaS tirpalai su šarminių metalų chromatais (VI). Pigmentas (barito geltonas) skirtas keramikai. MPC 0,01 mg / m 3 (pagal Cr0 3). Pirkonatas ВаZrО 3 - bespalvis. kristalai; lyd.p. ~269°С; - 1762 kJ/mol; sol. vandenyje ir vandeniniuose šarmų bei NH 4 HCO 3 tirpaluose, suskaidomas stiprių inorg. to-tami. Gaukite sąveiką. ZrO 2 su BaO, Ba(OH) 2 arba BaCO 3 kaitinant. Ba cirkonatas sumaišytas su ВаТiO 3 -pjezoelektriku.
Bromidas BaBr 2 - balti kristalai; lyd.p. 847 °C; tankus 4,79 g/cm3; -757 kJ/mol; gerai sol. vandenyje, metanolyje, dar blogiau – etanolyje. Iš vandeninių tirpalų dihidratas kristalizuojasi, virsdamas monohidratu 75 ° C temperatūroje, į bevandenę druską - virš 100 ° C. Vandeniniuose tirpaluose sąveika. su oro CO 2 ir O 2, sudarydami VaCO 3 ir Br 2. Gaukite BaBr 2 sąveiką. vandeninis p-griovys Ba (OH) 2 arba VaCO 3 su vandenilio bromido rūgštimi.
Jodidas BaI 2 – bespalvis. kristalai; lyd.p. 740°С (skilimas); tankus 5,15 g/cm3; . -607 kJ/mol; gerai sol. vandenyje ir etanolyje. Iš karšto vandens tirpalų kristalizuojasi dihidratas (dehidratuotas 150 ° C temperatūroje), žemiau 30 ° C - heksahidratas. Gaukite VaI 2 sąveiką. vandens p-griovys Ba (OH) 2 arba VaCO 3 su vandenilio jodo rūgštimi.
Fizinės bario savybėsBaris yra sidabriškai baltas kalusis metalas. Jis nutrūksta nuo stipraus smūgio. Yra dvi alotropinės bario modifikacijos: α-Ba su kubine kūno centre esančia gardele yra stabilus iki 375 °C (parametras a = 0,501 nm), β-Ba stabilus aukščiau.
Kietumas mineralogine skale 1,25; pagal Moso skalę 2.
Bario metalas laikomas žibale arba po parafino sluoksniu.
Bario cheminės savybėsBaris yra šarminių žemių metalas. Jis intensyviai oksiduojasi ore, sudarydamas bario oksidą BaO ir bario nitridą Ba 3 N 2, o šiek tiek pakaitintas užsidega. Energingai reaguoja su vandeniu, sudarydamas bario hidroksidą Ba (OH) 2:
Ba + 2H 2 O \u003d Ba (OH) 2 + H 2
Aktyviai sąveikauja su praskiestomis rūgštimis. Daugelis bario druskų netirpsta arba mažai tirpsta vandenyje: bario sulfatas BaSO 4, bario sulfitas BaSO 3, bario karbonatas BaCO 3, bario fosfatas Ba 3 (PO 4) 2. Bario sulfidas BaS, skirtingai nei kalcio sulfidas CaS, gerai tirpsta vandenyje.
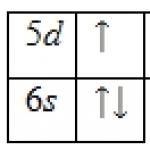
Natūralus nuo gegužės baris turi septynis stabilius izotopus. 130, 132, 134-137 ir 138 sk. (71,66 %). Šiluminių neutronų gaudymo skerspjūvis yra 1,17-10 28 m 2 . Išorinė konfigūracija elektronų apvalkalas 6s 2 ; oksidacijos laipsnis + 2, retai + 1; jonizacijos energija Ba° -> Ba + -> Ba 2+ resp. 5,21140 ir 10,0040 eV; Paulingo elektronegatyvumas 0,9; atominis spindulys 0,221 nm, joninis spindulys Ba 2+ 0,149 nm (koordinacijos skaičius 6).
Lengvai reaguoja su halogenais, sudarydamas halogenidus.
Kaitinamas vandeniliu, susidaro bario hidridas BaH 2 , kuris savo ruožtu su ličio hidridu LiH sudaro Li kompleksą.
Kaitinant reaguoja su amoniaku:
6Ba + 2NH3 = 3BaH2 + Ba3N2
Kaitinamas bario nitridas Ba 3 N 2 reaguoja su CO, sudarydamas cianidą:
Ba 3 N 2 + 2CO = Ba(CN) 2 + 2BaO
Su skystu amoniaku gaunamas tamsiai mėlynas tirpalas, iš kurio galima išskirti amoniaką, kuris turi auksinį blizgesį ir lengvai suyra pašalinus NH 3. Esant platinos katalizatoriui, amoniakas skyla ir susidaro bario amidas:
Ba (NH 2) 2 + 4NH 3 + H 2
Bario karbido BaC 2 galima gauti kaitinant BaO su anglimi lankinėje krosnyje.
Su fosforu jis sudaro fosfidą Ba 3 P 2 .
Baris redukuoja daugelio metalų oksidus, halogenidus ir sulfidus iki atitinkamo metalo.
Bario panaudojimasBario lydinys su A1 (alba lydinys, 56% Ba) yra geterių (geterių) pagrindas. Norint gauti patį geterį, iš lydinio aukšto dažnio kaitinimo būdu išgarinamas baris vakuuminėje prietaiso kolboje; bario veidrodis (arba difuzinė danga išgarinant azoto atmosferoje). Aktyvioji daugumos termioninių katodų dalis yra BaO. Baris taip pat naudojamas kaip Cu ir Pb deoksidatorius, kaip antifrikcinis priedas. lydiniai, juodieji ir spalvotieji metalai, taip pat lydiniai, iš kurių daromi tipografiniai šriftai, siekiant padidinti jų kietumą. Bario lydiniai su Ni naudojami vidaus variklių pakaitinimo žvakių elektrodams gaminti. degimo ir radijo lempose. 140 Va (T 1/2 12,8 paros) yra izotopinis indikatorius, naudojamas tiriant bario junginius.
Bario metalas, dažnai lydinyje su aliuminiu, naudojamas kaip geteris didelio vakuumo elektroniniuose prietaisuose.
Antikorozinė medžiagaBaris kartu su cirkoniu dedamas į skystus metalų aušinimo skysčius (natrio, kalio, rubidžio, ličio, cezio lydinius), siekiant sumažinti pastarųjų agresyvumą vamzdynams, metalurgijoje.
Bario fluoridas pavienių kristalų pavidalu naudojamas optikoje (lęšiuose, prizmėse).
Bario peroksidas naudojamas pirotechnikai ir kaip oksidatorius. Bario nitratas ir bario chloratas naudojami pirotechnikoje liepsnoms nuspalvinti (žaliai ugniai).
Bario chromatas naudojamas vandenilio ir deguonies gamyboje termocheminiu metodu (Oak Ridge ciklas, JAV).
Bario oksidas kartu su vario ir retųjų žemių metalų oksidais naudojamas superlaidžiai keramikai, veikiančiai skysto azoto ir aukštesnėje temperatūroje, sintetinti.
Bario oksidas naudojamas specialaus stiklo, naudojamo urano strypams padengti, lydymui. Vienas iš plačiai paplitusių tokių stiklų tipų turi tokią sudėtį - (fosforo oksidas - 61%, BaO - 32%, aliuminio oksidas - 1,5%, natrio oksidas - 5,5%). Gaminant stiklą branduolinei pramonei, bario fosfatas taip pat naudojamas.
Bario fluoridas naudojamas kietojo kūno fluoro akumuliatoriuose kaip fluorido elektrolito komponentas.
Bario oksidas naudojamas galinguose vario oksido akumuliatoriuose kaip aktyviosios masės komponentas (bario oksidas-vario oksidas).
Bario sulfatas naudojamas kaip neigiamo elektrodo aktyviosios masės plėtiklis švino rūgšties akumuliatorių gamyboje.
Į stiklo masę dedama bario karbonato BaCO 3, kad padidėtų stiklo lūžio rodiklis. Bario sulfatas naudojamas popieriaus pramonėje kaip užpildas; popieriaus kokybę daugiausia lemia jo svoris, baritas BaSO 4 daro popierių sunkesnį. Ši druska būtinai įtraukta į visas brangias popieriaus rūšis. Be to, bario sulfatas plačiai naudojamas gaminant baltus litopono dažus – bario sulfido ir cinko sulfato tirpalų reakcijos produktą:
BaS + ZnSO 4 → BaSO 4 + ZnS.
Abi druskos, turinčios baltą spalvą, nusėda, tirpale lieka grynas vanduo.
Gręžiant gilius naftos ir dujų gręžinius, kaip gręžimo skystis naudojama bario sulfato suspensija vandenyje.
Kita bario druska naudojama svarbiai. Tai bario titanatas BaTiO 3 – vienas svarbiausių feroelektrikų (feroelektrikai poliarizuojasi patys, neveikiant išoriniam laukui. Tarp dielektrikų jie išsiskiria taip pat, kaip ir feromagnetinės medžiagos tarp laidininkų. Tokios poliarizacijos galimybė yra palaikoma tik tam tikroje temperatūroje.. Poliarizuoti feroelektrikai skiriasi didesne dielektrine konstanta), kurios laikomos labai vertingomis elektros medžiagomis.
1944 metais ši klasė buvo papildyta bario titanatu, kurio feroelektrines savybes atrado sovietų fizikas B.M. Vulom. Bario titanato ypatybė yra ta, kad jis išlaiko feroelektrines savybes labai plačiame temperatūrų diapazone – nuo artimo absoliutaus nulio iki +125°C.
Baris taip pat buvo naudojamas medicinoje. Jo sulfatinė druska naudojama skrandžio ligų diagnostikai. BaSO 4 sumaišomas su vandeniu ir pacientui leidžiama jį nuryti. Bario sulfatas yra nepermatomas rentgeno spinduliams, todėl tos virškinamojo trakto dalys, pro kurias eina „bario košė“, ekrane lieka tamsios. Taigi gydytojas gauna supratimą apie skrandžio ir žarnyno formą, nustato vietą, kur gali atsirasti opa.
Bario poveikis žmogaus organizmui
Patekimo į kūną būdai.
Pagrindinis būdas, kuriuo baris patenka į žmogaus organizmą, yra su maistu. Taigi kai kurie jūros gyventojai sugeba sukaupti barį iš aplinkinio vandens, o koncentracijose 7-100 (o kai kuriems jūros augalams iki 1000) kartų didesnės nei jo kiekis jūros vandenyje. Kai kurie augalai (pavyzdžiui, sojos pupelės ir pomidorai) taip pat gali sukaupti barį iš dirvožemio 2–20 kartų. Tačiau vietovėse, kuriose bario koncentracija vandenyje yra didelė, geriamasis vanduo taip pat gali prisidėti prie bendro bario suvartojimo. Bario pasisavinimas iš oro yra nereikšmingas.
Pavojus sveikatai.
PSO globojamų mokslinių epidemiologinių tyrimų metu duomenys apie mirtingumo nuo širdies ir kraujagyslių ligų ryšį su bario kiekiu geriamajame vandenyje nepasitvirtino. Trumpalaikių tyrimų su savanoriais metu, kai bario koncentracija buvo iki 10 mg/l, neigiamo poveikio širdies ir kraujagyslių sistemai nepastebėta. Tiesa, atliekant eksperimentus su žiurkėmis, kai pastarosios vartojo vandenį net ir su nedideliu bario kiekiu, buvo pastebėtas sistolinio kraujospūdžio padidėjimas. Tai rodo galimą pavojų, kad žmonėms gali padidėti kraujospūdis, ilgai vartojant vandenį, kuriame yra bario (tokių duomenų turi USEPA).
USEPA duomenys taip pat rodo, kad net vienas gėrimas vandens, kuriame yra daug daugiau nei didžiausias bario kiekis, gali sukelti raumenų silpnumą ir pilvo skausmą. Tačiau būtina atsižvelgti į tai, kad USEPA kokybės standarto nustatytas bario standartas (2,0 mg/l) gerokai viršija PSO rekomenduojamą vertę (0,7 mg/l). Rusijos sanitariniai standartai nustato dar griežtesnę MPC reikšmę bariui vandenyje – 0,1 mg/l. Vandens šalinimo technologijos: jonų mainai, atvirkštinis osmosas, elektrodializė.
Su chemine formule BaSO 4 . Tai bekvapiai balti milteliai, netirpūs vandenyje. Jo baltumas ir neskaidrumas, taip pat didelis tankis nusako pagrindines jo taikymo sritis.
Vardų istorija
Baris priklauso šarminių žemių metalams. Pastarieji taip pavadinti, nes, anot D. I. Mendelejevo, jų junginiai sudaro netirpią žemės masę, o oksidai „turi žemišką išvaizdą“. Baris gamtoje randamas mineralinio barito pavidalu, kuris yra bario sulfatas su įvairiomis priemaišomis.
Pirmą kartą jį atrado švedų chemikai Scheele ir Hahn 1774 m. kaip vadinamojo sunkiojo sparno dalį. Iš čia kilo mineralo pavadinimas (iš graikų „baris“ – sunkusis), o vėliau ir pats metalas, kai 1808 metais jį gryna forma išskyrė Humphry Devi.
Fizinės savybės
Kadangi BaSO 4 yra sieros rūgšties druska, jos fizines savybes iš dalies lemia pats metalas, kuris yra minkštas, reaktyvus ir sidabriškai baltas. Natūralus baritas yra bespalvis (kartais baltas) ir skaidrus. Chemiškai grynas BaSO 4 yra nuo baltos iki šviesiai geltonos spalvos, yra nedegus, lydymosi temperatūra 1580°C.

Kokia yra bario sulfato masė? Jo molinė masė yra 233,43 g/mol. Jis turi neįprastai didelį savitąjį svorį – nuo 4,25 iki 4,50 g/cm 3 . Atsižvelgiant į jo netirpumą vandenyje, dėl didelio tankio jis yra nepakeičiamas kaip vandeninių gręžimo skysčių užpildas.
Cheminės savybės
BaSO 4 yra vienas iš blogiausiai tirpių junginių vandenyje. Jį galima gauti iš dviejų labai tirpių druskų. Paimkite vandeninį natrio sulfato - Na 2 SO 4 tirpalą. Jo molekulė vandenyje disocijuoja į tris jonus: du Na + ir vieną SO 4 2-.
Na 2 SO 4 → 2Na + + SO 4 2-

Paimkime ir vandeninį bario chlorido - BaCl 2 tirpalą, kurio molekulė disocijuoja į tris jonus: vieną Ba 2+ ir du Cl - .
BaCl 2 → Ba 2+ + 2Cl -
Sumaišykite vandeninį sulfato tirpalą ir mišinį, kuriame yra chlorido. Bario sulfatas susidaro susijungus dviem to paties dydžio ir priešingo krūvio jonams į vieną molekulę.
Ba 2+ + SO 4 2- → BaSO 4
Žemiau galite pamatyti visą šios reakcijos lygtį (vadinamąją molekulinę lygtį).
Na 2 SO 4 + BaCl 2 → 2 NaCl + BaSO 4

Dėl to susidaro netirpios bario sulfato nuosėdos.
Prekės baritas
Praktiškai komercinio bario sulfato, skirto naudoti gręžimo skysčiams gręžiant naftos ir dujų gręžinius, gamybos žaliava paprastai yra mineralinis baritas.
Sąvoka „pirminis“ baritas reiškia komercinius produktus, į kuriuos įeina žaliava (gaunama iš kasyklų ir karjerų), taip pat produktai, pagaminti iš paprasto sodrinimo taikant tokius metodus kaip plovimas, nusodinimas, atskyrimas sunkiose terpėse, flotacija. Daugumos žaliavinio barito grynumas ir tankis turi būti minimalūs. Mineralas, kuris naudojamas kaip užpildas, sumalamas ir sijojamas iki vienodo dydžio, kad bent 97 % jo dalelių būtų iki 75 mikronų dydžio, o ne daugiau kaip 30 % – mažesnės nei 6 mikronai. Pirminis baritas taip pat turi būti pakankamai tankus, kad jo savitasis svoris būtų 4,2 g/cm3 ar didesnis, bet pakankamai minkštas, kad nepažeistų guolių.
Chemiškai gryno produkto gavimas
Mineralinis baritas dažnai yra užterštas įvairiomis priemaišomis, daugiausia geležies oksidais, kurie jį nuspalvina įvairiomis spalvomis. Jis apdorojamas karboterminiu būdu (kaitinamas koksu). Rezultatas yra bario sulfidas.
BaSO 4 + 4 C → BaS + 4 CO
Pastarasis, skirtingai nei sulfatas, tirpsta vandenyje ir lengvai reaguoja su deguonimi, halogenais ir rūgštimis.
BaS + H 2 SO 4 → BaSO 4 + H 2 S
Sieros rūgštis naudojama didelio grynumo galutiniam produktui gauti. Šio proceso metu susidaręs bario sulfatas dažnai vadinamas blancfix, o tai prancūziškai reiškia „baltas fiksuotas“. Jis dažnai randamas plataus vartojimo produktuose, pavyzdžiui, dažuose.

Laboratorinėmis sąlygomis bario sulfatas susidaro tirpale sujungiant bario ir sulfato jonus (žr. aukščiau). Kadangi sulfatas yra mažiausiai toksiška bario druska dėl savo netirpumo, atliekos, kuriose yra kitų bario druskų, kartais apdorojamos natrio sulfatu, kad būtų surištas visas baris, kuris yra gana toksiškas.
Nuo sulfato iki hidroksido ir atgal
Istoriškai baritas buvo naudojamas gaminant bario hidroksidą, Ba(OH) 2 , reikalingą cukraus rafinavimui. Paprastai tai labai įdomus ir pramonėje plačiai naudojamas junginys. Jis gerai tirpsta vandenyje, sudarydamas tirpalą, žinomą kaip barito vanduo. Patogu naudoti įvairių kompozicijų sulfato jonams surišti, susidarant netirpiam BaSO 4 .
Aukščiau matėme, kad kaitinant esant koksui, iš sulfato nesunku gauti vandenyje tirpaus bario sulfido - BaS. Pastarasis, sąveikaudamas su karštu vandeniu, sudaro hidroksidą.
BaS + 2H 2 O → Ba(OH) 2 + H 2 S
Bario hidroksidas ir natrio sulfatas, paimti į tirpalus, sumaišius, sudarys netirpias bario sulfato ir natrio hidroksido nuosėdas.
Ba(OH) 2 + Na 2 SO 4 = BaSO 4 + 2NaOH

Pasirodo, kad natūralus bario sulfatas (baritas) pirmiausia pramoniniu būdu paverčiamas bario hidroksidu, o vėliau naudojamas tam pačiam sulfatui gauti valant įvairias druskų sistemas nuo sulfato jonų. Lygiai taip pat reakcija vyks ir valant SO 4 2- jonus iš vario sulfato tirpalo. Jei darote mišinį „bario hidroksidas + vario sulfatas“, gaunamas vario hidroksidas ir netirpus bario sulfatas.
CuSO 4 + Ba(OH) 2 → Cu(OH) 2 + BaSO 4 ↓
Netgi reaguojant su pačia sieros rūgštimi, jos sulfato jonai bus visiškai surišti bario.
Naudoti gręžimo skysčiuose
Apie 80% pasaulyje pagaminamo bario sulfato, išgryninto ir sumalto barito, sunaudojama kaip gręžimo skysčių sudedamoji dalis kuriant naftos ir dujų gręžinius. Jo pridėjimas padidina į šulinį įpurškamo skysčio tankį, kad būtų geriau atsparus aukštam rezervuaro slėgiui ir išvengta išsiveržimų.
Kai gręžiamas gręžinys, antgalis praeina per įvairius darinius, kurių kiekvienas turi savo ypatybes. Kuo didesnis gylis, tuo didesnis barito procentas turi būti tirpalo struktūroje. Papildomas privalumas – bario sulfatas yra nemagnetinė medžiaga, todėl netrukdo įvairiems gręžinių matavimams naudojant elektroninius prietaisus.
Dažų ir popieriaus pramonė
Didžioji dalis sintetinio BaSO 4 yra naudojama kaip baltojo dažų pigmento komponentas. Taigi, blancfix sumaišytas su titano dioksidu (TiO 2) parduodamas kaip balti aliejiniai dažai, naudojami tapyboje.
BaSO 4 ir ZnS (cinko sulfido) derinys suteikia neorganinį pigmentą, vadinamą litoponu. Jis naudojamas kaip tam tikrų rūšių fotopopieriaus danga.
Visai neseniai bario sulfatas buvo naudojamas rašaliniams spausdintuvams skirto popieriaus šviesinimui.
Taikymas chemijos pramonėje ir spalvotųjų metalų metalurgijoje
Gaminant polipropileną ir polistireną BaSO 4 kaip užpildas naudojamas proporcijomis iki 70 proc. Tai padidina plastikų atsparumą rūgštims ir šarmams, taip pat suteikia jiems neskaidrumą.

Jis taip pat naudojamas gaminant kitus bario junginius, ypač bario karbonatą, iš kurio gaminamas LED stiklas televizoriams ir kompiuterių ekranams (istoriškai – katodinių spindulių vamzdeliuose).
Metalo liejimui naudojamos formos dažnai padengiamos bario sulfatu, kad būtų išvengta sukibimo su išlydytu metalu. Tai daroma gaminant anodo vario plokštes. Jie liejami į varines formas, padengtas bario sulfato sluoksniu. Kai skystas varis sukietėja į gatavą anodo plokštę, jį galima lengvai išimti iš formos.
pirotechnikos prietaisai
Kadangi degdami bario junginiai skleidžia žalią šviesą, pirotechnikos formulėse dažnai naudojamos šios medžiagos druskos. Nors nitratas ir chloratas yra labiau paplitę nei sulfatas, pastarasis plačiai naudojamas kaip pirotechninių blyksčių lempų komponentas.
Rentgeno kontrastinė medžiaga
Bario sulfatas yra radioaktyvus agentas, naudojamas tam tikroms medicininėms problemoms diagnozuoti. Kadangi tokios medžiagos yra nepermatomos rentgeno spinduliams (blokuoja jas dėl didelio tankio), kūno sritys, kuriose jos yra, rentgeno juostoje atrodo kaip balti plotai. Tai sukuria reikiamą skirtumą tarp vieno (diagnozuoto) organo ir kitų (aplinkinių) audinių. Kontrastas padės gydytojui pamatyti visas ypatingas sąlygas, kurios gali egzistuoti tame organe ar kūno dalyje.

Bario sulfatas vartojamas per burną arba į tiesiąją žarną su klizma. Pirmuoju atveju stemplė, skrandis ar plonoji žarna tampa nepermatoma rentgeno spinduliams. Taigi juos galima fotografuoti. Jei medžiaga suleidžiama su klizma, tada storoji žarna ar žarnos gali būti matomos ir fiksuojamos rentgeno spinduliais.
Bario sulfato dozė skirtingiems pacientams bus skirtinga, viskas priklauso nuo tyrimo tipo. Vaistas tiekiamas specialios medicininės bario suspensijos arba tablečių pavidalu. Skirtingiems tyrimams, kuriems reikalinga kontrastinė ir rentgeno įranga, reikia skirtingų suspensijos kiekių (kai kuriais atvejais būtinas vaistas tablečių pavidalu). Kontrastinė medžiaga turi būti naudojama tik tiesiogiai prižiūrint gydytojui.
BARIO JUNGINIAI, atsižvelgiant į bario padėtį Mendelejevo sistemos II grupės šarminių žemių pogrupyje, turi dvigubai įkrautą joną Ba ∙∙ (išskyrus bario peroksidą BaO 2). Bario junginiams būdingas didelis savitasis tankis, bespalvis anijonai, jei anijonai nėra spalvoti, liepsnos žalia spalva ir nedidelis kompleksinių junginių kiekis. Techniškai svarbiausi yra oksidai ir peroksidas, netirpios druskos: bario karbonatas, sulfatas ir chromo rūgštis bei tirpios druskos: bario nitratas, bario chloridas ir kt. Tirpios bario druskos yra nuodingos. Kiekybiškai baris nustatomas BaSO 4 pavidalu, tačiau, atsižvelgiant į itin didelį žemoje temperatūroje gaunamų nuosėdų smulkumą, būtina nusodinti iš verdančio tirpalo, šiek tiek parūgštinto druskos rūgštimi. Jei tirpale yra azoto rūgšties, dalis nuosėdų patenka į tirpalą. Be to, BaSO 4 nuosėdos gali nunešti dalį druskų dėl adsorbcijos. Norint atskirti nuo stroncio, baris nusodinamas kaip BaSiF 6 . Jei bario junginiai yra netirpūs, tada jie sulydomi su kalio karbonatu-natriu ir, išplovus lydinį vandeniu, ištirpinami rūgštyje. Bario junginiai dažniausiai randami kaip mineralinis baritas; daug rečiau paplitęs oneritas – bario karbonatas.
Bario oksidas BaO- balta kieta medžiaga, kristalizuojasi kubeliais, tankis 5,72-5,32, lydymosi temperatūra 1580 °, sudaro kristalinį hidratą pagal formulę:
BaO + 9H 2 O \u003d Ba (OH) 2 ∙ 8H 2 O.
Bario oksidas gana gerai tirpsta: esant 0 ° - 1,5 val. 100 valandų vandenyje; 10° - 2,2 val., 15° - 2,89 val., 20° - 3,48 val., 50° - 11,75 val., 80° - 90,77 val.. Bario oksidas gaunamas iš bario nitrato deginimo būdu; taip gaunamas akytas produktas, tinkamas iš jo gaminti peroksidą. Kaitinama tigliuose, mufelinėje krosnyje, iš pradžių labai atsargiai, kad tigliai nesprogtų. Azoto oksidų išsiskyrimas prasideda po 4 valandų, tačiau galutiniam jų pašalinimui tigliai kelias valandas kaitinami balta ugnimi (azoto rūgščiai gauti galima panaudoti 30 % azoto oksidų). Produktas labai brangus, nes brangus: pradinė medžiaga, tik vieną kartą tinkami tigliai, kuras ir kt. Išgauti bario oksidą iš viterio (BaCO 3 \u003d BaO + CO 2) yra daug sunkiau nei deginti kalkes, t. atvirkštinis CO 2 pridėjimas vyksta labai lengvai; todėl anglis sumaišoma su vyteritu, todėl CO 2 pereina į CO. Jei norima gauti porėtą gaminį, tuomet būtina griežtai laikytis degimo temperatūros. Siekiant išvengti sukepinimo, dažnai pridedama bario nitrato, akmens anglių, dervos ar bario karbido, t.y.
ВаСО 3 + Ba(NO 3) 2 + 2С = 2ВаО + 2NO 2 + 3СО
ЗВаСО 3 + ВаС 2 = 4ВаО + 5СО.
Be to, būtina kuo labiau apsaugoti gaminį nuo sukepinimo su tiglio sienelėmis ir nuo karštų dujų poveikio. Deginant šachtinėse krosnyse gaunamas labai grynas produktas (95%), jei krosnis pastatyta iš aukštos kokybės medžiagų ir kaitinama generatorinėmis dujomis, kas leidžia tiksliai kontroliuoti temperatūrą. Italijoje naudojamas kaitinimas elektrinėse krosnyse, tačiau, matyt, taip susidaro „oksikarbidas“ ir „baris“, kuriuose, be 80–85 % bario oksido, yra 10–12 % karbido ir 3–5 % bario cianido.
Vandeninis bario oksidas, šarminis baritas Ba (OH) 2 , formuoja skaidrius monoklininius kristalus
Va (OH) 2 ∙ 8H 2 0,
netenkama paskutinės vandens molekulės tik esant tamsiai raudonam karščiui; su šviesiai raudona šiluma gaunamas BaO, o oro srove kaitinant – bario peroksidas. Šarminio bario – stipraus šarmo – tirpalas sugeria CO 2 iš oro, sudarydamas netirpus CaCO 3. 100 g tirpalo yra: 0 ° - 1,48 g BaO, 10 ° - 2,17, 15 ° - 2,89, 20 ° - 3,36, 50 ° - 10,5, 80 ° - 4,76. Kaustinis baritas naudojamas CO 2 sugerti, šarminiams šarmams iš sulfatų išgauti, cukrui iš melasos išgauti ir kt. Kaustinį baritą galima gauti kalcinuojant viteritą praleidžiant vandens garus, bet lengviau sudegina BaCO 3 ir veikia BaO su vandeniu; arba 60 % BaO ir 40 % BaS mišinys, gautas kalcinuojant BaSO 4 anglimi, ištirpinamas vandenyje, o Ba (OH) 2 gaunamas ne tik iš BaO, bet ir iš nemažos dalies BaS dėl hidrolizės:
2BaS + 2HOH = Ba(OH)2 + Ba(SH)2.
Išsikristalizavusioje medžiagoje yra tik 1% priemaišų. Senieji geležies arba cinko oksidų įdėjimo į BaS metodai nebenaudojami. Taip pat siūloma šarminį baritą gauti elektrolizės būdu iš bario chlorido arba bario chlorato ir perchlorato, esant BaCO 3 nuosėdoms, kurios ištirpsta prie anodo susidariusios rūgšties.
Bario peroksidas BaO 2 - balti, perlamutriniai smulkiausių kristalų ataugimai, labai mažai tirpūs vandenyje (100 val. vandenyje tik 0,168 val.). Peroksidui gauti bario oksidas kaitinamas pasvirusiuose vamzdeliuose arba specialiuose mufeliuose, kuriuos galima tiksliai palaikyti norimoje temperatūroje (500-600°), įpučiamas nuo CO 2 ir drėgmės išvalytas oras. Gryniausias peroksidas gaunamas kvadratinių BaO 2 ∙ 8H 2 O kristalų pavidalu, kurių techninis peroksidas pirmiausia sutrinamas su vandeniu, perpilamas į tirpalą, pridedant silpnos druskos rūgšties ir nusodinamas kaustinio barito tirpalu arba tiesiog pridedama. 10 kartų daugiau 8% barito tirpalo. Gryniausias peroksidas yra pilkšvai žalsva sukepinta masė, netirpi vandenyje, bet sąveikaujanti su anglies dioksido anhidridu. Kaitinamas, BaO 2 skyla į BaO ir deguonį. Deguonies elastingumas virš BaO 2 esant 555 ° - 25 mm, esant 790 ° - 670 mm. Peroksido milteliai gali uždegti pluoštines medžiagas. Parduodamos: geriausios klasės - su 90% BaO 2 ir vidutinės - su 80-85%, kurių pagrindinė priemaiša yra BaO. BaO 2 kiekis nustatomas titruojant 1/10 N-osios KMnO 4 BaO 2 tirpalu labai silpnoje šaltoje druskos rūgštyje (savitasis tankis 1,01-1,05), prieš tai nusodinus bario jonus su silpna sieros rūgštimi. Taip pat iš kalio jodido išskirtą bario peroksidą galima titruoti natrio jodido sulfatu. Bario peroksidas naudojamas vandenilio peroksidui gaminti (o kartu ir stipresniam balinimui „blancfix“) bei dezinfekavimo priemonėms ruošti.
Bario nitritas Ba (NO 2) 2 ∙ H 2 O - šešiakampės bespalvės šešiakampės prizmės, lydymosi temperatūra 220°. 0 ° temperatūroje 100 valandų vandenyje ištirpsta 58 val., 35 ° - 97 val.. Gaunamas į 360 val. vandens mišinį įpylus natrio nitrito tirpalo (360 val. 96 % NaNO 2 1000 val. vandenyje). valandų NaNO 2 ir 610 valandų BaCl 2 . Aukštoje temperatūroje NaCl kristalizuojasi, toliau aušinant - Ba (NO 2) 2.
Bario nitratas Ba (NO 3) 2 - bespalviai skaidrūs oktaedrai, lydosi 375°; 100 valandų vandenyje jie tirpsta 10 ° - 7 val., 20 ° - 9,2 val., 100 ° - 32,2 val.. Kaitinant pirmiausia pereina į bario nitritą, o po to į bario oksidą. Jis naudojamas: 1) bario peroksidui ruošti, 2) žaliai fejerverkų lemputei, 3) kai kurioms sprogstamosioms medžiagoms. Jis gaunamas: 1) keičiantis skaidymui, kai į karštą bario chlorido tirpalą (30 ° V) įpilamas teorinis kiekis natrio nitrato ir vėliau perkristalizuojamas, 2) sąveikaujant witeritui arba bario sulfidui su azoto rūgštimi, 3) kaitinant kalcio nitratą su techniniu bario karbonatu.
Bario permanganatas - mangano žalumynai, Kaselio žalumynai, rozenstielio žalumynai. BaMnO 4 - patvarūs žali dažai, tinkami freskų tapybai; gaunamas deginant bario (kaustinio barito, bario nitrato arba bario peroksido) ir mangano (dioksido arba oksido) junginių mišinį.
Bario sulfidas BaS - pilkšvos porėtos masės, lengvai oksiduojasi ir pritraukia angliarūgštės anhidridą bei vandenį; suyra su vandeniu. Jis naudojamas daugumos bario junginių gamybai (litoponas, stiprus balinimas ir kt.), cukrui išgauti iš melasos ir kirpti vilną nuo odos (depiliatorius). Kasybai jie naudoja sunkiųjų špatų mišinio su anglimi deginimą 600–800 ° temperatūroje:
BaSO 4 + 2C = 2CO 2 + BaS,
o aukštesnėje temperatūroje anglies iššvaistoma dvigubai daugiau. Pagrindinė sąlyga yra glaudus anglies ir sparno kontaktas, kuris pasiekiamas sumalant špatą su 30-37% anglies ir vandens besisukančiose malūnuose. Krosnys kūrenamos rotacinėse krosnyse, pvz., naudojamose cemento ar sodos gamybai, su dulkėta kamera už trumpų krosnių dūmams ir suodžiams nusodinti. Gautame produkte yra 60-70% vandenyje tirpių medžiagų, 20-25% - tirpių rūgštyse ir 5% likučių. Gautas produktas karštas metamas į vandenį arba į vandeninį 1-2% NaOH tirpalą (36 °B), kur pusė patenka į vandeninį oksidą Ba (OH) 2, o kita į vandeninį sierą Ba (SH) 2. Šis tirpalas tiesiogiai naudojamas bario junginių (litopono ir kt.) gamybai arba cukraus ekstrahavimui. Kai liekana reaguoja su druskos rūgštimi, gaunamas bario chloridas. Seno tipo gamyklose deginimas atliekamas šamotinėse retortose, tolygiai padengtose liepsna. Į retortas kraunamos gerai išdžiovintos akmens anglių ir špatų plokštės, sumaišytos su vandeniu. Kai tik dingsta degančio anglies monoksido liepsnos, plokštės nuimamos taip, kad patenka į hermetiškai uždarytas geležines dėžes.
Bario sulfatas BaS 2 O 3 ∙ H 2 O Jis susidaro iš bario sulfido: 1) laisvai patenkant į orą ir 2) keičiantis skaidymui su natrio sulfatu. Jis naudojamas titrams nustatyti jodometrijos metu.
Bario sulfatas BaSO 4 , sunkus špagatas („stiprus“, „mineralinis“, „naujas“ ir tt balinimas), grynai balti, žemiški, labai sunkūs milteliai, praktiškai netirpūs vandenyje ir rūgštyse (tirpumas: 18 ° temperatūroje 1 litre vandens - 2 . 3 mg). Natūralus sumalkite tiesiogiai. Geriausios bespalvės veislės vadinamos "gėlių" špagatais; ultramarinas pridedamas prie gelsvos ir rausvos spalvos. Kartais sunkus sparnas sumalamas ir kaitinamas druskos rūgštimi, kad pašalintų geležį; arba sparnas sulydomas su Na 2 SO 4 ir atskiriamas nuo lydinio veikiant vandeniui. Dirbtinai jis gaunamas: 1) kaip atliekos ruošiant vandenilio peroksidą; 2) iš bario chlorido sąveikaujant: a) su sieros rūgštimi, kuri duoda greitai nusėdančias nuosėdas, b) su natrio sulfidu Na 2 SO 4 arba su magnio sulfido druska MgSO 4, kuri duoda lėtai krintančius ir aukštai dengiančius miltelius; gamybos metu svarbu švariai išvalyti sieros rūgštį; 3) iš vyterio; jei jis labai grynas, jį galima sumalti tiesiogiai veikiant H 2 SO 4 , bet pridedant 2 % HCl; jei witerite yra priemaišų, jis pirmiausia ištirpinamas druskos rūgštyje ir tada nusodinamas. Bario sulfatą naudoja Ch. arr. tapetų dažymui spalvotam popieriui, kartonui ir ypač fotopopieriui, šviesiems aliejiniams ir lakiniams dažams iš anglies, dirbtinio dramblio kaulo ir gumos gamyboje, maišymui su maistu, patenkančiu į skrandį rentgenografijos metu.
Bario karbonatas BaCO 3 - mineralinis viteritas (rombiniai kristalai) arba dirbtinai gautas mažiausių nuosėdų pavidalu (savitasis tankis 4.3); sunkiau disocijuoti kalcinuojant nei CaCO 3; esant 1100° CO 2 slėgiui yra tik 20 mm. Jis naudojamas kitiems bario junginiams išgauti, plytų ir terakotos, porceliano, dirbtinio marmuro ir barito kristalų gamyboje. Jis dirbtinai gaminamas: 1) iš neapdoroto bario sulfido tirpalo, įpurškiant karboanhidridą; 2) bario sulfato kaitinimas su kaliu 5 atm slėgyje; 3) bario sacharatui skaidant anglies anhidridu.
Bario acetatas Ba (C 2 H 3 O 2) 2 ∙ H 2 O - lengvai tirpstantys kristalai, naudojami dažymui; susidaro sąveikaujant natrio sulfidui arba karbonatui su acto rūgštimi.
Bario fluoridas BaF 2 - balti milteliai, šiek tiek tirpūs vandenyje, lydosi 1280° temperatūroje, gaunami bario karbonatą arba šarmą ištirpinant HF arba verdant kriolitą su vandeniniu bario oksidu.
Bario chloridas l 2∙ 2Н 2O- bespalvės plokščios rombinės plokštelės (savitasis svoris 3,05), stabilios ore, rūgštaus skonio, nuodingos; kaitinant palyginti lengva prarasti pirmąją vandens dalelę, o antrąją – daug sunkiau; bevandenis BaCl 2 dešinėje. sistema tirpsta 962°. 100 valandų tirpalo yra bevandenės druskos:
ВаСl 2 naudojamas „tvariam“ baltumui gaminti ir keramikos gaminiuose esančiam vitrioliui paversti netirpiu BaSO 4; jis išgaunamas iš barito kalcinuojant anglimi ir kalcio chloridu sodos krosnyse 900-1000 ° temperatūroje redukuojančioje liepsnoje, taip pat galima naudoti 70% kalcio chlorido tirpalą, bet geriau kietas kalcio chloridas:
BaSO 4 + 4C \u003d BaS + 4CO;
BaS + SaSl 2 \u003d TUl 2 + CaS.
Tinkamai pagaminus, gaunamas beveik juodas akytas produktas su 50-56% BaCl 2. Po sistemingo išplovimo druska kristalizuojama (anksčiau perleidžiama anglies rūgšties anhidrido srove), kol vandenilio sulfidas visiškai pašalinamas ir išgarinamas viduje lakuotuose induose. Kristalai atskiriami centrifuguojant. Jei reikia bevandenio BaCl 2, tuomet druska kaitinama induose su maišyklėmis, kad susidarytų labai maži kristalai, kurie vėliau kalcinuojami ir gaunama 95 % BaCl 2. BaCl 2 galima gauti uždarytuose induose į druskos rūgštį pridedant BaS miltelių, iš kurių reikia pašalinti išskyrusį sieros vandenilį į gamyklos vamzdį arba sudeginti iki SO 2, pastarąjį panaudojant sieros rūgščiai. Žinoma, daug naudingiau BaCO 3 veikti su druskos rūgštimi.
Bario chloratas Ba (C lO 3) 2 ∙ H 2O- monoklininės prizmės, gerai tirpsta šaltame ir dar geriau karštame vandenyje. Lengvai sprogsta kaitinant ir nuo smūgio, jei susimaišo su degiomis medžiagomis. Jis naudojamas pirotechnikoje žaliai liepsnai. Jis gaunamas elektrolizės būdu 75° temperatūroje prisotintą BaCl 2 tirpalą su platinos anodu ir grafito katodu.
BARIJAS (lot. Barium), Ba, periodinės sistemos trumposios formos II grupės (2 ilgosios formos grupės) cheminis elementas; reiškia šarminių žemių metalus; atominis skaičius 56, atominė masė 137,327. Gamtoje yra 7 stabilūs nuklidai, tarp kurių vyrauja 138 Ba (71,7%); dirbtinai gauta apie 30 nuklidų.
Istorijos nuoroda. Barį oksido pavidalu 1774 metais atrado K. Scheele, atradęs anksčiau nežinomą „žemę“, vėliau pavadintą „sunkiąja žeme“ – baritu (iš graikų βαρ?ς – sunkioji). 1808 metais G. Davy išlydytų druskų elektrolizės būdu gavo metalinį barį amalgamos pavidalu.
Paplitimas gamtoje. Bario kiekis žemės plutoje yra 5·10 -2 % masės. Dėl didelio cheminio aktyvumo jis neatsiranda laisvos formos. Pagrindiniai mineralai yra baritas BaSO 4 ir viteritas BaSO 3 . Pasaulyje BaSO 4 pagaminama apie 6 mln. tonų per metus.
Savybės. Bario atomo išorinio elektroninio apvalkalo konfigūracija yra 6s 2 ; junginiuose jo oksidacijos būsena yra +2, retai +1; Paulingo elektronegatyvumas 0,89; atomo spindulys yra 217,3 nm, Ba 2+ jono spindulys yra 149 pm (koordinacijos numeris 6). Jonizacijos energija Ba 0 → Ba + → Ba 2+ 502,8 ir 965,1 kJ / mol. Ba 2+ / Ba poros standartinis elektrodo potencialas vandeniniame tirpale yra -2,906 V.
Baris yra sidabriškai baltas kalusis metalas; t pl 729 °С, t ΚИΠ 1637 °С. Esant normaliam slėgiui, bario kristalinė gardelė yra į kūną orientuota kubinė; esant 19 °C ir 5530 MPa, susidaro šešiakampė modifikacija. 293 K temperatūroje bario tankis 3594 kg/m 3, šilumos laidumas 18,4 W/(m·K), elektrinė varža 5·10 -7 Ohm·m. Baris yra paramagnetinis; savitasis magnetinis jautrumas 1,9·10 -9 m 3 /kg.
Bario metalas greitai oksiduojasi ore; jis laikomas žibale arba po parafino sluoksniu. Baris normalioje temperatūroje reaguoja su deguonimi, sudarydamas bario oksidą BaO ir su halogenais, sudarydamas halogenidus. Deguonies arba oro sraute 500 ° C temperatūroje deginant BaO, gaunamas peroksidas BaO 2 (800 ° C temperatūroje skyla į BaO). Reakcijoms su azotu ir vandeniliu reikia kaitinti; reakcijos produktai yra Ba 3 N 2 nitridas ir BaH 2 hidridas. Baris reaguoja su vandens garais net šaltyje; stipriai tirpsta vandenyje, todėl susidaro šarminių savybių turintis hidroksidas Ba (OH) 2. Baris sudaro druskas su praskiestomis rūgštimis. Iš plačiausiai naudojamų bario druskų, tirpstančių vandenyje: chloridas BaCl 2 ir kiti halogenidai, nitratas Ba (NO 3) 2, chloratas Ba (ClO 3) 2, acetatas Ba (OOCH 3) 2, sulfidas BaS; blogai tirpus - sulfatas BaS0 4, karbonatas BaCO 3, chromatas BaCrO 4. Baris redukuoja daugelio metalų oksidus, halogenidus ir sulfidus iki atitinkamo metalo. Baris sudaro lydinius su dauguma metalų, kartais lydiniuose yra intermetalinių junginių. Taigi, BaAl, BaAl 2, BaAl 4 buvo rasti Ba-Al sistemoje.
Tirpios bario druskos yra toksiškos; praktiškai netoksiškas BaSO 4 .
Kvitas. Pagrindinė bario gamybos žaliava yra barito koncentratas (80-95%) BaSO 4 , kuris redukuojamas anglimi, koksu arba gamtinėmis degiosiomis dujomis; gautas bario sulfidas perdirbamas į kitas šio elemento druskas. Deginant bario junginius, gaunamas BaO. Komerciniu požiūriu grynas metalinis baris (96-98 % masės) gaunamas termiškai redukuojant BaO oksidą Al milteliais. Distiliuojant vakuume baris išvalomas iki mažiau nei 10-4% priemaišų, zoniniu lydymu - iki 10-6%. Kitas būdas gauti barį iš BaO yra oksido lydalo elektrolizė. Nedideli bario kiekiai gaunami redukuojant berilatą BaBeO 2 1300 °C temperatūroje titanu.
Taikymas. Baris naudojamas kaip vario ir švino deoksidatorius, kaip antifrikcinių lydinių, juodųjų ir spalvotųjų metalų, taip pat lydinių, naudojamų tipografinių šriftų gamybai, priedas, siekiant padidinti jų kietumą. Bario-nikelio lydiniai naudojami vidaus degimo variklių ir radijo vamzdžių uždegimo žvakių elektrodams gaminti. Bario ir aliuminio lydinys - alba, kuriame yra 56% Ba, geterių pagrindas. Bario metalas - medžiaga anodams cheminiuose srovės šaltiniuose. Daugumos termioninių katodų aktyvioji dalis yra bario oksidas. Bario peroksidas naudojamas kaip oksidatorius, baliklis, pirotechnikoje; anksčiau jis buvo naudojamas deguoniui regeneruoti iš CO 2 . Bario heksaferitas BaFe 12 O 19 yra perspektyvi medžiaga, skirta naudoti informacijos saugojimo įrenginiuose; BaFe 12 O 19 naudojamas nuolatiniams magnetams gaminti. BaSO 4 patenka į gręžimo skysčius naftos ir dujų gavybos metu. Bario titanatas BaTiO 3 yra vienas iš svarbiausių feroelektrikų. Nuklidas 140 Va (β-emiteris, T 1/2 12,8 paros) yra izotopų žymeklis, naudojamas bario junginiams tirti. Kadangi bario junginiai gerai sugeria rentgeno spindulius ir γ spinduliuotę, jie yra įtraukiami į rentgeno įrenginių ir branduolinių reaktorių apsaugines medžiagas. BaSO 4 naudojamas kaip kontrastinė medžiaga virškinamojo trakto rentgeno tyrimams.
Lit. : Akhmetov TG Bario junginių chemija ir technologija. M., 1974; Tretjakovas Yu.D. ir tt Neorganinė chemija. M., 2001 m.
D. D. Zaicevas, Yu. D. Tretjakovas.
1808 m. Davy Humphrey gavo barį amalgamos pavidalu elektrolizės būdu.
Kvitas:
Gamtoje jis sudaro mineralus baritą BaSO 4 ir vyteritą BaCO 3 . Gaunamas aliuminotermijos arba azido skaidymo būdu:
3BaO+2Al=Al 2O 3 +3Ba
Ba(N 3) 2 \u003d Ba + 3N 2
Fizinės savybės:
Sidabriškai baltas metalas, turintis aukštesnę lydymosi ir virimo temperatūrą bei didesnį tankį nei šarminių metalų. Labai minkštas. Tm = 727°C.
Cheminės savybės:
Baris yra stipriausias reduktorius. Ore greitai pasidengia oksido, peroksido ir bario nitrido plėvele, užsidega kaitinant arba tiesiog susmulkinus. Energingai sąveikauja su halogenais, kai kaitinama su vandeniliu ir siera.
Baris intensyviai reaguoja su vandeniu ir rūgštimis. Laikyti, kaip ir šarminius metalus, žibale.
Junginiuose jo oksidacijos laipsnis yra +2.
Svarbiausios jungtys:
bario oksidas. Kieta medžiaga, kuri intensyviai reaguoja su vandeniu, sudarydama hidroksidą. Sugeria anglies dioksidą, virsdamas karbonatu. Kaitinamas iki 500 ° C, jis reaguoja su deguonimi ir susidaro peroksidas
bario peroksidas BaO 2, balta medžiaga, blogai tirpus, oksidatorius. Naudojamas pirotechnikoje, vandenilio peroksidui gaminti, balikliui.
bario hidroksidas Ba(OH) 2, Ba(OH) 2 oktahidratas *8H 2 O, bespalvis. kristalas, šarmas. Naudojamas sulfatų ir karbonatų jonams aptikti, augaliniams ir gyvuliniams riebalams valyti.
bario druskos bespalviai kristalai. medžiagų. Tirpios druskos yra labai toksiškos.
Chloridas baris gaunamas sąveikaujant bario sulfatui su akmens anglimi ir kalcio chloridu 800°C – 1100°C temperatūroje. Reagentas sulfato jonams. naudojamas odos pramonėje.
Nitratas baris, bario nitratas, žaliųjų pirotechnikos kompozicijų komponentas. Kaitinamas, jis suyra ir susidaro bario oksidas.
Sulfatas baris praktiškai netirpsta vandenyje ir rūgštyse, todėl yra šiek tiek toksiškas. naudojamas popieriui balinti, fluoroskopijai, baritinio betono užpildas (apsauga nuo radioaktyviosios spinduliuotės).
Taikymas:
Bario metalas naudojamas kaip daugelio lydinių komponentas, deoksidatorius vario ir švino gamyboje. Tirpios bario druskos yra nuodingos, MPC 0,5 mg/m 3 . Taip pat žiūrėkite:
S.I. Venetsky Apie retą ir išsibarsčiusį. Metalo istorijos.