Lantanas (Lanthanum, La) yra cheminis elementas, esantis periodinėje lentelėje 57 numeriu.
Ypatingą vietą tarp cheminių elementų užima ši „šeima“, kurią tarpusavyje sieja išskirtinis savybių panašumas. Pasenęs jų pavadinimas yra retųjų žemių elementai (REE). Susidomėjimas jais gerokai išaugo pradėjus veikti pirmiesiems atominiams reaktoriams, kurių veikimo metu šie elementai susidaro kaip šalutiniai produktai.
Šis elementas labai ilgą laiką buvo slepiamas nuo smalsių chemikų, todėl gavo pavadinimą lantanas ("lantano" graikiškai "slepiu", "paslėptas"). Jį 1839 m. atrado švedų chemikas Mozanderis. Lantanas jau daugiau nei šimtą metų buvo sunkiai pasiekiamas elementas ne tik pramonei, bet ir chemijos laboratorijai. Gryna forma lantanas (ir jo junginiai) buvo gautas tik po to, kai vadinamoji chromatografinė analizė, kurią 1903 m. sukūrė rusų mokslininkas M. S. Tsvet, tvirtai pateko į laboratorijų ir pramonės įmonių praktiką.
Šio metodo esmė bendrais bruožais yra tokia. Tiriamasis tirpalas perleidžiamas per mėgintuvėlį, užpildytą bespalviais milteliais arba smulkiagrūde medžiaga, kuri savo paviršiuje gali sulaikyti (adsorbuoti) kitų medžiagų daleles.
Į mišinį įtrauktos medžiagos, priklausomai nuo jų adsorbcijos laipsnio absorberio (adsorbento) paviršiuje, vamzdyje (stulpelyje) bus skirtinguose jo aukščio lygiuose. Jei tirpalas susideda iš spalvotų medžiagų mišinio (su tokiais tirpalais dirbo MS Tsvet vienu metu), tai dėl skirtingo adsorbavimo jie išlaikomi skirtingose adsorbento dalyse, nuspalvindami jį atitinkamą medžiagą atitinkančia spalva. .
Taigi mišinio sudedamosios dalys yra atskirtos. Adsorbento masė per visą vamzdelio ilgį, atsižvelgiant į sulaikytos medžiagos spalvą, bus skirtingų spalvų arba skirtingų tos pačios spalvos atspalvių (priklausomai nuo mišinio sudedamųjų dalių spalvų). Gautas spalvoto adsorbento stulpelis vadinamas chromatograma (iš graikų kalbos „chromas“ – dažai, spalva ir „grafo“ – rašau). Norint atskirti mišinio komponentus, adsorbento kolonėlė atsargiai pašalinama iš mėgintuvėlio ir padalinama į spalvų zonas. Kiekvienos spalvotos zonos sudėtis nustatoma įprastiniais cheminės analizės metodais. Visiškai aišku, kad analizė nesukelia sunkumų, kai kiekvienoje zonoje yra tik viena medžiaga. Tačiau dažniausiai spalvoto adsorbento zonos nesiskiria viena nuo kitos taip smarkiai, kad jas būtų galima nesunkiai atskirti mechaniškai. Paprastai zonos sujungiamos ir palaipsniui pereina viena į kitą. Tokiais atvejais vamzdelis, kuriame yra adsorbentas su jame esančiomis medžiagomis, plaunamas specialiai parinktu tirpikliu, kuris skiriasi nuo adsorbuotų mišinio sudedamųjų dalių. Toks adsorbuotos medžiagos ištraukimo iš adsorbento būdas vadinamas eliuavimu (iš lot. „elutio“ – plovimas). Eliucija leidžia panaudoti ne tik mišinio sudedamųjų dalių adsorbcijos skirtumą, bet ir jų tirpumą.
Lantanas ir jo junginiai turi labai didelį panašumą su daugeliu kitų elementų, labai panašių į lantaną.
Lantano „giminaičių“ skaičius yra žinomas. Jų yra 14. Iš lantano, kaip labiausiai ištirta, jie visi yra sujungti į vieną grupę, į vieną Mendelejevo sistemos ląstelę lantanidų šeimos pavadinimu.
Didelis lantanidų cheminių savybių panašumas yra susijęs su ypatinga šių elementų atomų elektronų apvalkalo struktūra – nuo lantano iki liutecio imtinai. Ši ypatinga struktūra lemia tai, kad didėjant elemento eilės skaičiui, atomo spindulys nedidėja (lantanido suspaudimas). Šis reiškinys paaiškina tokį didelį cheminį visų lantanidų panašumą.
Išskyrus grynas lantano druskas, gauti paties lantano nebebuvo sunku. Pavyzdžiui, metalas lantanas buvo gautas elektrolizės būdu iš lantano chlorido, kuris savo chemine elgsena primena kalcio metalą. Lantanas savo kietumu panašus į alavo (tankis 6,2), jo lydymosi temperatūra tik 915-925°C, tačiau virimo temperatūra stebėtinai aukšta (4515°C). Kaip ir daugelis aktyvių metalų, jis skaido vandenį, gerai reaguoja su rūgštimis, o stipriai kaitinamas su chloru, siera ir kitais metaloidais, tai yra pasižymi tipiško metalo savybėmis.
Lantanas yra „savaime besisaugantis“ metalas: sausame ore jis pasidengia plona oksido plėvele, kuri apsaugo jį nuo tolesnio oksidacijos. Bet tokia „apsauga“ atsiranda tik sausame ore, drėgmė susijungia su šia plėvele ir sudaro tvirtą pagrindą.
Mes ne kartą minėjome tokį svarbų metalą kaip aliuminis ir ypač atkreipėme dėmesį į jo gebėjimą degti išskiriant didelį šilumos kiekį. Šia reakcija pagrįsta daug įvairių procesų. Lantane mišinio reakcijos su deguonimi šiluma yra dar didesnė. Kai tik jie sužinojo, kaip gauti lantano dideliais kiekiais, jis pradėjo konkuruoti su aliuminiu metalurgijoje. Norint pašalinti deguonį iš skysto plieno, į jį dažnai įpilamas ne aliuminis, o lantanas. Vienai tonai plieno reikia tik vieno kilogramo šio „deoksidatoriaus“, nes technologijoje vadinamos medžiagos, išlaisvinančios plieną iš deguonies. Milijonai tonų plieno jau buvo apdorota tokiu būdu ir sako, kad tai puikus būdas pagerinti jo kokybę.
Lantanas buvo gautas mišinyje su ceriu, kitu lantanidų šeimos nariu, maždaug 1:1 santykiu. Sulydžius šių metalų mišinį su geležimi, jie gavo ... „titnagą“, kuris buvo plačiai naudojamas kišeniniuose žiebtuvėliuose. Žinoma, geležies-cerio-lantano „titnagas“ neturi nieko bendra su natūraliu titnago akmeniu – silicio junginiu. Šis pavadinimas buvo suteiktas lydiniui dėl gebėjimo „kibirkštis“, kai ant jo trina dantytą plieninį ratą. Šis gebėjimas buvo naudojamas ne tik nekenksminguose žiebtuvėliuose, bet ir artilerijos sviediniuose. Parūpinę sviedinį su antgaliu iš šio „mišraus metalo“, gavome galimybę stebėti sviedinį skrendant. „Mišraus metalo“ kibirkštys skrendant ore. Šiuo atveju žiebtuvėlio rato vaidmenį atlieka pats oras, besitrinantis į metalą.
Lantano junginiai naudojami stiklo gamyboje geriausiems fotoaparatų objektyvams ir specialiems apsauginiams akiniams. Lydinyje su magniu lantanas naudojamas orlaivių variklių dalims gaminti.
Įdomu tai, kad pažįstamas augalas mėlynės yra savotiškas lantano „nuosėdas“, kurio pelenuose yra iki 0,17% lantano oksido. Nedidelių Karelijos beržų pelenuose yra daug lantano.
APIBRĖŽIMAS
Lantanas yra periodinės lentelės pagrindinio (A) pogrupio III grupės šeštajame periode.
priklauso šeimai f- elementai. Metalas. Pavadinimas - La. Eilinis skaičius – 57. Santykinė atominė masė – 138,906 a.m.u. Lantanas yra retųjų žemių metalas. Visi jie turi panašią struktūrą, todėl yra suskirstyti į atskirą elementų grupę, kuri vadinama lantanidais.
Lantano atomo elektroninė struktūra
Lantano atomą sudaro teigiamai įkrautas branduolys (+57), kurio viduje yra 57 protonai ir 82 neutronai, o 57 elektronai juda šešiomis orbitomis.
1 pav. Scheminė lantano atomo struktūra.
Elektronų pasiskirstymas orbitose yra toks:
57La) 2) 8) 18) 18) 9) 2 ;
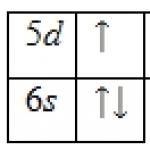
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 0 5s 2 5p 6 5d 1 6s 2 .
Lantano atomo išoriniame energijos lygyje yra 3 elektronai, kurie yra valentiniai. Pagrindinės būsenos energijos diagrama yra tokia:

Lantano atomo valentinius elektronus galima apibūdinti keturių kvantinių skaičių rinkiniu: n(pagrindinis kvantas), l(orbitinė), m l(magnetinis) ir s(suktis):
|
polygis |
||||
Problemų sprendimo pavyzdžiai
1 PAVYZDYS
Svarbiausias dalykas, susijęs su elementu #57, neabejotinai yra tai, kad jis pirmauja tarp 14 lantanidų - elementų, turinčių labai panašias savybes. Lantanas ir lantanidai visada yra kartu: mineraluose, mūsų supratimu, metale. 1900 m. pasaulinėje parodoje Paryžiuje pirmą kartą buvo parodyti kai kurių tariamai grynų lantanidų pavyzdžiai. Bet neabejotina, kad kiekviename mėginyje, nepriklausomai nuo etiketės, buvo lantano, cerio, neodimio su prazeodimiu ir rečiausių iš lantanidų – tulio, holmio, liutecio. Rečiausias, išskyrus „išnykusį“ ir branduolinėse reakcijose atkurtą elementą Nr.61 – prometis. Tačiau jei prometis turėtų stabilių izotopų, jo būtų ir bet kuriame retųjų žemių elemento pavyzdyje.
Tik pastaraisiais dešimtmečiais mokslo ir technologijų raida pasiekė tokį lygį, kuriame žmonija galėjo panaudoti kiekvieno (arba beveik kiekvieno) lantanido individualias savybes, nors, kaip ir anksčiau, viena populiariausių ir pigiausi retųjų žemių gaminiai lieka mischmetal - lantano ir lantanidų "natūralus lydinys"... Todėl būtų logiška tik pusę šios istorijos skirti tiesiogiai elementui Nr.57, o kitą pusę retųjų žemių "komandai" kaip visas *. Žinoma, kiekvienas lantanidas – kaip cheminis individas – nusipelno nepriklausomos istorijos; čia – apie jų „vadą“ ir apie tai, kas jiems visiems bendra.
* Be lantano ir lantanidų, retųjų žemių elementai yra skandis ir itris.
Lantanas be lantanidų
Kad ir kaip būtų liūdna suvokti, mūsų istorijos herojus yra visiškai paprastas žmogus. Tai paprastas metalas savo išvaizda (sidabriškai baltas, padengtas pilkšva oksido plėvele) ir fizinėmis savybėmis: lydymosi temperatūra 920, virimo temperatūra 3469 ° C; pagal stiprumą, kietumą, elektrinį laidumą ir kitas charakteristikas lantano metalas visada atsiduria lentelių viduryje. Lantanas taip pat būdingas cheminėms savybėms. Sausame ore jis nesikeičia – oksido plėvelė patikimai apsaugo nuo oksidacijos urmu. Bet jei oras drėgnas (o įprastomis antžeminėmis sąlygomis beveik visada drėgnas), metalinis lantanas palaipsniui oksiduojasi iki hidroksido. La(OH) 3 yra vidutinio stiprumo pagrindas, kuris vėlgi būdingas „vidutiniam“ metalui.
Ką dar galima pasakyti apie chemines lantano savybes? Deguonyje, kaitinamas iki 450 ° C, jis dega ryškia liepsna (šiuo atveju išsiskiria gana daug šilumos). Jei jis kaitinamas azoto atmosferoje, susidaro juodasis nitridas. Chlore lantanas užsidega kambario temperatūroje, o su bromu ir jodu reaguoja tik kaitinamas. Jis gerai tirpsta mineralinėse rūgštyse, nereaguoja su šarmų tirpalais. Visuose junginiuose lantano valentingumas yra 3+. Žodžiu, metalas yra kaip metalas – tiek fizinėmis, tiek cheminėmis savybėmis.
Galbūt vienintelis skiriamasis lantano bruožas yra jo sąveikos su vandeniliu pobūdis. Reakcija tarp jų prasideda jau kambario temperatūroje ir tęsiasi išsiskiriant šilumai. Susidaro įvairios sudėties hidridai, nes tuo pačiu metu lantanas sugeria vandenilį – kuo intensyviau, tuo aukštesnė temperatūra.
Lantanidai taip pat sąveikauja su vandeniliu. Vienas iš jų, ceris, netgi naudojamas kaip dujų absorberis elektrovakuuminėje pramonėje ir metalurgijoje.
Čia prieinama viena iš svarbių mūsų istorijos dalių, temos „Lantanas ir ceris“, o su ja – lantano istorija.
Pagal paplitimą gamtoje, gamybos mastą ir panaudojimo platumą lantanas yra prastesnis už artimiausią analogą – pirmąjį iš lantanidų. „Protėvis“ ir – amžinai antras, tokia lantano padėtis jo šeimoje. Ir kai retųjų žemių elementai buvo suskirstyti į du pogrupius pagal jų savybių visumą, lantanas buvo priskirtas pogrupiui, kurio pavadinimas buvo suteiktas cerio garbei... O lantanas buvo atrastas po cerio, kaip cerio priemaiša, m. mineralinis ceritas. Tai istorija, mokytojų ir mokinių istorija.
1803 m. 24 metų švedų chemikas Jene Jacob Berzelius kartu su savo mokytoju Hisinger tyrė mineralą, dabar žinomą kaip ceritas. Šį mineralą Gadolinas atrado 1794 m., itrio žemę ir kitą retąją žemę, labai panašią į itrį. Jie pavadino jį ceriumi. Beveik kartu su Berzeliu garsus vokiečių chemikas Martinas Klaprothas atrado cerio žemę.
Berzelius grįžo dirbti su šia medžiaga po daugelio metų, jau būdamas žymus mokslininkas. 1826 m. mokinys, asistentas ir vienas iš artimų Berzelio draugų Karlas Mozanderis, ištyręs cerio žemę, padarė išvadą, kad ji yra nevienalytė, kad, be cerio, joje yra dar vienas, o gal ir ne vienas naujas elementas. Tačiau norint patikrinti šią prielaidą, reikėjo daug cerite. Mozanderiui pavyko įrodyti cerio žemės sudėtingumą tik 1839 m.
Įdomu tai, kad metais anksčiau tarp chemikų nežinomas studentas Erdmannas Norvegijoje rado naują mineralą ir pavadino jį savo mokytojo Mozandro vardu – mosanderitu. Iš šio mineralo taip pat buvo išskirtos dvi retosios žemės – ceris ir nova.
Naujasis elementas, rastas cerite ir mosanderite, Berzelio pasiūlymu buvo pavadintas lantanu. Pavadinimas su užuomina: kilęs iš graikų λανθανειν – pasislėpti, būti pamirštam. Cerite esantis lantanas buvo sėkmingai slepiamas nuo chemikų 36 metus!
Ilgą laiką buvo manoma, kad lantanas yra dvivalentis, kad jis yra kalcio ir kitų šarminių žemių metalų analogas, o jo atominė masė – 90...94. Dėl šių skaičių teisingumo abejonių nekilo iki 1869 m. Mendelejevas pamatė, kad retųjų žemių elementams II periodinės sistemos grupėje nėra vietos ir įtraukė juos į III grupę, lantanui priskirdamas 138...139 atominį svorį. Tačiau tokio žingsnio teisėtumą dar reikėjo įrodyti. Mendelejevas ėmėsi lantano šiluminės talpos tyrimo. Jo gauta vertė tiesiogiai nurodė, kad šis elementas turi būti trivalentis ...
Metalinį lantaną, žinoma, toli gražu ne gryną, pirmą kartą Mosander gavo kaitindamas lantano chloridą su kaliu.
Šiais laikais pramoniniu mastu lantanas gaunamas daugiau nei 99 % grynumo. Stebėsime, kaip tai daroma, bet pirmiausia susipažinsime su pagrindiniais lantano mineralais ir pirmaisiais sudėtingiausio retųjų žemių elementų atskyrimo proceso etapais.
Jau minėta, kad mineraluose lantanas ir lantanidai visada yra vienas kitą lydintys. Yra selektyvių mineralų, kuriuose vieno ar kito retųjų žemių elemento dalis yra didesnė nei įprasta. Tačiau nėra grynai lantano ar grynai cerio mineralų, jau nekalbant apie kitus lantanidus. Selektyvaus lantano mineralo pavyzdys yra daviditas, kuriame iki 8,3 % La 2 O 3 ir tik 1,3 % cerio oksido. Tačiau lantanas daugiausia gaunamas iš monazito ir bastnäsito, taip pat cerio ir visų kitų cerio pogrupio elementų.
Monazitas yra sunkus, blizgus mineralas, dažniausiai geltonai rudas, bet kartais ir kitų spalvų, nes nesiskiria savo sudėties pastovumu. Tiksliausiai jo sudėtį apibūdina tokia keista formulė: (REE)PO 4 . Tai reiškia, kad monazitas yra retųjų žemių elementų (REE) fosfatas. Paprastai monazite yra 50...68% REE oksidų ir 22...31,5% P 2 O 5. Taip pat jame yra iki 7% cirkonio dioksido, 10% (vidutiniškai) torio dioksido ir 0,1 ... 0,3% urano. Šie skaičiai aiškiai parodo, kodėl retųjų žemių ir branduolinės pramonės keliai taip glaudžiai susipynę.
Mišrus retųjų žemių metalas – mišmetalas – ir jų oksidų mišinys pradėti naudoti praėjusio amžiaus pabaigoje, o šio amžiaus pradžioje su jais buvo pademonstruotas išskirtinis tarptautinės vagystės pavyzdys. Vokiečių laivai, gabenę krovinius į Braziliją, grįždami atgal užpildė triumus smėliu iš šios šalies Atlanto vandenyno pakrantės paplūdimių ir iš tam tikrų vietų. Kapitonai tvirtino, kad smėlis tebuvo balastas, reikalingas, kad laivas būtų stabilesnis. Iš tikrųjų, vykdydami vokiečių pramonininkų užsakymus, jie pavogė vertingas mineralines žaliavas - Espirito Santo valstijos pakrantės smėlį, kuriame gausu monazito ...
Monazito stulpeliai yra platinami upių, ežerų ir jūrų pakrantėse visuose žemynuose. Šimtmečio pradžioje (1909 m. duomenys) 92% pasaulio retųjų žemių žaliavų ir pirmiausia monazito produkcijos sudarė Brazilija. Po dešimties metų svorio centras pasislinko tūkstančius kilometrų į rytus (arba į vakarus, priklausomai nuo to, kaip skaičiuosi) – į Indiją. Po 1950 m., plėtojant branduolinę pramonę, JAV tapo hegemonu tarp kapitalistinių šalių retųjų žemių žaliavų gavybos ir perdirbimo srityje.
Žinoma, mūsų šalis ir kitos socialistinės bendruomenės šalys turėjo plėtoti savo retųjų žemių pramonę ir ieškoti savo žaliavų.
Apibendrintai eikime keliu nuo monazito smėlio iki lantano.
Nors smėlis vadinamas monazitu, jame monazito nėra daug – procento dalis. Pavyzdžiui, gerai žinomuose Aidaho (JAV) monazito telkiniuose tonoje smėlio yra tik 330 g monazito. Todėl visų pirma gaunamas monazito koncentratas.
Pirmas susikaupimo etapas vyksta jau ant drago. Monazito tankis yra 4,9 ... 5,3, o paprasto smėlio - vidutiniškai 2,7 g / cm 3. Esant tokiam svorio skirtumui, gravitacinis atskyrimas nėra sunkus. Tačiau, be monazito, tuose pačiuose smėliuose yra ir kitų sunkiųjų mineralų. Todėl, norint gauti 92...96% grynumo monazito koncentratą, naudojamas gravitacinio, magnetinio ir elektrostatinio sodrinimo metodų kompleksas. Dėl to pakeliui gaunamas ilmenitas, rutilas, cirkonis ir kiti vertingi koncentratai.
Kaip ir bet kuris mineralas, monazitas turi būti „atidarytas“. Dažniausiai tam monazito koncentratas apdorojamas koncentruota sieros rūgštimi *. Susidarę retųjų žemių elementų ir torio sulfatai išplaunami paprastu vandeniu. Po to, kai jie ištirpsta, nuosėdose lieka silicio dioksidas ir dalis cirkonio, kuris neatsiskyrė ankstesniuose etapuose.
* Taip pat paplitęs šarminis monazito atidarymo būdas.
Kitame atskyrimo etape išgaunamas trumpalaikis mezotoriumas (radis-228), o paskui pats toris, kartais kartu su ceriu, kartais atskirai. Cerio atskyrimas nuo lantano ir lantanidų mišinio nėra ypač sudėtingas: priešingai nei jie, jis gali turėti 4+ valentingumą ir nusodinti Ce(OH) 4 hidroksido pavidalu, o jo trivalenčiai analogai lieka tirpale. . Atkreipiame dėmesį tik į tai, kad cerio atskyrimo operacija, kaip ir ankstesnės, atliekama pakartotinai - siekiant kuo geriau „išspausti“ brangų retųjų žemių koncentratą.
Išskyrus cerį, tirpale yra daugiausia lantano (La(NO 3) 3 nitrato pavidalu, nes vienoje iš tarpinių stadijų sieros rūgštis buvo pakeista azoto rūgštimi, kad būtų lengviau atskirti). Iš šio tirpalo lantanas gaunamas pridedant amoniako, amonio ir kadmio nitratų. Esant Cd(NO 3) 2 atskyrimas yra išsamesnis. Šių medžiagų pagalba visi lantanidai pereina į nuosėdas, o filtrate lieka tik kadmis ir lantanas. Kadmis nusodinamas vandenilio sulfidu, nuosėdos atskiriamos, o lantano nitrato tirpalas dar kelis kartus išgryninamas frakcine kristalizacija iš lantanido priemaišų.
Galiausiai paprastai gaunamas lantano chloridas LaCl 3. Išlydyto chlorido elektrolizės metu gaunamas iki 99,5 % grynumo lantanas. Dar daugiau gryno lantano (99,79% ir daugiau) gaunamas kalcio terminiu metodu. Tai klasikinė tradicinė technologija.
Kaip matote, elementinio lantano gavimas yra sudėtingas dalykas.
Lantanidų atskyrimas – nuo prazeodimio iki liutecio – reikalauja dar daugiau pastangų ir pinigų bei, žinoma, laiko. Todėl pastaraisiais dešimtmečiais daugelio pasaulio šalių chemikai ir technologai siekė sukurti naujus, pažangesnius šių elementų atskyrimo būdus. Tokie metodai – ekstrahavimas ir jonų mainai – buvo sukurti ir įdiegti pramonėje. Jau septintojo dešimtmečio pradžioje gamyklos, veikiančios jonų mainų principu, pasiekė 95% retųjų žemių produktų, kurių grynumas siekė 99,9%, išeigą.
Iki 1965 m. mūsų šalies užsienio prekybos organizacijos galėjo pasiūlyti pirkėjams visus metalų pavidalo lantanidus, kurių grynumas viršija 99%. Žinoma, be prometio, nors šio elemento radioaktyvieji preparatai – urano branduolinio skilimo produktai – taip pat tapo gana prieinami.
Techsnabexport kataloguose taip pat buvo apie 300 chemiškai grynų ir ypač grynų lantano ir lantanidų junginių. Tai liudija apie aukštą sovietinės retųjų žemių pramonės išsivystymo lygį.
Bet grįžkime prie lantano.
Trumpai apie lantano ir jo junginių panaudojimą
Grynas lantanas beveik niekada nenaudojamas kaip legiruojamasis metalas, tam naudojamas pigesnis ir lengviau prieinamas ceris arba mischmetal – lantano ir lantanidų legiravimo poveikis yra beveik toks pat.
Jau minėta, kad kartais lantanas iš mišinio ekstrahuojamas naudojant skirtingą kai kurių (dažniausiai kompleksinių) retųjų žemių elementų junginių tirpumą organiniuose tirpikliuose. Bet pasitaiko, kad pats elementas Nr.57 naudojamas kaip ekstraktorius. Išlydytas lantanas naudojamas plutoniui iš skysto urano išgauti. Čia yra dar vienas branduolinės ir retųjų žemių pramonės sąlyčio taškas.
Lantano oksidas La 2 O 3 naudojamas daug plačiau. Šie balti amorfiniai milteliai, netirpūs vandenyje, bet tirpūs rūgštyse, tapo svarbiu optinių stiklų komponentu. Garsiosios „Kodak“ kompanijos fotoobjektyvuose yra nuo 20 iki 40% La 2 O 3 . Dėl to, kad buvo pridėta lantano, buvo galima sumažinti objektyvo dydį esant ta pačia diafragma ir žymiai pagerinti spalvoto fotografavimo kokybę. Yra žinoma, kad Antrojo pasaulinio karo metais lantano stiklai buvo naudojami lauko optiniuose instrumentuose. Geriausi buitiniai fotografijos lęšiai, pavyzdžiui, Industar-61LZ, taip pat gaminami iš lantano stiklo, o viena geriausių mūsų mėgėjiškų kino kamerų vadinasi Lantanas... Pastaruoju metu lantano stiklas taip pat buvo naudojamas laboratoriniams indams gaminti. Lantano oksidas suteikia stiklui ne tik vertingų optinių savybių, bet ir didesnį atsparumą karščiui bei rūgštims.
Tai, ko gero, yra pagrindinis dalykas, kurį galima pasakyti apie lantaną be lantanidų, nors kai kuriose vietose buvo neįmanoma nenukrypti nuo principo „be“ ...
Lantanas ir jo komanda
Lyginti lantaną ir lantanidus su sporto komanda kai kuriems gali atrodyti tolima. Tačiau šis palyginimas nėra labiau triukšmingas nei tokie gerai žinomi apibrėžimai kaip „lantanidų šeima“ arba „cheminiai dvyniai“. Spręskite patys: lantanas ir jo komanda turi vieną uniformą (sidabriškai baltą) ir, kaip ir ledo ritulininkai, visi turi apsauginę amuniciją (iš oksidinių plėvelių). Visus juos gamta išleidžia maždaug vienodai (panašumas be galo didelis), tačiau, kaip ir sporte, dėl įvairių priežasčių „sugebėjimai“ realizuojami nevienodai: vieni „žaidžia“ geriau, kiti prasčiau... Žinoma, kiekvienas šios grupės narys atlieka savo mėgstamus „apgaulėtus“ ir „gudrybes“ – pavyzdžiui, gadolinio feromagnetizmą.
O pagal chemines savybes lantanidai vis tiek nėra dvyniai – kitaip jų atskirti nepavyktų. Kaip ir geroje sporto komandoje, jie yra vieningi pagrindinėje ir ypač individualioje. Kalbant apie dalyvių skaičių, žaidėjų skaičius skirtinguose žaidimuose yra skirtingas, 14 yra normos ribose...
Tiesa, buvo laikas, kai šiai „komandai“ buvo rekomenduota beveik penkiasdešimt kandidatų. Atrastų į lantaną panašių elementų skaičius augo katastrofiškai. Sudarė profesorius N.A. Figurovo klaidingai atrastų elementų sąraše yra daugiausia netikrų lantanidų. Klaidų neišvengė net ir didieji mokslininkai – Mozanderis, Lecoqas de Boisbaudranas, Aueris von Welsbachas, Crookesas, Urbainas.
Lantano ir jo komandos savybių neperiodiškumas, iškritimas iš griežtos periodinės sistemos sekos, sukėlė Mendelejevui bėdų. Tačiau laikui bėgant viskas išsisprendė. Tai buvo Prahos universiteto profesorius Bohuslavas Frantsevichas Brauneris, kuris pirmasis pasiūlė išimti lantanidus iš pagrindinės lentelės dalies.
„Jūs turite būti toks „retųjų žemių“ ekspertas, kaip B.F. Brauneris, norėdamas suprasti šį sudėtingą, sunkų ir vis dar beveik nebaigtą dalyką, kurį patikrinti sunku ne tik dėl daugelio pradinių santykių originalumo ir panašumo, bet ir dėl pačios natūralios medžiagos gavimo sunkumų “, - rašė Mendelejevas. 1902 m.
„Kalbant apie retųjų žemių elementų sistematiką ir jų vietą periodinėje lentelėje, dabar galima daryti prielaidą, kad skandis, itris ir lantanas yra lyginėse III grupės eilutėse, kaip matyti iš jų atominio svorio ir tūrio. jų oksidų... Kiti retųjų žemių elementai tikriausiai sudaro tarpperiodinę grupę arba mazgą sistemoje, kur jie seka vienas kitą pagal atominį svorį. Tai Braunerio žodžiai iš straipsnio „Retųjų žemių elementai“, parašyto priešpaskutiniam (1903 m.) Mendelejevo „Chemijos pagrindų“ leidimui.
Išnarplioti „mazgą sistemoje“ pagaliau pavyko tik į periodinės lentelės pagrindą įdėjus naują, fiziškai tikslesnį kriterijų – atomo branduolio krūvį. Tada paaiškėjo, kad tarp lantano ir tantalo gali tilpti tik 15 elementų, o pastarasis turėtų būti cirkonio analogas. Šį elementą, hafnį, 1923 m. atrado Costeris ir Hevosi.
Paskutinis (pagal atominį skaičių) lantanidas, liutecis, buvo aptiktas anksčiau, 1907 m.
Natūralu lantano ir lantanidų bendrų savybių priežasčių ieškoti jų atomų elektronų apvalkalų struktūroje.
Remiantis kvantinės mechanikos dėsniais, elektronai gali suktis aplink branduolius ne bet kokiomis orbitomis. Jie tarsi pasiskirstę sluoksniais – kriauklėmis. Šių apvalkalų talpa, maksimalus elektronų skaičius juose nustatomas pagal formulę ne = 2N 2, kur ne yra elektronų skaičius, a N yra apvalkalo skaičius, skaičiuojant nuo šerdies. Iš to seka, kad pirmasis apvalkalas gali turėti tik du elektronus, antrasis – aštuonis, trečiasis – aštuoniolika, ketvirtasis – trisdešimt du ir t.t.
Jau ketvirtajame periodinės lentelės periode, pradedant skandžiu, „kiti“ elektronai patenka ne į išorinį ketvirtąjį sluoksnį, o į ankstesnį. Štai kodėl elementų, kurių atominis skaičius yra nuo 12 iki 30, savybių skirtumas nėra toks ryškus kaip lengvesnių elementų. Panašus vaizdas stebimas ir penktajame periode. Ir čia, pradedant itriu, nauji elektronai užpildo ne penktą, o priešpaskutinį, ketvirtą apvalkalą – susidaro dar viena vadinamųjų pereinamųjų metalų serija.
Ryžiai. 3. Retųjų žemių elementų atominių tūrių kreivė. Jis turi du maksimumus, sudarytus iš elementų, kurių valentingumas 2+; priešingai, elementai, kurie gali būti keturvalenčiai, turi minimalų atominį tūrį
Perkeliant šią analogiją į šeštąjį periodą, būtų logiška manyti, kad pradedant lantanu (tai skandžio ir itrio analogas), čia bus tas pats. Tačiau elektronai, nepaisydami mūsų logikos, čia užpildo ne priešpaskutinį, o trečią apvalkalą iš išorės, nes jame yra laisvų vietų. Pagal formulę ne = 2N 2, ant šio apvalkalo - ketvirtojo iš branduolio - gali būti 32 elektronai. Čia, išskyrus retas išimtis, patenka „nauji“ kitų lantanidų elektronai. O kadangi elemento chemines savybes pirmiausia lemia išorinių elektronų apvalkalų struktūra, lantanidų savybės pasirodo dar artimesnės nei pereinamųjų metalų.
Kaip ir dera III grupės elementams, lantanidai dažniausiai yra trivalenčiai. Tačiau kai kurie iš jų gali parodyti ir kitą valentingumą: ceris, prazeodimis ir terbis – 4+; samaris, europis ir iterbis - 2+.
Anomalinius lantanidų valentingumus ištyrė ir paaiškino vokiečių chemikas Vilhelmas Klemas. Iš rentgeno spektrų jis nustatė pagrindinius jų kristalų parametrus ir atomų tūrius. Atominio tūrio kreivė aiškiai parodo maksimumus (europis, iterbis) ir, ne taip ryškiai, minimumus (ceris, terbis). Prazeodimis ir samaris taip pat iškrenta, nors ir nelabai, iš serijų, apibrėžtų sklandžiai krentančios kreivės. Todėl pirmasis „gravituoja“ prie mažo tūrio cerio ir terbio, o antrasis – prie didelio europio ir iterbio. Didesnio atomo tūrio elementai tvirčiau laiko elektronus, todėl yra tik tri- ar net dvivalečiai. „Mažo tūrio“ atomuose, atvirkščiai, vienas iš „vidinių“ elektronų nėra tvirtai uždarytas apvalkale – todėl cerio, prazeodimio ir terbio atomai gali būti keturvalenčiai.
Klemmo darbuose taip pat buvo pateiktas fizinis pagrindimas seniai nusistovėjusiam retųjų žemių elementų skirstymui į du pogrupius – cerį ir itrį. Pirmajame yra lantanas ir lantanidai nuo cerio iki gadolinio, antrasis – itris ir lantanidai nuo terbio iki liutecio. Skirtumas tarp šių dviejų grupių elementų yra elektronų, užpildančių pagrindinį ketvirtąjį lantanidų apvalkalą, sukimosi kryptis.
Spinai – tinkami elektronų impulso momentai – nes pirmieji turi tą patį ženklą; pastarajame pusė elektronų turi vieno ženklo sukinius, o pusė – kito.
Bet užteks apie anomalijas, kurias galima paaiškinti tik kvantinės mechanikos pagalba – grįžkime prie šablonų.
Kalbant apie lantanidus, raštai taip pat kartais atrodo nelogiški. To pavyzdys yra lantanido susitraukimas.
Lantanido suspaudimas – tai natūralaus retųjų žemių elementų trivalenčių jonų, nuo lantano iki liutecio, dydžio mažėjimo pavadinimas, kurį atrado norvegų geochemikas Goldschmidtas. Atrodytų, viskas turėtų būti atvirkščiai: cerio atomo branduolyje yra vienu protonu daugiau nei lantano atomo branduolyje; prazeodimio branduolys yra didesnis už cerio branduolį ir pan. Atitinkamai didėja ir aplink branduolį besisukančių elektronų skaičius. Ir jei įsivaizduotume atomą tokį, koks jis dažniausiai piešiamas diagramose – mažo disko pavidalu, apsuptu pailgomis nematomų elektronų orbitomis, įvairaus dydžio orbitomis, tai, aišku, elektronų pelnas turėtų padidinti atomo dydį kaip visas. Arba, jei atmestume išorinius elektronus, kurių skaičius gali būti nevienodas, turėtų būti stebimas toks pat lantano ir jo komandos trivalenčių jonų dydžių dėsningumas.
Tikroji padėtis iliustruojama lantanido suspaudimo diagramoje. Trivalenčio lantano jono spindulys yra 1,22 Å, o to paties liutecio jono – tik 0,99 Å. Viskas nėra logiška, o kaip tik atvirkščiai. Tačiau net ir be kvantinės mechanikos nesunku patekti į fizinės lantanido suspaudimo reiškinio prasmės dugną, užtenka tik prisiminti pagrindinius elektromagnetizmo dėsnius.
Branduolio krūvis ir aplink jį esančių elektronų skaičius auga lygiagrečiai. Taip pat auga traukos jėga tarp priešingų krūvių; sunkesnis branduolys stipriau pritraukia elektronus, sutrumpina jų orbitas. O kadangi gilios orbitos lantanido atomuose yra labiausiai prisotintos elektronų, elektrinė trauka turi dar stipresnį poveikį.
Joninių spindulių artumas ir cheminių savybių bendrumas yra pagrindinės priežastys, dėl kurių mineraluose yra lantanidai.
Apie retųjų žemių mineralus
Pagrindinis iš jų – monazitas – aprašytas aukščiau. Antras pagal svarbą retųjų žemių mineralas bastnäzitas daugeliu atžvilgių panašus. Bastnäsitas taip pat sunkus, taip pat blizgus, taip pat nepastovios spalvos (dažniausiai šviesiai geltonas). Tačiau chemiškai jis yra susijęs su monazitu tik dideliu lantano ir lantanidų kiekiu. Jei monazitas yra fosfatas, tai bastnäsitas yra retųjų žemių fluorokarbonatas, jo sudėtis paprastai rašoma taip: (La, Ce)FCO 3 . Tačiau, kaip dažnai nutinka, mineralinė formulė nevisiškai atspindi jos sudėtį. Šiuo atveju nurodomi tik pagrindiniai komponentai: bastnäsite 36,9 ... 40,5% cerio oksido ir beveik tokie pat (iš viso) lantano, prazeodimio ir neodimio oksidai. Tačiau, žinoma, jame yra ir kitų lantanidų.
Be bastnäsito ir monazito, praktiškai, nors ir ribotai, naudojami dar keli retųjų žemių mineralai, ypač gadolinitas, kuriame yra iki 32 % cerio pogrupio REE oksidų ir 22...50 % itrio. Kai kuriose šalyse retieji žemių metalai išgaunami kompleksiškai apdorojant loparitą ir apatitą.

Ryžiai. 4. Santykinis lantanidų kiekis žemės plutoje. Šablonas: lyginiai skaičiai yra labiau paplitę nei nelyginiai
Iš viso žinoma apie 70 pačių retųjų žemių mineralų ir dar apie 200 mineralų, kuriuose šie elementai yra įtraukti kaip priemaišos. Tai rodo, kad „retosios“ žemės nėra tokios retos, o šis senas įprastas skandžio, itrio ir lantano pavadinimas su lantanidu yra ne kas kita, kaip duoklė praeičiai. Jie nėra reti – žemėje cerio yra daugiau nei švino, o rečiausių retųjų žemių žemių plutoje yra daug dažniau nei gyvsidabrio. Tai susiję su šių elementų išsklaidymu ir sunkumu juos atskirti vieną nuo kito. Tačiau, žinoma, lantanidai gamtoje nėra vienodai pasiskirstę. Elementai su lyginiais atominiais skaičiais yra daug dažniau nei jų nelyginiai kaimynai. Ši aplinkybė, žinoma, turi įtakos retųjų žemių metalų gamybos mastui ir kainoms. Labiausiai nepasiekiami lantanidai – terbis, tulis, liutecis (atkreipkite dėmesį, kad tai visi lantanidai su nelyginiais atominiais skaičiais) – yra brangesni už auksą ir platiną. O daugiau nei 99% grynumo cerio kaina – tik 55 rubliai už kilogramą (1970 m. duomenys). Palyginimui nurodome, kad kilogramas mišmetalo kainuoja 6...7 rublius, o feroceris (10 % geležies, 90 % retųjų žemių elementų, daugiausia cerio) – tik penkis. Retųjų žemių elementų naudojimo mastai, kaip taisyklė, yra proporcingi kainoms...
Lantanidai praktikoje
1970 metų rudenį SSRS mokslų akademijos Retų elementų mineralogijos, geochemijos ir kristalų chemijos instituto mokslinė taryba susirinko į išplėstinį posėdį, kurio darbotvarkė buvo gana neįprasta. Retųjų žemių elementų galimybės buvo aptartos „atsižvelgiant į žemės ūkio problemas“.
Klausimas apie šių elementų įtaką gyviems organizmams iškilo neatsitiktinai. Viena vertus, žinoma, kad retųjų žemių metalai dažnai įtraukiami kaip priemaiša į svarbiausių agrochemijos mineralų - fosforitų ir apatito - sudėtį. Kita vertus, buvo nustatyti augalai, kurie gali būti lantano ir jo analogų biocheminiai rodikliai. Taigi, pavyzdžiui, pietinių Hikorijos riešutmedžio lapų pelenuose iki 2,5% retųjų žemių elementų. Padidėjusi šių elementų koncentracija taip pat nustatyta cukriniuose runkeliuose ir lubinuose. Retųjų žemių elementų kiekis tundros dirvožemyje siekia beveik 0,5%.
Mažai tikėtina, kad šie bendri elementai neturės įtakos augalų ir galbūt organizmų vystymuisi kitose evoliucijos laiptų pakopose. Dar ketvirtojo dešimtmečio viduryje sovietų mokslininkas A.A. Drobkovas tyrinėjo retųjų žemių poveikį įvairiems augalams. Jis eksperimentavo su žirniais, ropėmis ir kitomis kultūromis, įvedė retųjų žemių su boru arba be jo, manganą. Eksperimentų rezultatai teigė, kad retųjų žemių metalai reikalingi normaliam augalų vystymuisi... Tačiau praėjo ketvirtis amžiaus, kol šie elementai tapo sąlyginai prieinami. Galutinis atsakymas į klausimą apie lantano ir jo komandos biologinį vaidmenį dar turi būti pateiktas.
Šia prasme metalurgai gerokai aplenkė agrochemikus. Vienas reikšmingiausių pastarųjų dešimtmečių įvykių geležies ir plieno pramonėje yra susijęs su lantanu ir jo komanda.
Kalusis ketus dažniausiai buvo gaunamas modifikuojant jį magniu. Fizinė šio priedo prasmė paaiškės, jei prisiminsime, kad ketuje yra 2 ... 4,5% anglies dribsnių grafito pavidalu, kas suteikia ketaus pagrindinį techninį trūkumą – trapumą. Pridėjus magnio, grafitas virsta sferine arba rutuline forma, kuri tolygiau pasiskirsto metale. Dėl to žymiai pagerėja konstrukcija, o kartu ir mechaninės ketaus savybės. Tačiau ketaus legiravimas su magniu reikalauja papildomų išlaidų: reakcija labai audringa, išsilydęs metalas purslai į visas puses, todėl šiam procesui reikėjo statyti specialias kameras.
Retieji žemių metalai ketų veikia panašiai: „pašalina“ oksidų priemaišas, suriša ir pašalina sierą, prisideda prie grafito perėjimo į rutulinę formą. Ir tuo pačiu metu jiems nereikia specialių kamerų - reakcija vyksta ramiai. O rezultatas?
Vienai tonai ketaus įvedama tik 4 kg (0,4%) ferocerio-magnio lydinio, o ketaus stiprumas padvigubėja! Toks ketus daugeliu atvejų gali būti naudojamas vietoj plieno, ypač gaminant alkūninius velenus. Maža to, kaliasis ketus yra 20...25% pigesnis už plieno liejinius ir 3...4 kartus pigesnis už plieno kaltinius. Ketaus veleno kakliukų atsparumas dilimui pasirodė 2–3 kartus didesnis nei plieninių. Kaliojo ketaus alkūniniai velenai jau naudojami dyzeliniuose lokomotyvuose ir kitose sunkiose mašinose.
Retųjų žemių elementų (mišmetalo ir ferocerio pavidalu) taip pat dedama į įvairių rūšių plieną. Visais atvejais šis priedas veikia kaip stiprus deoksidatorius, puikus degazatorius ir sieros šalinimo priemonė. Kai kuriais atvejais retųjų žemių metalai yra legiruoti... legiruotasis plienas. Nikelio-chromo plienas sunkiai valcuojamas – tik 0,03% mišmetalo, įvestas į tokį plieną, labai padidina jo plastiškumą. Tai palengvina valcavimą, kaltinių gaminių gamybą ir metalo pjovimą.
Retųjų žemių elementai taip pat įtraukiami į lengvųjų lydinių sudėtį. Žinomas, pavyzdžiui, karščiui atsparus aliuminio lydinys su 11% mischmetal. Lantano, cerio, neodimio ir prazeodimio priedai leido daugiau nei tris kartus padidinti magnio lydinių minkštėjimo temperatūrą ir tuo pačiu padidinti jų atsparumą korozijai. Po to magnio lydiniai su retųjų žemių elementais pradėti naudoti gaminant viršgarsinių orlaivių dalis ir dirbtinių Žemės palydovų korpusus.
Retųjų žemių priedai pagerina kitų svarbių metalų – vario, chromo, vanadžio, titano – savybes... Nenuostabu, kad metalurgai kasmet vis dažniau naudoja retųjų žemių metalus.
Lantanas ir jo analogai buvo pritaikyti kitose šiuolaikinių technologijų srityse. Chemijos ir naftos pramonėje jie (ir jų junginiai) veikia kaip veiksmingi katalizatoriai, stiklo pramonėje – kaip dažikliai ir kaip medžiagos, suteikiančios stiklui specifinių savybių. Lantanidų naudojimas branduolinėje inžinerijoje ir susijusiose pramonės šakose yra įvairus. Bet daugiau apie tai vėliau, skyriuose, skirtuose kiekvienam lantanidui. Tik atkreipsime dėmesį, kad net dirbtinai sukurtas prometis rado pritaikymą: prometio-147 skilimo energija naudojama atominėse elektros baterijose. Žodžiu, retųjų žemių elementų nedarbo laikas baigėsi seniai ir negrįžtamai.
Tačiau nereikėtų manyti, kad visos problemos, susijusios su periodinės lentelės „mazgu“, jau buvo išspręstos. Šiandien ypač aktualūs Dmitrijaus Ivanovičiaus Mendelejevo žodžiai apie „retąsias žemes“: „Pastaraisiais metais čia susikaupė daug naujų dalykų“... Tačiau tik mėgėjai gali manyti, kad viskas ir viskas buvo žinoma, kad retas žemės subjektas išsėmė save. Specialistai, priešingai, įsitikinę, kad pažinimas apie lantaną ir jo komandą tik prasideda, kad šie elementai mokslo pasaulį nustebins dar ne kartą. Ir galbūt ne tik mokslinis.
reaktoriaus nuodai
Natūralus lantanas susideda iš dviejų izotopų, kurių masės skaičiai yra 138 ir 139, o pirmasis (jo frakcija yra tik 0,089%) yra radioaktyvus. Jis suyra K-fiksuojant, kurio pusinės eliminacijos laikas yra 3,2·10 11 metų. Izotopas lantanas-139 yra stabilus. Beje, jis susidaro branduoliniuose reaktoriuose irstant uranui (6,3 % visų fragmentų masės). Šis izotopas laikomas reaktoriaus nuodu, nes gana aktyviai fiksuoja šiluminius neutronus, o tai būdinga ir lantanidams. Iš dirbtinių lantano izotopų įdomiausias yra lantanas-140, kurio pusinės eliminacijos laikas yra 40,22 valandos. Šis izotopas naudojamas kaip radioaktyvus žymeklis tiriant lantano ir lantanidų atskyrimo procesus.
Kuris iš trijų?
Elementai, esantys po lantano, vadinami retaisiais žemėmis arba lantanidais arba lantanidais. Kuris iš šių pavadinimų yra tinkamiausias? Terminas „retųjų žemių metalai“ atsirado XVIII a. Dabar jis priskiriamas skandžio, itrio, lantano oksidams ir jo analogams; iš pradžių šis terminas turėjo platesnę reikšmę. „Žemėmis“ paprastai vadinami visi ugniai atsparūs metalų oksidai. Kalbant apie elementus, kurių atominis skaičius yra nuo 57 iki 71, tai tiesa: La 2 O 3 lydymosi temperatūra yra apie 2600 °C. Gryna forma daugelis šių „žemių“ yra retos iki šių dienų. Tačiau nereikia kalbėti apie retųjų žemių elementų retumą žemės plutoje ...
Terminas „lantanidai“ buvo įvestas siekiant parodyti, kad kiti keturiolika elementų yra po lantano. Bet tada, vienodai sėkmingai, fluoras gali būti vadinamas deguonimi (arba oksidu) – jis taip pat seka deguonį, o chloras – sulfidą... Tačiau chemija jau seniai investavo į sąvokas „sulfidas“, „fosfidas“, „hidridas“, chloridas ir tt skirtinga reikšmė. Todėl terminas „lantanidai“ daugumos mokslininkų laikomas nesėkmingu ir vartojamas vis rečiau.
"Lanthanides" - labiau pagrįsta. Galūnė „oid“ rodo panašumą. „Lanthanides“ reiškia „panašus į lantaną“. Matyt, šis terminas turėtų būti naudojamas apibūdinti 14 elementų - lantano analogų.
"Nauja istorija"
Lantano ir lantanidų istorijoje galima išskirti du laiko tarpus, ypač turtingus atradimų ir ginčų. Pirmasis iš jų datuojamas XIX amžiaus pabaiga, kai lantanidai buvo aptikti ir „užsidaryti“ taip dažnai, kad galiausiai pasidarė net neįdomu... Antrasis neramus laikotarpis buvo XX amžiaus 50-ieji, kai branduolinės technologijos plėtra padėjo gauti didelius retųjų žemių žaliavų kiekius ir paskatino naujus šios srities tyrimus. Būtent tada atsirado tendencija gauti ir naudoti retųjų žemių elementus ne mišinyje, o kiekvieną atskirai, naudojant specifines jų savybes. Neatsitiktinai per 15 metų (nuo 1944 m. iki 1958 m.) mokslinių publikacijų, skirtų lantanidams, skaičius išaugo 7,6 karto, o kai kurių atskirų elementų – net daugiau: pavyzdžiui, holmiui – 24, o tuliui – 45 kartus. !
Užmaskuotas krakmolu
Vienas iš lantano junginių, jo bazinis acetatas, elgiasi kaip krakmolas, kai į jį pridedama jodo. Baltas gelis įgauna ryškiai mėlyną spalvą. Analitikai kartais naudoja šią savybę, norėdami atrasti lantaną mišiniuose ir tirpaluose.
Dvivalentinis tik formaliai
Nustatyta, kad visuose junginiuose lantanas pasižymi vienodu valentingumu – 3+. Bet kaip tada paaiškinti pilkai juodo dihidrido LaH 2 ir geltonojo sulfido LaS egzistavimą? Nustatyta, kad LaH 2 yra santykinai stabilus tarpinis LaH 3 susidarymo reakcijos produktas ir kad lantanas yra trivalentis abiejuose hidriduose. Dihidrido molekulėje yra La-La metalo jungtis. Su sulfidu viskas paaiškinama dar paprasčiau. Ši medžiaga pasižymi dideliu elektriniu laidumu, o tai rodo, kad joje yra La 3+ jonų ir laisvųjų elektronų. Beje, LaH 2 taip pat gerai praleidžia srovę, o LaH 3 yra puslaidininkis.
Lantanas - 57
Lantanas (La) retųjų žemių metalas, atominis skaičius 57, atominė masė 138,91, lydymosi temperatūra 920°C ir tankis 6,16 g/cm3.
Jie ilgai negalėjo jo atidaryti, dėl ko jis gavo savo pavadinimą („lantan“, graikiškai „aš slepiuosi“). Ilgą laiką lantano buvo sunku gauti laboratorijoje ir, be to, pramonėje. Gryna forma jis ir jo junginiai buvo gauti tik 1903 m., naudojant chromatografiją. Pirmiausia buvo išskirtos lantano druskos, o vėliau ir pats lantanas gryna forma. Metalinis lantanas yra labai panašus į metalo kalcį. Jo kietumas prilygsta alavo, jis skaido vandenį, reaguoja su rūgštimis, o kaitinamas – su chloru ir siera. Atvirame sausame ore jis oksiduojasi ir plona oksido plėvelė apsaugo metalinį korpusą nuo oksidacijos.
LANTANO GAVIMAS.

retųjų žemių metalas – lantanas
Gamtoje lantano daugiausia randama mineraluose, vadinamuose monazitu ir bastnäsitu. Jo taip pat yra mineraluose loparite ir apatite. Šiuose mineraluose taip pat yra kitų REM, todėl sunku išskirti gryną lantaną. Pramonėje, kaip komercinis produktas, lantanas gaminamas iki 99 % grynumo, kuris vėliau padidinamas iki didesnio grynumo.
Monazitas yra sunkusis mineralas, gamtoje randamas įvairių spalvų dėl savo kintamos cheminės sudėties. Jame yra iki 68% įvairių REM oksidų, iki 7% cirkonio, iki 10% torio dioksido ir procento urano frakcijų. Monazitas, dažniausiai vietovių pavidalo, randamas įvairių žemynų jūrų, ežerų ir upių pakrantėse. Išgavus mineralus reikia gauti iki 92-96% grynumo koncentratą. Tam taikomas grubaus smulkinimo, smulkaus smulkinimo ir po to sodrinimo procesas gravitacijos, magnetiniais ir elektrostatiniais metodais. Tokiu atveju gaunami ir kiti koncentratai (ilmenitas, rutilas, cirkonis).
Tada gautas monazito koncentratas apdorojamas sieros rūgštimi (kartais šarmu). Susidarę REM sulfatai išplaunami vandeniu, ištirpsta, o silicio dioksidas ir dalis cirkonio lieka nuosėdose. Kitame apdorojimo etape atskiriamas radis 228 ir toris su ceriu. Atskyrus cerį, lantanas lieka tirpale LaCl3 chlorido pavidalu. Tada jis yra elektrolizuojamas lydaloje, kur jis išskiriamas iki 99,5% grynumo. Norint gauti daugiau gryno lantano iki 99,8%, naudojamas kalcio terminio apdorojimo metodas. Yra ir kitų retųjų žemių metalų atskyrimo būdų – ekstrahavimo ir jonų mainų, kuriuos naudojant pasiekiamas iki 99,9% gauto lantano grynumas.
Visai neseniai lantanas buvo gautas kartu su ceriu. Šiame mišinyje jų buvo santykiu 1:1, o šis mišinys pasižymėjo piroforinėmis savybėmis, kurios buvo panaudotos atsekamųjų sviedinių gamyboje. Lantano galima gauti gaminant superfosfatus ir apatitus, kurių atsargos mūsų šalyje yra neišsenkančios.
LANTANO TAIKYMAS.
Kuriant naujas medžiagas šiuolaikiniame pasaulyje sunku pervertinti retųjų žemių metalų, įskaitant lantaną, svarbą.
Energija. Branduolinė energija sunaudoja daug lantano kaip branduolinio kuro priedo. Jis taip pat naudojamas plutoniui gaminti. Vėjo energijos pramonėje vėjo turbinų generatoriams naudojami galingi magnetai, pagaminti iš lantano.
Naftos pramonė. Lantanas naudojamas kaip katalizatorius naftos krekingo procese.
Fosforai. Lantanas naudojamas fluorescencinių lempų gamyboje, plokščiųjų ekranų ir monitorių gamyboje, įrenginiams ant katodinių spindulių vamzdžių. Šiuo metu fosforo gamyba tampa didžiausia pasaulyje REM ir lantano, ypač labai išgryninto metalo ir sudėtingų junginių, tokių kaip LaCeT, LaP, vartojimo pramone.
Elektronika. Kompiuterių mikroschemų ir atminties įrenginių gamyba, LED ekranų gamyba.
Lydiniai ir keramika. Lydiniams legiruoti ir rafinuoti metalurgijoje, vadinamieji. mišrus metalas (cerio 45-50%, lantano 22-35%, neodimio 15-17% ir kitų REM lydinių su geležimi iki 5% ir silicio 0,1-0,3%), labai svarbus komponentas gryniems metalams gauti, kaip ligatūros karščiui ir chemikalams atspariems lydiniams gauti. Lantano ir cerio mišinys, įterptas į chromo-nikelio plienų sudėtį, žymiai padidina jų lankstumą, o tai palengvina valcavimą dešimt kartų ir žymiai sumažina metalo nuostolius. Neįmanoma gauti didelio grynumo ugniai atsparių metalų, jei į jų lydinius neįvedamas lantano ir jo mišinio su ceriu. Lantano ir jo mišinio su ceriu priedai prie aliuminio ir magnio žymiai padidina jų mechanines ir chemines savybes. Elektrinės ir elektroninės keramikos gamyba naudojant lantaną tampa svarbia pramonės šaka išsivysčiusių pramonės šalių rinkose.
Kosmosas ir aviacija. Palydovinių ir erdvėlaivių korpusų konstrukcinių medžiagų gamyba. Šios medžiagos atlaiko didžiules apkrovas, temperatūros ir slėgio kritimus. Orlaivių dujų turbininiams varikliams naudojamas mikrolydymas su REM lydiniais, kuriuose yra lantano.
Automobilių pramonė Kuro katalizatorių gamyba, naujos kartos akumuliatorių kūrimas, variklių gamyba hibridinėms transporto priemonėms.
Lazeriai ir optoelektronika. Optinių lęšių gamyba.
Kiti. Diagnostinių prietaisų kūrimas medicinoje, naujų rūšių trąšų kūrimas žemės ūkiui. Filtrų kūrimas aplinkai nekenksmingoms pramonės šakoms.
Įvadas
1. Kvitas
2. Savybės
3. Taikymas
4. Biologinis vaidmuo
Išvada
Įvadas
Lantano, kaip cheminio elemento, nepavyko atrasti 36 metus. 1803 m. 24 metų švedų chemikas Jönsas Jakobas Berzelius ištyrė mineralą, dabar žinomą kaip ceritas. Šiame minerale buvo rasta itrio žemių ir kitos retos žemės, labai panašios į itrį. Jie pavadino jį ceriumi. 1826 m. Carlas Mozanderis ištyrė cerio žemę ir padarė išvadą, kad ji yra nevienalytė, kad, be cerio, joje yra dar vienas naujas elementas. Cerio žemės sudėtingumą Mozandrui pavyko įrodyti tik 1839 m. Naują elementą jam pavyko išskirti turėdamas didesnį cerito kiekį.
1. Kvitas
Metalinį lantaną, žinoma, toli gražu ne gryną, pirmą kartą Mosander gavo kaitindamas lantano chloridą su kaliu. Šiais laikais pramoniniu mastu lantanas gaunamas daugiau nei 99 % grynumo; daugiausia iš monazito ir bastnäsito, taip pat cerio ir visų kitų cerio pogrupio elementų.
Mozanitas yra sunkus, blizgus mineralas, dažniausiai geltonai rudas, bet kartais ir kitų spalvų, nes savo sudėtimi nesiskiria. Tiksliau, jo sudėtis apibūdinama tokia keista formule: (REE)RO4: tai reiškia, kad monazitas yra retųjų žemių elementų (REE) fosfatas. Paprastai monalite 50-68% REE oksidų ir 22-31,5% P2O5. Taip pat jame yra iki 7% cirkonio dioksido, 10% (vidutiniškai) torio dioksido ir 0,1-0,3% urano. Šie skaičiai aiškiai parodo, kodėl mūsų laikais retųjų žemių ir branduolinės pramonės keliai yra glaudžiai susipynę. Monazito stulpeliai yra platinami upių, ežerų ir jūrų pakrantėse visuose žemynuose. Šimtmečio pradžioje (1909 m. duomenys) 92% pasaulio retųjų žemių žaliavų, pirmiausia monazito, produkcijos buvo pagaminta iš Brazilijos. Po 1950 m., plėtojant branduolinę pramonę, JAV tapo hegemonu tarp kapitalistinių šalių retųjų žemių žaliavų gavybos ir perdirbimo srityje.
Norint gauti 92 - 96% grynumo monazito koncentratą, naudojamas gravitacinio, magnetinio ir elektrostatinio sodrinimo metodų kompleksas. Dėl to pakeliui gaunamas ilmenitas, rutilas, cirkonis ir kiti vertingi koncentratai.
Kaip ir bet kuris mineralas, monazitas turi būti „atidarytas“. Dažniausiai tam monazito koncentratas apdorojamas koncentruota sieros rūgštimi (išplito ir šarminis monazito atidarymo būdas). Susidarę retųjų žemių elementų ir torio sulfatai išplaunami šaltu vandeniu. Po to, kai jie ištirpsta, nuosėdose lieka silicio dioksidas ir dalis cirkonio, kuris neatsiskyrė ankstesniuose etapuose.
Kitame etape atskiriamas trumpalaikis mezotoriumas (radis - 228), o tada pats toris - kartais kartu su ceriu, kartais atskirai. Išskyrus cerį, didžioji dalis lantano lieka tirpale, kuris paprastai gaunamas LaCl3 chlorido pavidalu. Išlydyto chlorido elektrolizės metu gaunamas iki 99,5% grynumo lantanas. Dar daugiau gryno lantano – 99,79% ir daugiau gaunamas kalcio terminiu metodu. Tai klasikinė, tradicinė technologija. Kaip matote, elementinio lantano gavimas yra sudėtingas dalykas.
Lantanidų atskyrimas – nuo prazeodimio iki liutecio – reikalauja dar daugiau pastangų ir pinigų bei, žinoma, laiko. Todėl pastarąjį dešimtmetį daugelio pasaulio šalių chemikai ir technologai siekė sukurti naujus, pažangesnius šių elementų atskyrimo metodus. Tokie metodai – ekstrahavimas ir jonų mainai – buvo sukurti ir įdiegti pramonėje. Jau septintojo dešimtmečio pradžioje gamyklos, veikiančios jonų mainų principu, pasiekė 95% retųjų žemių produktų, kurių grynumas siekė 99,9%, išeigą.
2. Savybės
Lantano fizinės savybės
LANTANAS (iš graikų lanthano – slepiasi; lot. Lanthanum) La, chem. elementas III gr. periodiškai sistemos, atominis skaičius 57, atominė masė 138,9055; priklauso retųjų žemių elementams. Natūralų lantaną sudaro du izotopai 139La (99,911%) ir radioaktyvusis 138La (0,089%).
|
atominis skaičius |
||
|
Išvaizda |
minkštas, kalus, klampus sidabro baltumo metalas |
|
|
Atomo savybės |
||
|
Atominė masė (molinė masė) |
138.9055 a. e.m. (g/mol) |
|
|
Atomo spindulys |
||
|
Jonizacijos energija (pirmasis elektronas) |
541,1 (5,61) kJ/mol (eV) |
|
|
Elektroninė konfigūracija |
||
|
Termodinaminės savybės |
||
|
Tankis |
||
|
Specifinė šiluma |
0,197 J/(K mol) |
|
|
Šilumos laidumas |
13,4 W/(m K) |
|
|
Lydymosi temperatūra |
||
|
Lydymosi karštis |
8,5 kJ/mol |
|
|
Virimo temperatūra |
||
|
Garavimo šiluma |
402 kJ/mol |
|
|
Molinis tūris |
22,5 cm3/mol |
|
|
Cheminės savybės |
||
|
kovalentinis spindulys |
||
|
Jonų spindulys |
101.(+3e) 18 val |
|
|
Elektronegatyvumas |
||
|
Elektrodo potencialas |
||
|
Oksidacijos būsenos |
7, 6, 4, 3, 2, 0, -1 |
|
|
Kristalinė ląstelė |
||
|
Grotelių struktūra |
šešiakampė |
|
|
Grotelių laikotarpis |
||
|
c/a santykis |
||
|
Debye temperatūra |
Cheminės savybės
Pagal chemines savybes lantanas yra įprastas, tačiau itin atsparus ugniai. Sausame ore jis nesikeičia – oksido plėvelė patikimai apsaugo nuo oksidacijos urmu. Bet jei oras drėgnas (o įprastomis antžeminėmis sąlygomis beveik visada drėgnas), metalinis lantanas palaipsniui oksiduojasi iki hidroksido. Deguonyje, kaitinamas iki 450 ° C, jis dega ryškia liepsna (šiuo atveju išsiskiria gana daug šilumos). Jei jis kaitinamas azoto atmosferoje, susidaro juodasis nitridas. Chlore lantanas užsidega kambario temperatūroje, o su bromu ir jodu reaguoja tik kaitinamas. Jis gerai tirpsta mineralinėse rūgštyse, nereaguoja su šarmų tirpalais. Visuose junginiuose lantano valentingumas yra 3+.
Reakcija su vandeniliu ir lantanu prasideda jau kambario temperatūroje ir vyksta išskiriant šilumą. Susidaro įvairios sudėties hidridai, nes tuo pačiu metu lantanas sugeria vandenilį – kuo intensyviau, tuo aukštesnė temperatūra.
3. Taikymas
Stiklo gamyba
Lantano oksidas (nuo 5 iki 40%) naudojamas optiniam stiklui (lantano stiklui) lydyti, lęšiams ir prizmėms, naudojamoms kino ir fotografijos technikoje, gaminti, taip pat astronomijos tikslams.
Keraminių elektrinių šildytuvų gamyba
Lantano chromitas, legiruotas kalciu, stronciu, magniu, naudojamas aukštos temperatūros krosnių šildytuvų gamybai (lydymosi temperatūra Ї 2453 ° C, darbo temperatūra - apie 1780 laipsnių deguonies atmosferoje). Kylant temperatūrai, lantano chromito elektrinė varža smarkiai sumažėja. Lantano chromito šiluminio plėtimosi koeficientas yra labai mažas ir tai lemia elektrinių šildytuvų ilgaamžiškumą.
Aukštos temperatūros superlaidumas
Lantano oksidas naudojamas aukštos temperatūros superlaidininkams, kurių pagrindą sudaro lantano, itrio, bario, stroncio, vario ir kt. oksidai, sintezei.
Metalo terminis
Kartais lantanas naudojamas metalotermijoje, siekiant sumažinti retų elementų kiekį.
Specialios stiklo dangos
Lantano junginių pagrindu gaminamos dangos langų stiklams, kurios leidžia sumažinti temperatūrą patalpoje 5-7 laipsniais.
Termoelektrinės medžiagos
Lantano monoteluridas turi labai aukštą šiluminę emf (834 µV/K) ir yra naudojamas didelio efektyvumo termoelektriniuose generatoriuose.
Metalo hidrido vandenilio akumuliatorių gamyba
Lantano nikelio hidridas plačiai naudojamas kaip didelės talpos vandenilio saugykla (metalo hidrido vandenilio saugykla) automobiliams.
Atominė energija
Didelio grynumo metalinis lantanas turi absoliučiai išskirtinę reikšmę branduolinėje pramonėje, o ypač branduolinio kuro perdirbimo technologijoje, siekiant išgauti plutonį. Išlydytas lantanas sumaišomas su išlydytu metaliniu uranu, kurio priemaiša yra metalinis plutonis. Išlydytas lantanas visiškai išskiria plutonio izotopus iš didžiosios urano dalies į lydinį ir plūduriuoja virš urano, nesimaišydamas su juo. Gautas lydinys nusausinamas ir apdorojamas chemine technologija. Galima teigti, kad lantanas ant savo „pečių“ laiko branduolinių ginklų gamybą.
Elektronika
Pastaraisiais metais labai išaugo susidomėjimas lantano molibdatu, kuris pasižymi dideliu laidumu.
elektroninė mikroskopija
LaB 6 (lantano heksaborido) katodų naudojimas elektroniniuose mikroskopuose leido padidinti skiriamąją gebą padidinus srovės tankį 6 kartus ir tuo pat metu padidinti katodo tarnavimo laiką 5 kartus (iki 500 valandų), palyginti su volframu. katodai.
Cheminiai srovės šaltiniai
Akumuliatorių su kietu elektrolitu gamyba ir tyrimai yra labai svarbūs pramonei ir elektronikai. Šioje srityje lantano fluoridas tapo labai svarbus kaip elektrolitas, o kai metalas lantanas yra anodas, katodas dažniausiai yra bismutas, švinas arba vario fluoridas. Tokių srovės šaltinių patraukli pusė yra labai didelis savitasis energijos intensyvumas tūrio atžvilgiu, ilgas energijos kaupimo laikotarpis, stiprumas ir ilgaamžiškumas; Šiuo atžvilgiu daugelis pirmaujančių ekspertų laiko juos alternatyva bet kokioms kitoms baterijoms.
4. Biologinis vaidmuo
lantano chlorido metalo cheminė medžiaga
Trečiojo dešimtmečio viduryje sovietų mokslininkas A. A. Drobkovas tyrinėjo retųjų žemių metalų poveikį įvairiems augalams. Jis eksperimentavo su žirniais, ropėmis ir kitais augalais, pristatė retųjų žemių metalus su boru arba be jo, manganą. Eksperimentų rezultatai teigė, kad retųjų žemių metalai reikalingi normaliam augalų vystymuisi. Tačiau praėjo ketvirtis amžiaus, kol šie elementai tapo gana prieinami. Galutinis atsakymas į klausimą apie biologinį lantano vaidmenį dar turi būti pateiktas.
Medicinoje lantano karbonatas naudojamas esant hiperfosfatemijai kaip vaistas, neleidžiantis fosfatui pasisavinti iš maisto.
Išvada
Savo abstrakčiai išnagrinėjau fizines ir chemines lantano savybes, taip pat kur lantanas naudojamas, kokiose pramonės šakose ir medicinoje.
Bibliografija
1. Arefjeva „Ekologinė chemija“, 2006 m
2. Gelfmanas „Chemija“, 2004 m
3. Nekrasovas „Bendroji chemija“, 2007 m
4. Knyazevas „Neorganinė chemija“, 2004 m
5. http://ru.wikipedia.org/wiki/%D0%9B%D0%B0%D0%BD%D1%82%D0%B0%D0%BD
Panašūs dokumentai
Lantano ir lantanidų šeima, jų fizikinių ir cheminių savybių ypatumai. Lantano ir jo junginių atradimo istorija, gavimo būdai, pritaikymas. Lantano ir lantanidų atomų elektronų apvalkalų sandara. Anomalios lantanidų valencijos.
santrauka, pridėta 2010-01-18
Kietųjų medžiagų joninio laidumo prigimtis. Kietųjų oksidų elektrolitų rūšys, jų panaudojimas įvairiuose įrenginiuose. Bismuto oksido sandara ir savybės, jo bendras cheminis nusodinimas lantano oksidu. Susintetinto kietojo elektrolito analizė.
Kursinis darbas, pridėtas 2013-12-06
Bario metalas ir jo atsiradimas gamtoje. Metalinio bario gavimas. Bario chlorido elektrolizė. Hidrido terminis skilimas. Cheminės ir fizinės savybės. Taikymas. Jungtys (bendrosios savybės). neorganiniai junginiai.
Akrilamidas: fizikinės ir cheminės savybės, tirpumas. Akrilamido paruošimas ir nustatymas, toksiškumas. Akrilamido ir jo darinių naudojimo ypatybės. Akrilamido polimerų taikymas ir gamyba. Poliakrilamido cheminių savybių apibūdinimas.
Kursinis darbas, pridėtas 2010-06-19
Fizinės ir cheminės 2-metilbutadieno-1,3 savybės. Pavojingo poveikio tipų, toksiškumo, pavojingumo klasės analizė. Taikymas pramonėje. Gamybos metodai, chemija ir proceso technologija. Izopreno gamyba izobutileno ir formaldehido pagrindu.
Kursinis darbas, pridėtas 2015-09-03
Antrosios grupės pagrindinio pogrupio elementas, ketvirtasis periodinės D. I. Mendelejevo cheminių elementų sistemos periodas. Vardo istorija ir kilmė. Kalcio radimas gamtoje. Fizinės ir cheminės savybės. Metalinio kalcio naudojimas.
santrauka, pridėta 2012-12-01
Vandenilio peroksido fizinės savybės – bespalvis skaidrus skystis su lengvu savitu kvapu. Medžiagos gavimas laboratorinėmis ir pramoninėmis sąlygomis. Vandenilio peroksido redukuojančios ir oksiduojančios savybės, jo baktericidinės savybės.
pristatymas, pridėtas 2014-09-23
Stroncio atradimo istorija. Rasti gamtoje. Stroncio gavimas aliuminoterminiu būdu ir jo saugojimas. fizines savybes. Mechaninės savybės. Atominės charakteristikos. Cheminės savybės. Technologinės savybės. Naudojimo sritys.
santrauka, pridėta 2008-09-30
Fizinės ir fizikinės cheminės feritų savybės. Normalaus ir atvirkštinio spinelio sandara. Sukepinimo ir karštojo presavimo būdo apžvalga. Šešiakampės struktūros magnetiniai kristalai. Feritų panaudojimas radijo elektronikoje ir kompiuterinėse technologijose.
Kursinis darbas, pridėtas 2016-12-12
Kalcio chloridas: fizikinės ir cheminės savybės. pritaikymas ir žaliavos. Lydyto kalcio chlorido gavimas iš distiliavimo skysčio, gaminančio soda. Kalcio chlorido ir hidroksilchlorido gavimas iš motininio tirpalo. Bevandenis kalcis iš druskos rūgšties.