Tülyum tülyum
Periyodik tablonun III. grubunun kimyasal bir elementi olan (lat. Thulium) lantanitlere aittir. Adını Yunanca Thúlē - Thule'den alır. Metal. Yoğunluk 9,318 g/cm3; T pl 1545°C. Yapay olarak üretilen radyoaktif izotop 170 Tm, yumuşak bir X-ışını radyasyonu kaynağıdır.
TÜLYUMTULYUM (enlem. Tülyum, eski coğrafyacılar arasında Thule - dünyanın en kuzeyi), Tm ("tülyum" olarak okunur), atom numarası 69, atom kütlesi 168.93421 olan kimyasal bir element, daha önce kimyasal sembolü Tu'ydu. Doğada kararlı bir izotop olan 169 Tm bulunur. Üç dış elektronik katmanın konfigürasyonu 4s 2 p 6 d 10 f 13 5s 2 p 6 d 0 6s 2'dir. Oksidasyon durumları +3, +2 (değerlik III, II).
Periyodik element tablosunun 6. periyodunda IIIB grubunda yer alır. Lantanit (santimetre. LANTANOİDLER).
Atom yarıçapı 0,174 nm, iyon yarıçapı (koordinasyon numarası 6) Tu 3+ - 0,102 nm, Tu 2 + - 0,117 nm. Ardışık iyonlaşma enerjileri 6.181, 12.05, 23.7, 42.7 eV'dir. Pauling'e göre elektronegatiflik (santimetre. PAULING Linus) 1,1.
Keşif tarihi
1879'da İsveçli kimyager P. T. Kleve tarafından keşfedildi (santimetre. KLEVE Pierre Theodore) Gadolinit mineralinden yeni bir elementin oksidini izole eden kişi. Elementi spektral yöntemle tanımlayan Kleve, ona anavatanının adını verdi.
Doğada olmak
Yer kabuğundaki içerik %2,7·10-5'tir. Mineraller içerir: bastnäsite (santimetre. BASTNESİT), monazit (santimetre. MONAZİT), loparit (santimetre. LOPARİT),
ortit (santimetre. ORTI),
ksenotim (santimetre. KSENOTİM).
Fiş
Tülyum iterbiyum ile konsantre edilir (santimetre.İTERBİYUM) ve lutesyum (santimetre. LUTESYUM). Ayırma ve saflaştırma, iyon kromatografisi veya ekstraksiyon yöntemleri kullanılarak gerçekleştirilir.
Tülyum metali, kalsiyum kullanılarak TmF3'ün metalotermik indirgenmesiyle elde edilir (santimetre. KALSİYUM):
2TmF 3 +3Ca=3CaF 2 +2Tm
veya Tm203'ün lantan metali ile indirgenmesi (santimetre. LANTAN):
Tm 2 O 3 +La=La 2 O 3 +Tm
Fiziksel ve kimyasal özellikler
Tülyum yumuşak gümüş grisi bir metaldir. Mg tipi altıgen kristal kafesli bir modifikasyonda bulunur, A= 0,35375 nm, c = 0,55546 nm. Erime noktası 1545°C, kaynama noktası 1947°C, yoğunluk 9.318 kg/dm3.
Kompakt Tm havada stabildir. Halojenli (santimetre. HALOJEN)ısıtıldığında tepkimeye girerek TmF3 ve TmCl3 oluşturur. Tülyum mineral asitlerle reaksiyona girerek tülyum(III) tuzlarını oluşturur. Güçlü indirgeyici maddelerle Tm 3+, Tm 2+'ye indirgenir.
Nitrat Tm(NO 3) 3, oksalat Tm 2 (C 2 O 4) 3, sülfat Tm 2 (SO 4) 3 ve diğer Tm (III) bileşiklerinin 800-900°C'de havada kalsine edilmesiyle, tülyum oksit Tu 2 O 3 oluşur.
Başvuru
Tülyum, bazı fosforlar ve lazer malzemeleri için aktivatör olarak kullanılır ve yapay garnetlerin sentezinde kullanılır.
ansiklopedik sözlük. 2009 .
Eş anlamlı:Diğer sözlüklerde “thulium” un ne olduğunu görün:
- (Tulium), Tm, periyodik tablonun III. grubunun kimyasal elementi, atom numarası 69, atom kütlesi 168.9342; nadir toprak elementlerine aittir; metal. 1879'da İsveçli kimyager P. Kleve tarafından keşfedildi... Modern ansiklopedi
- (Latin Tülyum) Periyodik tablonun III. Grubunda yer alan, atom numarası 69, atom kütlesi 168.9342 olan kimyasal bir element olan Tm, lantanitlere aittir. Yunanca'dan isim. Thule Thule. Metal. Yoğunluk 9,318 g/cm³, erime noktası 1545.C. Yapay olarak elde edilen... ... Büyük Ansiklopedik Sözlük
- (Yunan Thule Thule'den, eski coğrafyacılara göre dünyanın en uç kuzey sınırı; lat. tulium * a. thulium; n. Thulium; f. thulium; i. tulio), Tm, kimyasal. grup III periyodik elementi. Mendeleev sistemi, at.sci. 69, en. m.168.9342, şunu ifade eder... ... Jeolojik ansiklopedi
- (enlem. Tulium), Tm, kimyasal. grup III periyodik elementi. element sistemleri, at. 69 numara, en. kütle 168,9342; lantanitlere aittir. Doğada 169 Tm'de stabil olarak bulunur. Harici konfigürasyon elektron kabukları Enerji sıralıdır. iyonizasyon... ... Fiziksel ansiklopedi
İsim, eş anlamlıların sayısı: 3 lantanit (15) metal (86) element (159) ASIS Eşanlamlılar Sözlüğü ... Eşanlamlılar sözlüğü
Tülyum- (Tulium), Tm, periyodik tablonun III. grubunun kimyasal elementi, atom numarası 69, atom kütlesi 168.9342; nadir toprak elementlerine aittir; metal. 1879'da İsveçli kimyager P. Kleve tarafından keşfedildi. ... Resimli Ansiklopedik Sözlük
69 Erbiyum ← Tülyum → İtterbiyum ... Wikipedia
- (lat. Thulium), kimyasal. element III gr. periyodik sistem lantanitlere aittir. İsim Yunancadan Thule (Eski adı) aşırı kuzey ülkeler Metal. Yoğunluk 9,318 g/cm3; 1545 °C'ye kadar. Yapay radyoaktif nüklid 170Tm yumuşak kaynak... ... Doğal bilim. ansiklopedik sözlük
- (enlem. thule yarı efsanevi ülke, eski zamanlarda dünyanın kuzey ucu olarak kabul edilir) kimyasal. lantanit ailesinden bir element, sembolü Tm (enlem. tülyum), metal. Yeni yabancı kelimeler sözlüğü. EdwART, 2009. thulium i, çoğul. Hayır m. (… Rus dilinin yabancı kelimeler sözlüğü
Tülyum- Bakın Thulium (Tm)... Ansiklopedik Metalurji Sözlüğü
Kitabın
- Ahlaki Düşünceler (deri ciltli, altın kenarlı), Cicero Marcus Tullius. Seçkin bir Romalı hukukçu ve devlet adamı olan Marcus Tullius Cicero, konsül seçildi, Senato tarafından anavatanın babası ve kendisine emanet edilen eyaletin askerleri tarafından imparator ilan edildi. Fakat…
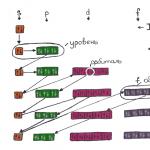
Bir atomun elektronik konfigürasyonu bir atomdaki elektronların düzeylere ve alt düzeylere göre dizilişini gösteren bir formüldür. Makaleyi inceledikten sonra elektronların nerede ve nasıl bulunduğunu öğrenecek, kuantum sayılarını tanıyacak ve bir atomun elektronik konfigürasyonunu numarasına göre oluşturabileceksiniz; makalenin sonunda bir element tablosu bulunmaktadır.
Neden elemanların elektronik konfigürasyonunu incelemeliyiz?
Atomlar bir yapı seti gibidir: Belli sayıda parça vardır, birbirlerinden farklıdırlar, ancak aynı türden iki parça kesinlikle aynıdır. Ancak bu yapım seti plastik olandan çok daha ilginç ve nedeni de bu. Yapılandırma yakınlarda kimin olduğuna bağlı olarak değişir. Örneğin hidrojenin yanında oksijen Belki suya dönüşür, sodyumun yanında gaza dönüşür, demirin yakınındayken tamamen pasa dönüşür. Bunun neden olduğu sorusunu yanıtlamak ve bir atomun diğerinin yanındaki davranışını tahmin etmek için aşağıda tartışılacak olan elektronik konfigürasyonu incelemek gerekir.
Bir atomda kaç elektron vardır?
Atom bir çekirdek ve onun etrafında dönen elektronlardan oluşur; çekirdek ise proton ve nötronlardan oluşur. Nötr durumda, her atomun elektron sayısı, çekirdeğindeki proton sayısına eşittir. Proton sayısı, elementin atom numarası ile belirlenir; örneğin, kükürtün 16 protonu vardır - periyodik tablonun 16. elementi. Altının 79 protonu var - periyodik tablonun 79. elementi. Buna göre kükürtün nötr durumda 16 elektronu, altının ise 79 elektronu vardır.
Elektron nerede aranır?
Elektronun davranışını gözlemleyerek belirli modeller elde edildi; bunlar kuantum sayılarıyla tanımlanır; toplamda dört tane vardır:
- Ana kuantum sayısı
- Yörünge kuantum numarası
- Manyetik kuantum sayısı
- Spin kuantum sayısı
Orbital
Ayrıca yörünge kelimesi yerine "orbital" terimini kullanacağız; yörünge, elektronun dalga fonksiyonudur, kabaca elektronun zamanının %90'ını geçirdiği bölgedir.
N - seviye
L - kabuk
M l - yörünge numarası
M s - yörüngedeki birinci veya ikinci elektron
Yörünge kuantum sayısı l
Elektron bulutunun incelenmesi sonucunda, enerji seviyesine bağlı olarak bulutun dört ana form aldığını buldular: bir top, dambıl ve diğer iki, daha karmaşık form. Artan enerjiye göre bu formlara s-, p-, d- ve f-kabuğu adı verilir. Bu kabukların her biri 1 (s üzerinde), 3 (p üzerinde), 5 (d üzerinde) ve 7 (f üzerinde) yörüngeye sahip olabilir. Yörünge kuantum sayısı, yörüngelerin bulunduğu kabuktur. S,p,d ve f yörüngeleri için yörünge kuantum sayısı sırasıyla 0,1,2 veya 3 değerlerini alır.
S kabuğunda bir yörünge vardır (L=0) - iki elektron
P kabuğunda üç yörünge vardır (L=1) - altı elektron
D kabuğunda beş yörünge vardır (L=2) - on elektron
F kabuğunda yedi yörünge vardır (L=3) - on dört elektron
Manyetik kuantum sayısı m l
P kabuğunda üç yörünge vardır ve bunlar -L'den +L'ye kadar sayılarla gösterilir, yani p kabuğu (L=1) için "-1", "0" ve "1" yörüngeleri vardır. . Manyetik kuantum sayısı m l harfiyle gösterilir.
Kabuğun içinde elektronların farklı yörüngelere yerleştirilmesi daha kolaydır, bu nedenle ilk elektronlar her bir yörüngeyi doldurur ve ardından her birine bir çift elektron eklenir.
D kabuğunu düşünün:
D kabuğu L=2 değerine karşılık gelir, yani beş yörünge (-2,-1,0,1 ve 2), ilk beş elektron M l =-2, M değerlerini alarak kabuğu doldurur. l =-1, M l =0 , M l =1,M l =2.
Spin kuantum sayısı m s
Spin, bir elektronun kendi ekseni etrafında dönme yönüdür, iki yön vardır, dolayısıyla spin kuantum numarasının iki değeri vardır: +1/2 ve -1/2. Bir enerji alt seviyesi yalnızca zıt spinlere sahip iki elektron içerebilir. Spin kuantum sayısı m s ile gösterilir
Baş kuantum sayısı n
Ana kuantum sayısı enerji seviyesidir; şu anda her biri Arap rakamıyla gösterilen yedi enerji seviyesi bilinmektedir: 1,2,3,...7. Her seviyedeki mermi sayısı seviye numarasına eşittir: birinci seviyede bir mermi, ikinci seviyede iki mermi vardır, vb.
Elektron numarası

Yani herhangi bir elektron dört kuantum sayısıyla tanımlanabilir, bu sayıların kombinasyonu elektronun her konumu için benzersizdir, ilk elektronu alın, en düşük enerji seviyesi N = 1'dir, ilk seviyede bir kabuk vardır, Herhangi bir seviyedeki ilk kabuk bir top (s-kabuk) şeklindedir; L=0, manyetik kuantum sayısı yalnızca bir değer alabilir, M l =0 ve spin +1/2'ye eşit olacaktır. Eğer beşinci elektronu alırsak (hangi atomda olursa olsun), o zaman onun ana kuantum sayıları şöyle olacaktır: N=2, L=1, M=-1, spin 1/2.
Tülyum - 69
Tülyum (Tm) - nadir toprak elementi, atom numarası 69, atom kütlesi 168,93, erime noktası 1545°C, yoğunluk 9,346 g/cm3.
Thulium, adını, antik coğrafyacıların en kuzeydeki toprak olarak kabul ettiği ve günümüzde coğrafi konumu İskandinav Yarımadası'na karşılık gelen efsanevi ülke "Thule" onuruna almıştır. Tülyum 1879'da spektroskopiyle keşfedildi. Tülyum, doğadaki en önemsiz lantanitlerden biridir, ayrıca onu diğer nadir toprak metalleriyle karışımdan ayırmak çok zordu. Yüzde yirmi tülyum konsantresi elde etmek ve ardından içindeki tülyum içeriğini %99'a çıkarmak birkaç yıl aldı. Günümüzde nadir toprak metallerinin ayrılması için kullanılan kromatografik yöntem, tülyum oksitlerin üretimini ve ardından saf metal üretimini önemli ölçüde basitleştirmiş ve hızlandırmıştır. Saf haliyle tülyum 1911'de elde edildi.
Tülyum en ağır lantanitlerden biridir, yoğunluğu bakır ve nikele yakındır.

Tülyum — gümüş-beyaz yumuşak
Tülyum — gümüş-beyaz yumuşak Dövülebilir, viskoz bir metal olan havada oksitlenmez, ancak nemli havada ısıtıldığında hafifçe oksitlenir. Tulyum tuzları üretmek için mineral asitlerle reaksiyona girer. Isıtıldığında halojenler ve nitrojenle reaksiyona girer. Doğada tulyum ksenotim, euksenit, monazit ve loparit gibi minerallerde bulunur. Yer kabuğundaki içerik toplam kütlenin %2,7x10-5'idir. Doğal ve insan yapımı hammadde türlerinde, tülyum oksit son derece nadiren bulunur - ödialitte -% 0,3 ve diğer minerallerde - daha da az. Tulyumdan farklı yarı ömürlere sahip 32 yapay radyoaktif izotop elde edilmiştir. Sadece bir tanesi doğal olarak oluşur; tülyum-169.
FİŞ.
Doğal minerallerin zenginleştirilmesinden sonra, nadir toprak metallerinin bir karışımından elde edilen konsantreler işlenir, bunun sonucunda tülyum ağır lantanitler - iterbiyum ve lutesyum ile konsantre edilir. Ayırma ve rafine etme, kompleksonlar (metal iyonlarıyla kompleks bileşikler oluşturan organik maddeler) kullanılarak ekstraksiyon veya iyon değişim kromatografisi yoluyla gerçekleştirilir. Tülyum metali, tülyum florürün TmF3-kalsiyum ile veya tülyum oksidin Tm2O3-lantan ile termal indirgenmesiyle elde edilir. Tülyum ayrıca havadaki tülyum nitratların, sülfatların ve oksalatların 800-900°C'ye ısıtılmasıyla da elde edilir.
BAŞVURU.
Doğada yaygınlığının az olmasına ve maliyetinin yüksek olmasına rağmen, tülyum günümüzde bilimde ve endüstride nispeten yaygın olarak kullanılmaya başlanmıştır.
İlaç. Yumuşak gama radyasyonuna sahip olan tülyum izotopu tülyum-170, özellikle insan vücudunun geleneksel bir X-ışını makinesiyle ulaşılması zor olan bölgeleri için teşhis cihazları oluşturmak için kullanılır. Radyoaktif tülyum içeren bu radyo iletim cihazlarının tıbbi uygulamada kullanımı basit ve kolaydır.
Lazer malzemeleri. Tülyum iyonları kızılötesi lazer radyasyonu üretmek için kullanılır. Tülyum metal buharları, değişken frekanslı (dalga boyu) lazer radyasyonunu uyarmak için kullanılır. Tülyum, lazer malzemelerinin üretiminde ve ayrıca sentetik garnet üretiminde kullanılır.
Manyetik ortam. Tülyum metali, bilgi depolama ortamı oluşturmak amacıyla ferrogarnet üretmek için kullanılır.
TermoEMF malzemeleri. Tülyum monotelürid, termal dönüştürücülerin yüksek verimliliği ile yüksek düzeyde termoEMF'ye sahiptir; ancak, tülyumun termoelementler olarak yaygın kullanımı, yüksek maliyeti nedeniyle engellenmektedir.
Yarı iletkenler. Tülyum tellür, kurşun tellürün yarı iletken özelliklerini düzenlemek için bir değiştirici olarak kullanılır.
Nükleer güç. Tülyum borat, nötron radyasyonuna karşı koruma sağlamak amacıyla özel emayelere katkı maddesi olarak kullanılır.
Süperiletkenler. Tülyum bileşikleri, yüksek sıcaklıkta süper iletken malzemelerin bir parçasıdır.
Cam üretimi. Tülyum, katot ışın tüpleri için cam ve seramik üretiminde çeşitli oksit malzemelerin bir bileşenidir.
-
1879'da İsveçli kimyager Per Theodor Kleve, Marignac'ın holmiyum ve tülyum (Thule, İskandinavya'nın eski Roma adıdır) adını verdiği "erbiyum"undan iki "dünya" daha izole etti. Spektrum, tülyumun hala bilinmeyen bir kimyasal element içerdiğini gösterdi. Daha sonra Kleve bu elementin bazı tuzlarını elde etmeyi başardı ve bunların soluk yeşil renkte olduğunu gösterdi. Böylece, Thulium adının ve Tm sembolünün verildiği en nadir elementlerden biri keşfedildi.
1911'de T. W. Richards elementi izole etti ve atom kütlesini belirledi.Doğada olmak, almak:
Tülyum bir eser elementtir, yerkabuğundaki içeriği kütlece %2,7·10 -5'tir. Aşağıdaki minerallerin bir parçasıdır: monazit (Ce, La...)PO 4, bastnäsite (Ce, La, Pr)CO 3 F ve diğerleri. Tülyum, iyon kromatografisi veya ekstraksiyon kullanılarak nadir toprak elementlerinin bir karışımından izole edilir, okside dönüştürülür, ardından florüre dönüştürülür. Tülyum metali, TmF3'ün kalsiyum ile veya Tm203'ün lantan ile indirgenmesiyle elde edilir.
Fiziki ozellikleri:
Gümüş grisi bir metaldir, dövülebilir, sünek ve nispeten yumuşaktır. Yoğunluk 9,321 g/cm3, erir. = 1545°C, kaynama sıcaklığı = 1950°C. Doğal tülyum monoizotopik bir elementtir (tülyum-169), yapay olarak elde edilen tülyum izotoplarının yarı ömürleri kısadır (en uzun ömürlü tülyum-170 128,6 gündür).
Kimyasal özellikler:
Tülyum kuru havada oldukça stabildir; ısıtıldığında tülyum metali halojenler, nitrojen ve hidrojen ile reaksiyona girer. Florüre dayanıklıdır. Hidroksit Tm(OH)3 ve hidrojen oluşturmak üzere kaynar su ile reaksiyona girer. Tülyum mineral asitlerle (HF hariç) reaksiyona girerek tülyum(III) tuzlarını oluşturur.
Bileşiklerde ağırlıklı olarak +3 oksidasyon durumunu sergiler. Çoğu, çeşitli tonlarda yeşilimsi bir renkle karakterize edilir.En önemli bağlantılar:
Tülyum(III) oksit, Tm203, Tm(OH)3 hidroksitin dikkatlice dehidrasyonu, tülyum nitrat veya oksalatın ayrıştırılmasıyla elde edilebilir. Suda çözünmeyen açık yeşil kristaller.
Tülyum(III) hidroksit, Tm(OH)3, suda çözünmeyen amorf bir madde. Çözünür tulyum(III) tuzlarından değişim reaksiyonuyla elde edilebilir. Asitlerle tulyum(III) tuzlarını oluşturur.
Tülyum(III) florür, TmF 3 - değişim reaksiyonları veya gaz halindeki HF'nin tülyum(III) oksit üzerindeki etkisiyle elde edilen, çözünmeyen renksiz kristaller
Tülyum(III) klorür, TmСl 3 - sarı kristaller, çözünür, kristalin hidrat TmСl 3 * 7H2O - yeşilimsi kristaller oluşturur. Kristalin hidratın ısıtılmasına, tülyum oksoklorür TmOCl oluşumu ile hidroliz eşlik eder. Güçlü indirgeyici maddeler (alkali metaller) tülyum(II) klorüre dönüştürülebilir; ikincisi su ve oksijen tarafından kolayca oksitlenir.
Tülyum(III) nitrat, Tm(NO 3) 3, yeşilimsi kristaller, suda yüksek oranda çözünür, Tm(NO 3) 3 · 5H2 O bileşimi ile kristalli bir hidrat oluşturur.
Susuz tuz, nitrik oksidin (IV) tülyum(III) oksit veya tülyum metali üzerindeki etkisiyle hazırlanır:
Tm + 2N 2 Ö 4 = Tm(NO 3) 3 + 3NO
Tülyum(III) sülfat Tm2(S04)3, yeşil kristaller. Suda çözünür ve Tm2 (SO4)3 9H2O bileşimi ile kristalli bir hidrat oluşturur.Başvuru:
Tülyum, bazı fosforlar ve lazer malzemeleri için aktivatör olarak kullanılır ve yapay garnetlerin sentezinde kullanılır. Termoelektrik ve manyetik malzemelerin üretiminde sınırlı kullanım.
Radyoaktif izotop tulyum-170, taşınabilir X-ışını makinelerinde (yumuşak gama radyasyonu) ve kusur dedektörlerinde radyasyon kaynağı olarak kullanılır. İçlerindeki çalışma maddesi tülyum(III) oksittir.Kaynaklar: 1. Elementlerin keşfi ve adlarının kökeni. Tülyum
2. Popüler kimyasal element kütüphanesi Nauka Yayınevi, 1977.
Kusur tespiti. Radyoaktif izotop tülyum-170, hafif demir dışı metallerin ve bunların alaşımlarının yanı sıra 2 mm kalınlığa kadar ince çelik plakaların kusurlarının tespiti için kullanılır. 70 mm kalınlığa kadar olan alüminyum ürünler, tülyum-170 izotopu ile kolaylıkla taranabilmekte ve bu sayede içlerindeki en küçük kusurların tespit edilmesi mümkün olmaktadır. Bu durumda, tülyum gama radyasyonunu kullanan ve incelenen nesnenin yüksek kontrastlı görüntüsünü üreten bir fotoelektrik cihaz kullanılır. Tülyum-170, bir alüminyum ampul içine yerleştirilen ve daha sonra onunla birlikte kullanılan tülyum oksidin nötronlarla ışınlanmasıyla hazırlanır.