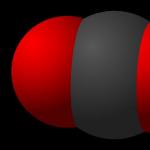
Mesaj pe tema dioxid de carbon (CO2)
dioxid de carbon
Dioxidul de carbon este o substanță care există de obicei în stare gazoasă. Poate deveni greu dacă se răcește puțin.
Aerul conține întotdeauna o cantitate mică de dioxid de carbon, aproximativ 1 litru la 2560 de litri de aer. Majoritatea dioxidului de carbon intră în aer atunci când țesuturile animale și vegetale formate din carbon se descompun. Combustibilii din carbon, cum ar fi lemnul sau cărbunele, produc cantități mari de dioxid de carbon atunci când sunt arse.
Corpul uman are nevoie de cantități mici de dioxid de carbon pentru a supraviețui. Acesta controlează viteza bătăilor inimii și alte câteva funcții ale corpului. Dar suprasaturarea corpului cu dioxid de carbon poate provoca rău și chiar poate provoca moartea.
O persoană primește oxigen din aerul pe care îl respiră. Oxigenul intră în sânge. Acolo se combină cu alimentele și se transformă în dioxid de carbon ca urmare a reacțiilor chimice. Dioxidul de carbon revine în plămâni și este expirat.
Copacii, la rândul lor, au o nevoie vitală de dioxid de carbon. Plantele verzi absorb dioxidul de carbon din aer prin porii din frunzele lor. Se combină cu apa, iar apoi, cu ajutorul luminii solare, dioxidul de carbon și apa sunt transformate în amidon și alte alimente pentru plantă. Planta eliberează oxigen.
Deci, plantele eliberează oxigen și absorb dioxid de carbon. Animalele inspiră oxigen și expiră dioxid de carbon. Aceasta menține o cantitate constantă de oxigen și dioxid de carbon în aer.
Dioxidul de carbon are și utilizări industriale, dintre care cea mai cunoscută este carbonatarea băuturilor.
Fapte interesante:
Concentrația de dioxid de carbon în atmosfera Pământului este în medie de 0,0395%.
Unele dintre cele mai mari concentrații de dioxid de carbon se găsesc în atmosferele lui Venus și Marte.
Potrivit unor estimări ale climatologilor și chimiștilor, în ultimele două secole, datorită oamenilor, aproximativ 2,1 trilioane de tone de CO2 au intrat în atmosfera planetei. Este de remarcat faptul că cel mai mare impact al emisiilor de dioxid de carbon nu a fost asupra atmosferei, ci asupra oceanului - aciditatea acestuia a crescut cu 30%.
SARCINI SIMILARE:
Subiect:
Dioxid de carbon, monoxid de carbon, dioxid de carbon - toate acestea sunt denumiri pentru o substanță cunoscută de noi ca dioxid de carbon. Deci, ce proprietăți are acest gaz și care sunt domeniile sale de aplicare?
Dioxidul de carbon și proprietățile sale fizice
Dioxidul de carbon este format din carbon și oxigen. Formula pentru dioxid de carbon arată astfel - CO₂. În natură, se formează în timpul arderii sau descompunerii substanțelor organice. Conținutul de gaz în aer și izvoarele minerale este, de asemenea, destul de mare. În plus, oamenii și animalele emit și dioxid de carbon atunci când expiră.

Orez. 1. Molecula de dioxid de carbon.
Dioxidul de carbon este un gaz complet incolor și nu poate fi văzut. De asemenea, nu are miros. Cu toate acestea, cu concentrații mari, o persoană poate dezvolta hipercapnie, adică sufocare. Lipsa dioxidului de carbon poate provoca, de asemenea, probleme de sănătate. Ca urmare a lipsei acestui gaz, se poate dezvolta starea opusă sufocării - hipocapnia.
Dacă puneți dioxid de carbon în condiții de temperatură scăzută, atunci la -72 de grade se cristalizează și devine ca zăpada. Prin urmare, dioxidul de carbon în stare solidă se numește „zăpadă uscată”.

Orez. 2. Zăpadă uscată – dioxid de carbon.
Dioxidul de carbon este de 1,5 ori mai dens decât aerul. Densitatea sa este de 1,98 kg/m³ Legătura chimică din molecula de dioxid de carbon este polară covalentă. Este polar datorită faptului că oxigenul are o valoare mai mare a electronegativității.
Un concept important în studiul substanțelor este masa moleculară și molară. Masa molară a dioxidului de carbon este 44. Acest număr este format din suma maselor atomice relative ale atomilor care alcătuiesc molecula. Valorile maselor atomice relative sunt luate din tabelul D.I. Mendeleev și sunt rotunjite la numere întregi. În consecință, masa molară a CO₂ = 12+2*16.
Pentru a calcula fracțiile de masă ale elementelor din dioxid de carbon, este necesar să se urmeze formula de calcul a fracțiilor de masă ale fiecărui element chimic dintr-o substanță.
n– numărul de atomi sau molecule.
O r– masa atomică relativă a unui element chimic.
Dl– masa moleculară relativă a substanței.
Să calculăm masa moleculară relativă a dioxidului de carbon.
Mr(CO₂) = 14 + 16 * 2 = 44 w(C) = 1 * 12 / 44 = 0,27 sau 27% Deoarece formula dioxidului de carbon include doi atomi de oxigen, atunci n = 2 w(O) = 2 * 16 / 44 = 0,73 sau 73%
Răspuns: w(C) = 0,27 sau 27%; w(O) = 0,73 sau 73%
Proprietățile chimice și biologice ale dioxidului de carbon
Dioxidul de carbon are proprietăți acide deoarece este un oxid acid, iar atunci când este dizolvat în apă formează acid carbonic:
CO2+H2O=H2CO3
Reacționează cu alcalii, rezultând formarea de carbonați și bicarbonați. Acest gaz nu arde. Doar anumite metale active, cum ar fi magneziul, ard în el.
Când este încălzit, dioxidul de carbon se descompune în monoxid de carbon și oxigen:
2CO3=2CO+O3.
Ca și alți oxizi acizi, acest gaz reacționează ușor cu alți oxizi:
СaO+Co₃=CaCO3.
Dioxidul de carbon face parte din toate substanțele organice. Circulația acestui gaz în natură se realizează cu ajutorul producătorilor, consumatorilor și descompunetorilor. În timpul vieții, o persoană produce aproximativ 1 kg de dioxid de carbon pe zi. Când inspirăm, primim oxigen, dar în acest moment se formează dioxid de carbon în alveole. În acest moment, are loc un schimb: oxigenul intră în sânge, iar dioxidul de carbon iese.
Dioxidul de carbon este produs în timpul producerii de alcool. Acest gaz este, de asemenea, un produs secundar în producerea de azot, oxigen și argon. Utilizarea dioxidului de carbon este necesară în industria alimentară, unde dioxidul de carbon acționează ca un conservant, iar dioxidul de carbon sub formă lichidă se găsește în stingătoarele de incendiu.

Orez. 3. Extinctor.
Ce am învățat?
Dioxidul de carbon este o substanță care în condiții normale este incoloră și inodoră. Pe lângă numele său comun, dioxid de carbon, se mai numește și monoxid de carbon sau dioxid de carbon.
Test pe tema
Evaluarea raportului
Evaluare medie: 4.3. Evaluări totale primite: 105.
Dioxid de carbon, incolor, inodor, solubilitate în apă - 0,9 V CO 2 se dizolvă în 1 V H 2 O (în condiții normale); mai greu decât aerul; t°pl. = -78,5°C (CO 2 solid se numește „gheață carbonică”); nu suportă arderea.
Când este dizolvat în apă, formează acid carbonic slab, care devine roșu hârtia de turnesol. Acidul carbonic îmbunătățește gustul băuturilor carbogazoase și previne creșterea bacteriilor. Reacționând cu hidroxizi ai metalelor alcaline și alcalino-pământoase, precum și cu amoniacul, CO 2 formează carbonați și bicarbonați.
Încărcați modulul
Odată cu creșterea presiunii și răcirea, dioxidul de carbon se lichefiază ușor și se află în stare lichidă la temperaturi de la +31 la –57 ° C (în funcție de presiune). Sub –57°C se transformă în stare solidă (gheață carbonică). Presiunea necesară pentru lichefiere depinde de temperatură: la +21° C este de 60 atm, iar la –18° C este de doar 20 atm. CO2 lichid este depozitat în recipiente sigilate sub presiune adecvată. Când trece în atmosferă, o parte din ea se transformă în gaz, iar o parte în „zăpadă de carbon”, în timp ce temperatura scade la –84 ° C.
Absorbind căldura din mediu, gheața carbonică trece în stare gazoasă, ocolind faza lichidă - se sublimează. Pentru a reduce pierderile prin sublimare, acesta este depozitat și transportat în recipiente etanșe suficient de puternice pentru a rezista la creșterea presiunii pe măsură ce temperatura crește.
Dioxidul de carbon este pătura Pământului. Transmite cu ușurință razele ultraviolete care ne încălzesc planeta și reflectă razele infraroșii emise de la suprafața sa în spațiul cosmic.
Dioxidul de carbon este folosit destul de larg în practica de zi cu zi. De exemplu, apa spumanta cu esente aromatice adaugate este o bautura racoritoare minunata. În industria alimentară, dioxidul de carbon este folosit și ca conservant - este indicat pe ambalaj sub codul E290, precum și ca agent de dospire.
Stingătoarele cu dioxid de carbon sunt folosite în incendii. Biochimiștii au descoperit că fertilizarea... aerului cu dioxid de carbon este un mijloc foarte eficient de creștere a randamentului diferitelor culturi. Poate că acest îngrășământ are un singur, dar semnificativ dezavantaj: poate fi folosit doar în sere La fabricile care produc dioxid de carbon, gazul lichefiat este ambalat în butelii de oțel și trimis către consumatori.
Dioxidul de carbon este utilizat ca mediu activ la sudarea cu sârmă, deoarece la temperatura arcului, dioxidul de carbon se descompune în monoxid de carbon CO și oxigen, care, la rândul său, interacționează cu metalul lichid, oxidându-l.
Dioxidul de carbon din cutii este folosit în tunurile cu aer comprimat și ca sursă de energie pentru motoarele în modelarea aeronavei.
În concentrații mari, dioxidul de carbon este toxic și provoacă hipoxie. Inhalarea pe termen lung (până la câteva zile), chiar și la o concentrație de 1,5-3%, provoacă dureri de cap, amețeli și greață. La concentrații de peste 6% (așa-numitul nivel critic), performanța este pierdută, apare somnolența, respirația și activitatea cardiacă sunt slăbite și există pericol pentru viață. Primul ajutor: duceți victima la aer curat, efectuați respirație artificială. În aerul clădirilor rezidențiale și publice, acumularea de dioxid de carbon nu atinge valori critice; concentrația sa este unul dintre indicatorii sanitari și igienici ai gradului de curățenie a mediului aerian.
Slide 1
Prezentare despre chimie pentru elevii clasei a IX-a pe tema: „Dioxid de carbon” MBOU – Școala Gimnazială Nr. 19 Razdolnenskaya, raionul Novosibirsk, regiunea Novosibirsk Completată de: profesor de chimie Evstegneeva Alevtina Vasilievna p. Razdolnoye 2011Slide 2
 Formula structurală a dioxidului de carbon O=C=O Formula moleculară a dioxidului de carbon CO2
Formula structurală a dioxidului de carbon O=C=O Formula moleculară a dioxidului de carbon CO2
Slide 3
 Proprietăți fizice Monoxidul de carbon (IV) este un gaz incolor, de aproximativ 1,5 ori mai greu decât aerul, foarte solubil în apă, inodor, neinflamabil, nu susține arderea și provoacă sufocare. Sub presiune se transformă într-un lichid incolor, care se solidifică atunci când este răcit.
Proprietăți fizice Monoxidul de carbon (IV) este un gaz incolor, de aproximativ 1,5 ori mai greu decât aerul, foarte solubil în apă, inodor, neinflamabil, nu susține arderea și provoacă sufocare. Sub presiune se transformă într-un lichid incolor, care se solidifică atunci când este răcit.
Slide 4
 Formarea monoxidului de carbon (IV) În industrie - un produs secundar în timpul producției de var. În laborator când acizii interacționează cu creta sau marmura. În timpul arderii substanțelor care conțin carbon. Cu oxidare lentă în procesele biochimice (respirație, degradare, fermentație).
Formarea monoxidului de carbon (IV) În industrie - un produs secundar în timpul producției de var. În laborator când acizii interacționează cu creta sau marmura. În timpul arderii substanțelor care conțin carbon. Cu oxidare lentă în procesele biochimice (respirație, degradare, fermentație).
Slide 5
 Aplicarea monoxidului de carbon (IV) Producția de zahăr. Stingerea incendiilor. Producerea apelor de fructe. „Gheață uscată”. Obținerea produselor de curățenie. Primirea de medicamente. Preparat de sifon, care este folosit pentru producerea sticlei.
Aplicarea monoxidului de carbon (IV) Producția de zahăr. Stingerea incendiilor. Producerea apelor de fructe. „Gheață uscată”. Obținerea produselor de curățenie. Primirea de medicamente. Preparat de sifon, care este folosit pentru producerea sticlei.
Slide 6
 Prindem fum Arderea este asociată cu apariția fumului. Fumul poate fi alb, negru și uneori invizibil. Un fum „invizibil” numit dioxid de carbon se ridică deasupra unei lumânări fierbinți sau a unei lămpi cu alcool. Țineți o eprubetă curată deasupra lumânărilor și prindeți puțin din fumul „invizibil”. Pentru a preveni zburarea, închideți rapid eprubeta cu un dop fără orificiu. Dioxidul de carbon va fi invizibil într-o eprubetă. Păstrați această eprubetă cu dioxid de carbon pentru experimente ulterioare.
Prindem fum Arderea este asociată cu apariția fumului. Fumul poate fi alb, negru și uneori invizibil. Un fum „invizibil” numit dioxid de carbon se ridică deasupra unei lumânări fierbinți sau a unei lămpi cu alcool. Țineți o eprubetă curată deasupra lumânărilor și prindeți puțin din fumul „invizibil”. Pentru a preveni zburarea, închideți rapid eprubeta cu un dop fără orificiu. Dioxidul de carbon va fi invizibil într-o eprubetă. Păstrați această eprubetă cu dioxid de carbon pentru experimente ulterioare.
Slide 7
 „A Troubled Story” Turnați puțină apă de var (pentru a acoperi fundul) în eprubeta în care ați captat dioxidul de carbon din flacăra lumânării. Închideți eprubeta cu degetul și agitați-o. Apa limpede de var a devenit complet tulbure. Doar dioxidul de carbon este de vină pentru asta. Dacă introduceți apă de var într-o eprubetă care nu conține dioxid de carbon și agitați eprubeta, apa va rămâne limpede. Aceasta înseamnă că turbiditatea apei de var este o dovadă că a existat dioxid de carbon în eprubetă.
„A Troubled Story” Turnați puțină apă de var (pentru a acoperi fundul) în eprubeta în care ați captat dioxidul de carbon din flacăra lumânării. Închideți eprubeta cu degetul și agitați-o. Apa limpede de var a devenit complet tulbure. Doar dioxidul de carbon este de vină pentru asta. Dacă introduceți apă de var într-o eprubetă care nu conține dioxid de carbon și agitați eprubeta, apa va rămâne limpede. Aceasta înseamnă că turbiditatea apei de var este o dovadă că a existat dioxid de carbon în eprubetă.
Slide 8
 Dioxidul de carbon este eliberat din sifon. Conectați această eprubetă cu un tub cotat la o altă eprubetă care conține apă. Din tub vor începe să apară bule. În consecință, un fel de gaz intră în apă din sifon. Tubul de sticlă nu trebuie lăsat să fie coborât în apă după ce încălzirea s-a terminat, altfel apa se va ridica în tub și va cădea în eprubeta fierbinte cu sifon. Acest lucru poate duce la spargerea eprubetei. După ce vedeți că gazul se eliberează din sifon atunci când este încălzit, încercați să înlocuiți apa plată din eprubetă cu apă de var. Va deveni noros. Dioxidul de carbon este eliberat din sifon.
Dioxidul de carbon este eliberat din sifon. Conectați această eprubetă cu un tub cotat la o altă eprubetă care conține apă. Din tub vor începe să apară bule. În consecință, un fel de gaz intră în apă din sifon. Tubul de sticlă nu trebuie lăsat să fie coborât în apă după ce încălzirea s-a terminat, altfel apa se va ridica în tub și va cădea în eprubeta fierbinte cu sifon. Acest lucru poate duce la spargerea eprubetei. După ce vedeți că gazul se eliberează din sifon atunci când este încălzit, încercați să înlocuiți apa plată din eprubetă cu apă de var. Va deveni noros. Dioxidul de carbon este eliberat din sifon.
Slide 9
 Gazul de limonadă este, de asemenea, dioxid de carbon, dacă deschideți o sticlă de limonadă sau începeți să o agitați, vor apărea o mulțime de bule de gaz. Închideți sticla de limonada cu un dop care conține un tub de sticlă și puneți capătul lung al tubului într-o eprubetă cu apă de var. În curând apa va deveni tulbure. Deci, gazul de lămâie este dioxid de carbon. Se formează din acidul carbonic conținut în limonadă.
Gazul de limonadă este, de asemenea, dioxid de carbon, dacă deschideți o sticlă de limonadă sau începeți să o agitați, vor apărea o mulțime de bule de gaz. Închideți sticla de limonada cu un dop care conține un tub de sticlă și puneți capătul lung al tubului într-o eprubetă cu apă de var. În curând apa va deveni tulbure. Deci, gazul de lămâie este dioxid de carbon. Se formează din acidul carbonic conținut în limonadă.
Slide 10
 Oțetul elimină dioxidul de carbon din sifon. Dioxidul de carbon este conținut într-o serie de substanțe, dar este imposibil de detectat din vedere. Dacă turnați oțet pe o bucată de sifon, oțetul va șuiera puternic și un fel de gaz va fi eliberat din sifon. Dacă puneți o bucată de sifon într-o eprubetă, turnați puțin oțet în ea, închideți-o cu un dop cu tub cot și scufundați capătul lung al tubului în apă de var, veți fi convins că se eliberează și dioxid de carbon din sifon.
Oțetul elimină dioxidul de carbon din sifon. Dioxidul de carbon este conținut într-o serie de substanțe, dar este imposibil de detectat din vedere. Dacă turnați oțet pe o bucată de sifon, oțetul va șuiera puternic și un fel de gaz va fi eliberat din sifon. Dacă puneți o bucată de sifon într-o eprubetă, turnați puțin oțet în ea, închideți-o cu un dop cu tub cot și scufundați capătul lung al tubului în apă de var, veți fi convins că se eliberează și dioxid de carbon din sifon.
Slide 11
 Fabrica de limonadă Chiar și acidul slab elimină dioxidul de carbon din sifon. Acoperiți fundul eprubetei cu acid citric și turnați aceeași cantitate de sifon deasupra. Se amestecă aceste două substanțe. Amândoi se înțeleg, dar nu pentru mult timp. Turnați acest amestec într-un pahar obișnuit și umpleți-l rapid cu apă proaspătă. Cât de mult șuiera și face spumă! Ca o limonadă adevărată. Îl poți sorbi în siguranță. Este absolut inofensiv, chiar gustos. Trebuie doar să adaugi zahăr la început, doar pentru a-l face mai gustos.
Fabrica de limonadă Chiar și acidul slab elimină dioxidul de carbon din sifon. Acoperiți fundul eprubetei cu acid citric și turnați aceeași cantitate de sifon deasupra. Se amestecă aceste două substanțe. Amândoi se înțeleg, dar nu pentru mult timp. Turnați acest amestec într-un pahar obișnuit și umpleți-l rapid cu apă proaspătă. Cât de mult șuiera și face spumă! Ca o limonadă adevărată. Îl poți sorbi în siguranță. Este absolut inofensiv, chiar gustos. Trebuie doar să adaugi zahăr la început, doar pentru a-l face mai gustos.
Slide 12
 Limonada în buzunar Dioxidul de carbon din băuturi mărește efectul lor revigorant. Puteți face oricând spumă de lămâie. Pentru a face acest lucru, amestecați 2 centimetri cubi de pulbere de acid citric, 2 centimetri cubi de sifon și 6 centimetri cubi de zahăr pudră într-o eprubetă. Aceste trei substanțe trebuie amestecate bine prin agitare și turnare pe o foaie mare de hârtie. Această sumă trebuie împărțită în părți egale. Fiecare porțiune trebuie să fie suficient de mare pentru a acoperi fundul rotund al eprubetei. Înfășurați fiecare porție într-o bucată de hârtie separată, așa cum ar fi înfășurat pulberile într-o farmacie. Dintr-o astfel de pungă puteți obține un pahar de limonadă răcoritoare.
Limonada în buzunar Dioxidul de carbon din băuturi mărește efectul lor revigorant. Puteți face oricând spumă de lămâie. Pentru a face acest lucru, amestecați 2 centimetri cubi de pulbere de acid citric, 2 centimetri cubi de sifon și 6 centimetri cubi de zahăr pudră într-o eprubetă. Aceste trei substanțe trebuie amestecate bine prin agitare și turnare pe o foaie mare de hârtie. Această sumă trebuie împărțită în părți egale. Fiecare porțiune trebuie să fie suficient de mare pentru a acoperi fundul rotund al eprubetei. Înfășurați fiecare porție într-o bucată de hârtie separată, așa cum ar fi înfășurat pulberile într-o farmacie. Dintr-o astfel de pungă puteți obține un pahar de limonadă răcoritoare.
Slide 13
 Calcarul eliberează dioxid de carbon Dacă apare spumă atunci când o substanță este umezită cu acid, aceasta se datorează aproape întotdeauna eliberării de dioxid de carbon. El este cel care formează această spumă. Calcarul umezit șuieră și face spumă, iar din el se eliberează dioxid de carbon. Dacă nu sunteți sigur de acest lucru, faceți un experiment: puneți o bucată de calcar într-o eprubetă și adăugați acid, apoi închideți eprubeta cu un dop cu un tub de sticlă și scufundați capătul lung al acestui tub în apă de var. Apa va deveni tulbure. Există mai multe tipuri de var. Calcarul este carbonat de calciu.
Calcarul eliberează dioxid de carbon Dacă apare spumă atunci când o substanță este umezită cu acid, aceasta se datorează aproape întotdeauna eliberării de dioxid de carbon. El este cel care formează această spumă. Calcarul umezit șuieră și face spumă, iar din el se eliberează dioxid de carbon. Dacă nu sunteți sigur de acest lucru, faceți un experiment: puneți o bucată de calcar într-o eprubetă și adăugați acid, apoi închideți eprubeta cu un dop cu un tub de sticlă și scufundați capătul lung al acestui tub în apă de var. Apa va deveni tulbure. Există mai multe tipuri de var. Calcarul este carbonat de calciu.
Slide 14
 Flacără care se scufundă Dioxidul de carbon încălzit, sau fumul, este ușor și se ridică liber în aer, dioxidul de carbon rece este greu, se așează pe fundul vasului și îl umple treptat până la refuz. Arderea este imposibilă în dioxid de carbon, deoarece el însuși este un produs de ardere. Dacă așezi o lumânare pe fundul unui vas și o urmărești un timp, vei vedea că flacăra se va stinge în curând. Dioxidul de carbon, transformat atunci când lumânarea arde, umple treptat vasul până la refuz, iar flacăra se „îneacă” în dioxid de carbon.
Flacără care se scufundă Dioxidul de carbon încălzit, sau fumul, este ușor și se ridică liber în aer, dioxidul de carbon rece este greu, se așează pe fundul vasului și îl umple treptat până la refuz. Arderea este imposibilă în dioxid de carbon, deoarece el însuși este un produs de ardere. Dacă așezi o lumânare pe fundul unui vas și o urmărești un timp, vei vedea că flacăra se va stinge în curând. Dioxidul de carbon, transformat atunci când lumânarea arde, umple treptat vasul până la refuz, iar flacăra se „îneacă” în dioxid de carbon.
Slide 15
 Sursa de informații D. Shkurko, „Funny Chemistry”, Leningrad, „Children’s Literature”, 1976. James Verzeim, Chris Oxlade, „Chemistry. Carte de referință ilustrată școlară”, „ROSMEN”, 1995. F.G. Feldman, G.E. Rudzitis, „Chimie 9. Manual pentru clasa a IX-a de gimnaziu”, M., „Iluminism”, 1994. Surse de ilustrații http://www.tonis.ua/content/news/thumbnail/320x240/349.jpg http: //img.lenta.ru/news/2006/10/27/morgan/picture.jpg http://edwinfotografeert.files.wordpress.com/2010/10/co2-brand.jpg?w=300&h=214 http: //him.1september.ru/2004/36/23-1.jpg http://www.3dnews.ru/_imgdata/img/2009/11/22/150662.jpg http://img.lenta.ru/ science/2004/10/11/carbon/picture.jpg http://img1.liveinternet.ru/images/attach/c/3/75/324/75324927_660779_kopiya.gif http://www.qualenergia.it/sites/ default/files/articolo-img/CO2_anidride_carbonica_carbon_bomba.jpg?1297712324 http://www.blackpantera.ru/upload/iblock/9c9/9c99680c814d3904d302dd9f4d42c33b.jpg
Sursa de informații D. Shkurko, „Funny Chemistry”, Leningrad, „Children’s Literature”, 1976. James Verzeim, Chris Oxlade, „Chemistry. Carte de referință ilustrată școlară”, „ROSMEN”, 1995. F.G. Feldman, G.E. Rudzitis, „Chimie 9. Manual pentru clasa a IX-a de gimnaziu”, M., „Iluminism”, 1994. Surse de ilustrații http://www.tonis.ua/content/news/thumbnail/320x240/349.jpg http: //img.lenta.ru/news/2006/10/27/morgan/picture.jpg http://edwinfotografeert.files.wordpress.com/2010/10/co2-brand.jpg?w=300&h=214 http: //him.1september.ru/2004/36/23-1.jpg http://www.3dnews.ru/_imgdata/img/2009/11/22/150662.jpg http://img.lenta.ru/ science/2004/10/11/carbon/picture.jpg http://img1.liveinternet.ru/images/attach/c/3/75/324/75324927_660779_kopiya.gif http://www.qualenergia.it/sites/ default/files/articolo-img/CO2_anidride_carbonica_carbon_bomba.jpg?1297712324 http://www.blackpantera.ru/upload/iblock/9c9/9c99680c814d3904d302dd9f4d42c33b.jpg
DEFINIŢIE
dioxid de carbon(dioxid de carbon, anhidridă carbonică, dioxid de carbon) – monoxid de carbon (IV).
Formula – CO2. Masa molara – 44 g/mol.
Proprietățile chimice ale dioxidului de carbon
Dioxidul de carbon aparține clasei de oxizi acizi, adică. Când interacționează cu apa, formează un acid numit acid carbonic. Acidul carbonic este instabil din punct de vedere chimic și în momentul formării se descompune imediat în componentele sale, adică. Reacția dintre dioxid de carbon și apă este reversibilă:
CO 2 + H 2 O ↔ CO 2 × H 2 O (soluție) ↔ H 2 CO 3 .
Când este încălzit, dioxidul de carbon se descompune în monoxid de carbon și oxigen:
2CO 2 = 2CO + O 2.
Ca toți oxizii acizi, dioxidul de carbon se caracterizează prin reacții de interacțiune cu oxizi bazici (formați numai din metale active) și baze:
CaO + C02 = CaC03;
Al203 + 3C02 = Al2(C03)3;
C02 + NaOH (diluat) = NaHC03;
CO2 + 2NaOH (conc) = Na2CO3 + H2O.
Dioxidul de carbon nu susține arderea în el numai metalele active:
C02 + 2Mg = C + 2MgO (t);
CO2 + 2Ca = C + 2CaO (t).
Dioxidul de carbon reacționează cu substanțe simple precum hidrogenul și carbonul:
CO2 + 4H2 = CH4 + 2H20 (t, kat = Cu20);
CO2 + C = 2CO (t).
Când dioxidul de carbon reacționează cu peroxizii metalelor active, se formează carbonați și se eliberează oxigen:
2CO 2 + 2Na 2 O 2 = 2Na 2 CO 3 + O 2.
O reacție calitativă la dioxidul de carbon este reacția interacțiunii acestuia cu apa de var (lapte), adică. cu hidroxid de calciu, în care se formează un precipitat alb - carbonat de calciu:
CO2 + Ca(OH)2 = CaCO3↓ + H2O.
Proprietățile fizice ale dioxidului de carbon
Dioxidul de carbon este o substanță gazoasă fără culoare sau miros. Mai greu decât aerul. Stabil termic. Când este comprimat și răcit, se transformă cu ușurință în stare lichidă și solidă. Dioxidul de carbon în stare solidă se numește „gheață carbonică” și se sublimează ușor la temperatura camerei. Dioxidul de carbon este slab solubil în apă și reacționează parțial cu acesta. Densitate – 1,977 g/l.
Producerea și utilizarea dioxidului de carbon
Există metode industriale și de laborator pentru producerea dioxidului de carbon. Astfel, în industrie se obține prin arderea calcarului (1), iar în laborator prin acțiunea acizilor tari asupra sărurilor acidului carbonic (2):
CaC03 = CaO + C02 (t) (1);
CaC03 + 2HCI = CaCI2 + C02 + H20 (2).
Dioxidul de carbon este utilizat în industria alimentară (limonadă de carbonatare), chimică (controlul temperaturii în producția de fibre sintetice), metalurgică (protecția mediului, cum ar fi precipitarea gazului brun) și alte industrii.
Exemple de rezolvare a problemelor
EXEMPLUL 1
| Exercita | Ce volum de dioxid de carbon va fi eliberat prin acţiunea a 200 g de soluţie 10% de acid azotic la 90 g de carbonat de calciu conţinând 8% impurităţi insolubile în acid? |
| Soluţie | Masele molare de acid azotic și carbonat de calciu, calculate folosind tabelul elementelor chimice de D.I. Mendeleev - 63 și, respectiv, 100 g/mol. Să scriem ecuația pentru dizolvarea calcarului în acid azotic: CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O. ω(CaCO 3) cl = 100% - ω amestec = 100% - 8% = 92% = 0,92. Apoi, masa de carbonat de calciu pur este: m(CaCO3) cl = m calcar × ω(CaCO3) cl / 100%; m(CaCO3) cl = 90 × 92 / 100% = 82,8 g. Cantitatea de substanță carbonat de calciu este egală cu: n(CaC03) = m(CaC03)cl/M(CaC03); n(CaC03) = 82,8/100 = 0,83 mol. Masa acidului azotic în soluție va fi egală cu: m(HNO 3) = m(HNO 3) soluție × ω(HNO 3) / 100%; m(HNO 3) = 200 × 10 / 100% = 20 g. Cantitatea de acid azotic de calciu este egală cu: n(HNO3) = m(HNO3) / M(HNO3); n(HNO3) = 20/63 = 0,32 mol. Comparând cantitățile de substanțe care au reacționat, determinăm că acidul azotic este insuficient, prin urmare, se fac calcule suplimentare folosind acid azotic. Conform ecuației reacției n(HNO3): n(CO2) = 2:1, deci n(CO2) = 1/2×n(HNO3) = 0,16 mol. Apoi, volumul de dioxid de carbon va fi egal cu: V(CO2) = n(CO2)×V m; V(CO 2) = 0,16 × 22,4 = 3,58 g. |
| Răspuns | Volumul dioxidului de carbon este de 3,58 g. |