Сообщение на тему углекислый газ (СО2)
Углекислый газ
Углекислый газ - это вещество, существующее обычно в газообразном состоянии. Он может стать твердым, если немного охладится.
В воздухе всегда содержится небольшое количество углекислого газа, около 1 литра в 2560 литрах воздуха. Большая часть углекислого газа поступает в воздух, когда животные и растительные ткани, состоящие из углерода, разлагаются. Топливо, состоящее из углерода, такое, как древесина или каменный уголь, т большое количество двуокиси углерода при сгорании.
Человеческому организму требуется для существования небольшое количество углекислого газа. Он контролирует скорость биения сердца и некоторые другие функции организма. Но перенасыщение организма углекислым газом может причинить вред и даже стать причиной смерти.
Человек получает кислород из воздуха, которым дышит. Кислород поступает в кровь. Там он соединяется с пищей и превращается в результате химических реакций в углекислый газ. Углекислый газ возвращается в легкие и выдыхается.
Деревья, в свою очередь, испытывают жизненную необходимость в углекислом газе. Зеленые растения поглощают углекислый газ из воздуха через поры в листьях. Он соединяется с водой, а затем с помощью солнечного света углекислый газ и вода превращаются в крахмал и другую пищу для растения. Растение при этом выделяет кислород.
Итак, растения выделяют кислород и поглощают углекислый газ. и животные вдыхают кислород, а выдыхают углекислый газ. Это поддерживает постоянное количество кислорода и углекислого газа в воздухе.
Углекислый газ имеет и промышленное применение, самое из известное из которых - это газирование напитков.
Интересные факты:
Концентрация углекислого газа в атмосфере Земли составляет в среднем 0,0395 %.
Одна из самых больших концентраций углекислого газа встречается в атмосферах Венеры и Марса.
По некоторым оценкам климатологов и химиков за последние два века благодаря людям в атмосфере планеты попало порядка 2,1 триллионов тонн CO2. Примечательно, что самое высокое влияние выбросы углекислого газа оказали не на атмосферу, а на океан - его кислотность увеличилась на 30%.
ПОХОЖИЕ ЗАДАНИЯ:
Тема:
Диоксид углерода, оксид углерода, углекислота – все эти названия одного вещества, известного нам, как углекислый газ. Так какими же свойствами обладает этот газ, и каковы области его применения?
Углекислый газ и его физические свойства
Углекислый газ состоит из углерода и кислорода. Формула углекислого газа выглядит так – CO₂. В природе он образуется при сжигании или гниении органических веществ. В воздухе и минеральных источниках содержание газа также достаточно велико. кроме того люди и животные также выделяют диоксид углерода при выдыхании.

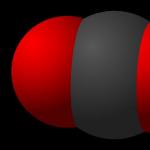
Рис. 1. Молекула углекислого газа.
Диоксид углерода является абсолютно бесцветным газом, его невозможно увидеть. Также он не имеет и запаха. Однако при его большой концентрации у человека может развиться гиперкапния, то есть удушье. Недостаток углекислого газа также может причинить проблемы со здоровьем. В результате недостатка это газа может развиться обратное состояние к удушью – гипокапния.
Если поместить углекислый газ в условия низкой температуры, то при -72 градусах он кристаллизуется и становится похож на снег. Поэтому углекислый газ в твердом состоянии называют «сухой снег».

Рис. 2. Сухой снег – углекислый газ.
Углекислый газ плотнее воздуха в 1,5 раза. Его плотность составляет 1,98 кг/м³ Химическая связь в молекуле углекислого газа ковалентная полярная. Полярной она является из-за того, что у кислорода больше значение электроотрицательности.
Важным понятием при изучении веществ является молекулярная и молярная масса. Молярная масса углекислого газа равна 44. Это число формируется из суммы относительных атомных масс атомов, входящих в состав молекулы. Значения относительных атомных масс берутся из таблицы Д.И. Менделеева и округляются до целых чисел. Соответственно, молярная масса CO₂ = 12+2*16.
Чтобы вычислить массовые доли элементов в углекислом газе необходимо следовать формулерасчета массовых долей каждого химического элемента в веществе.
n
– число атомов или молекул.
Ar
– относительная атомная масса химического элемента.
Mr
– относительная молекулярная масса вещества.
Рассчитаем относительную молекулярную массу углекислого газа.
Mr(CO₂) = 14 + 16 * 2 = 44 w(C) = 1 * 12 / 44 = 0,27 или 27 % Так как в формулу углекислого газа входит два атома кислорода, то n = 2 w(O) = 2 * 16 / 44 = 0,73 или 73 %
Ответ: w(C) = 0,27 или 27 %; w(O) = 0,73 или 73 %
Химические и биологические свойства углекислого газа
Углекислый газ обладает кислотными свойствами, так как является кислотным оксидом, и при растворении в воде образует угольную кислоту:
CO₂+H₂O=H₂CO₃
Вступает в реакцию со щелочами, в результате чего образуются карбонаты и гидрокарбонаты. Этот газ не подвержен горению. В нем горят только некоторые активные металлы, например, магний.
При нагревании углекислый газ распадается на угарный газ и кислород:
2CO₃=2CO+O₃.
Как и другие кислотные оксиды, данный газ легко вступает в реакцию с другими оксидами:
СaO+Co₃=CaCO₃.
Углекислый газ входит в состав всех органических веществ. Круговорот этого газа в природе осуществляется с помощью продуцентов, консументов и редуцентов. В процессе жизнедеятельности человек вырабатывает примерно 1 кг углекислого газа в сутки. При вдохе мы получаем кислород, однако в этот момент в альвеолах образуется углекислый газ. В этот момент происходит обмен: кислород попадает в кровь, а углекислый газ выходит наружу.
Получение углекислого газа происходит при производстве алкоголя. Также этот газ является побочным продуктом при получении азота, кислорода и аргона. Применение углекислого газа необходимо в пищевой промышленности, где углекислый газ выступает в качестве консерванта, а также углекислый газ в виде жидкости содержится в огнетушителях.

Рис. 3. Огнетушитель.
Что мы узнали?
Углекислый газ – вещество, которое в нормальных условиях не имеет цвета и запаха. помимо своего обычного названия – углекислый газ, его также называют оксидом углерода или диоксидом углерода.
Тест по теме
Оценка доклада
Средняя оценка: 4.3 . Всего получено оценок: 105.
Углекислый газ, бесцветный, без запаха, растворимость в воде - в 1V H 2 O растворяется 0,9V CO 2 (при нормальных условиях); тяжелее воздуха; t°пл.= -78,5°C (твёрдый CO 2 называется "сухой лёд"); не поддерживает горение.
При растворении в воде образует слабую угольную кислоту, окрашивающую лакмусовую бумажку в красный цвет. Угольная кислота улучшает вкусовые качества газированных напитков и предотвращает рост бактерий. Реагируя со гидроксидами щелочных и щелочноземельных металлов, а также с аммиаком, СО 2 образует карбонаты и бикарбонаты.
Загрузить модуль
При повышении давления и охлаждении диоксид углерода легко сжижается и находится в жидком состоянии при температурах от +31 до –57° С (в зависимости от давления). Ниже –57° С переходит в твердое состояние (сухой лед). Давление, необходимое для сжижения, зависит от температуры: при +21° С оно составляет 60 атм, а при –18° С всего 20 атм. Жидкий СО2 хранят в герметичных емкостях под соответствующим давлением. При переходе в атмосферу часть его превращается в газ, а некоторое количество – в «углеродный снег», при этом его температура понижается до –84° С.
Поглощая тепло из окружающей среды, сухой лед переходит в газообразное состояние, минуя жидкую фазу, – сублимирует. Для уменьшения сублимационных потерь его хранят и транспортируют в герметичных контейнерах, достаточно прочных, чтобы выдержать увеличение давления при повышении температуры.
Углекислый газ — это «одеяло» Земли. Он легко пропускает ультрафиолетовые лучи, которые обогревают нашу планету, и отражает инфракрасные, излучаемые с ее поверхности в космическое пространство.
В повседневной практике углекислый газ используется достаточно широко. Например, газированная вода с добавками ароматных эссенций – прекрасный освежающий напиток. В пищевой промышленности диоксид углерода используется и как консервант — он обозначается на упаковке под кодом Е290, а также в качестве разрыхлителя теста.
Углекислотными огнетушителями пользуются при пожарах. Биохимики нашли, что удобрение... воздуха углекислым газом весьма эффективное средство для увеличения урожайности различных культур. Пожалуй, такое удобрение имеет единственный, но существенный недостаток: применять его можно только в оранжереях.На заводах, производящих диоксид углерода, сжиженный газ расфасовывают в стальные баллоны и отправляют потребителям.
Углекислый газ используется в качестве активной среды при сварке проволокой, так как при температуре дуги углекислота разлагается на угарный газ СО и кислород, который, в свою очередь, и входит во взаимодействие с жидким металлом, окисляя его.
Углекислота в баллончиках применяется в пневматическом оружии и в качестве источника энергии для двигателей в авиамоделировании.
В больших концентрациях углекислый газ токсичен, вызывает гипоксию. Длительное (до нескольких сут)вдыхание его даже при концентрации 1,5—3% вызывает головную боль, головокружение, тошноту. При концентрации выше 6% (так называемый критический уровень) теряется работоспособность, появляются сонливость, ослабление дыхания и сердечной деятельности, возникает опасность для жизни. Первая помощь: вынести пострадавшего на свежий воздух, провести искусственное дыхание. В воздухе жилых и общественных зданий накопление углекислого газа не достигает критических величин; его концентрация — один из санитарно-гигиенических показателей степени чистоты воздушной среды.
Cлайд 1
Презентация по химии для учащихся 9 класса на тему: «Углекислый газ» МБОУ –Раздольненская средняя общеобразовательная школа №19 Новосибирского района Новосибирской области Выполнила: учитель химии Евстегнеева Алевтина Васильевна с. Раздольное 2011Cлайд 2
 Структурная формула углекислого газа О=С=О Молекулярная формула углекислого газа СО2
Структурная формула углекислого газа О=С=О Молекулярная формула углекислого газа СО2
Cлайд 3
 Физические свойства Оксид углерода (IV) – бесцветный газ, примерно в 1,5 раза тяжелее воздуха, хорошо растворим в воде без запаха, не горюч, не поддерживает горение, вызывает удушье. Под давлением превращается в бесцветную жидкость, которая при охлаждении застывает.
Физические свойства Оксид углерода (IV) – бесцветный газ, примерно в 1,5 раза тяжелее воздуха, хорошо растворим в воде без запаха, не горюч, не поддерживает горение, вызывает удушье. Под давлением превращается в бесцветную жидкость, которая при охлаждении застывает.
Cлайд 4
 Образование оксида углерода (IV) В промышленности – побочный продукт при производстве извести. В лаборатории при взаимодействии кислот с мелом или мрамором. При сгорании углеродсодержащих веществ. При медленном окислении в биохимических процессах (дыхание, гниение, брожение).
Образование оксида углерода (IV) В промышленности – побочный продукт при производстве извести. В лаборатории при взаимодействии кислот с мелом или мрамором. При сгорании углеродсодержащих веществ. При медленном окислении в биохимических процессах (дыхание, гниение, брожение).
Cлайд 5
 Применение оксида углерода (IV) Получение сахара. Тушение пожара. Производства фруктовых вод. «Сухой лёд». Получение моющихся средств. Получение лекарств. Получение соды, которую используют для получения стекла.
Применение оксида углерода (IV) Получение сахара. Тушение пожара. Производства фруктовых вод. «Сухой лёд». Получение моющихся средств. Получение лекарств. Получение соды, которую используют для получения стекла.
Cлайд 6
 Мы ловим дым Горение связано с появлением дыма. Дым бывает белым, черным, а иногда – невидимый. Над горячей свечой или спиртовкой поднимается такой «невидимый» дым, называемый углекислым газом. Чистую пробирку подержи над свечей и улови немного «невидимого» дыма. Чтобы он не улетел, быстро закрой пробирку пробкой без отверстия. Углекислый газ будет невидим и в пробирке. Сохрани эту пробирку с углекислым газом для дальнейших опытов.
Мы ловим дым Горение связано с появлением дыма. Дым бывает белым, черным, а иногда – невидимый. Над горячей свечой или спиртовкой поднимается такой «невидимый» дым, называемый углекислым газом. Чистую пробирку подержи над свечей и улови немного «невидимого» дыма. Чтобы он не улетел, быстро закрой пробирку пробкой без отверстия. Углекислый газ будет невидим и в пробирке. Сохрани эту пробирку с углекислым газом для дальнейших опытов.
Cлайд 7
 «Мутная история» Налей немного известковой воды (чтобы покрыть дно) в ту пробирку, в которую ты уловил углекислый газ от пламени свечи. Закрой пробирку пальцем и встряхни ее. Прозрачная известковая вода стала совсем мутной. В этом виноват только углекислый газ. Если возьмёшь известковой воды в пробирку, в которой не было углекислого газа, и встряхнешь пробирку, то вода останется прозрачной. Значит, помутнение известковой воды является доказательством того, что в пробирке был углекислый газ.
«Мутная история» Налей немного известковой воды (чтобы покрыть дно) в ту пробирку, в которую ты уловил углекислый газ от пламени свечи. Закрой пробирку пальцем и встряхни ее. Прозрачная известковая вода стала совсем мутной. В этом виноват только углекислый газ. Если возьмёшь известковой воды в пробирку, в которой не было углекислого газа, и встряхнешь пробирку, то вода останется прозрачной. Значит, помутнение известковой воды является доказательством того, что в пробирке был углекислый газ.
Cлайд 8
 Из соды выделяется углекислый газ Возьми немного порошка соды и подогрей его в горизонтальной укреплённой пробирке. Эту пробирку соедини коленчатой трубкой с другой пробиркой, в которой находится вода. Из трубки начнут появляться пузырьки. Следовательно, из соды в воду поступает какой то газ. Не следует допускать, чтобы стеклянная трубка была опущена в воду после окончания нагрева, иначе вода поднимется по трубке и попадет в горячую пробирку с содой. От этого пробирка может лопнуть. После того, кок ты увидишь, что из соды при нагревании выделяется газ, попробуй заменить простую воду в пробирке известковой водой. Она станет мутной. Из соды выделяется углекислый газ.
Из соды выделяется углекислый газ Возьми немного порошка соды и подогрей его в горизонтальной укреплённой пробирке. Эту пробирку соедини коленчатой трубкой с другой пробиркой, в которой находится вода. Из трубки начнут появляться пузырьки. Следовательно, из соды в воду поступает какой то газ. Не следует допускать, чтобы стеклянная трубка была опущена в воду после окончания нагрева, иначе вода поднимется по трубке и попадет в горячую пробирку с содой. От этого пробирка может лопнуть. После того, кок ты увидишь, что из соды при нагревании выделяется газ, попробуй заменить простую воду в пробирке известковой водой. Она станет мутной. Из соды выделяется углекислый газ.
Cлайд 9
 Лимонадный газ – это тоже углекислый газ Если ты откроешь бутылку с лимонадом или же начнешь её взбалтывать, то в ней появится множество газовых пузырьков. Закрой бутылку с лимонадом пробкой, в которую вставлена стеклянная трубка, и опусти длинный конец трубки в пробирку с известковой водой. Вскоре вода станет мутной. Значит, лимонный газ – это углекислый газ. Он образуется из содержащей в лимонаде угольной кислоты.
Лимонадный газ – это тоже углекислый газ Если ты откроешь бутылку с лимонадом или же начнешь её взбалтывать, то в ней появится множество газовых пузырьков. Закрой бутылку с лимонадом пробкой, в которую вставлена стеклянная трубка, и опусти длинный конец трубки в пробирку с известковой водой. Вскоре вода станет мутной. Значит, лимонный газ – это углекислый газ. Он образуется из содержащей в лимонаде угольной кислоты.
Cлайд 10
 Уксус выгоняет из соды углекислый газ Углекислый газ содержит в ряде веществ, но определить его на глаза невозможно. Если ты польёшь уксусом кусочек соды, то уксус сильно зашипит и при этом из соды выделится какой то газ. Если ты положишь кусочек соды в пробирку, нальёшь в нее немного уксуса, закроешь пробкой с коленчатой трубкой и опустишь длинный конец трубки в известковую воду, то убедишься, что из соды так же выделяется углекислый газ.
Уксус выгоняет из соды углекислый газ Углекислый газ содержит в ряде веществ, но определить его на глаза невозможно. Если ты польёшь уксусом кусочек соды, то уксус сильно зашипит и при этом из соды выделится какой то газ. Если ты положишь кусочек соды в пробирку, нальёшь в нее немного уксуса, закроешь пробкой с коленчатой трубкой и опустишь длинный конец трубки в известковую воду, то убедишься, что из соды так же выделяется углекислый газ.
Cлайд 11
 Фабрика лимонада Даже слабая кислота выгоняет из соды углекислый газ. Покрой дно пробирки лимонной кислотой и насыпь поверху нее столько же соды. Смешай эти два вещества. Оба они уживаются, но ненадолго. Высыпь эту смесь в обыкновенный стакан и быстро наполни его свежей водой. Как сильно она шипит и пенится! Как настоящий лимонад. Ты спокойно можешь отпить его. Это абсолютно безвредно, даже вкусно. Надо только в самом начале добавить сахар, просто чтобы было вкуснее.
Фабрика лимонада Даже слабая кислота выгоняет из соды углекислый газ. Покрой дно пробирки лимонной кислотой и насыпь поверху нее столько же соды. Смешай эти два вещества. Оба они уживаются, но ненадолго. Высыпь эту смесь в обыкновенный стакан и быстро наполни его свежей водой. Как сильно она шипит и пенится! Как настоящий лимонад. Ты спокойно можешь отпить его. Это абсолютно безвредно, даже вкусно. Надо только в самом начале добавить сахар, просто чтобы было вкуснее.
Cлайд 12
 Лимонад в кармане Углекислый газ в напитках увеличивает их освежающее действие. Ты можешь в любое время приготовить пенящийся лимон. Для этого надо в пробирке смешать 2 кубических сантиметра порошка лимонной кислоты, 2 кубических сантиметра соды и 6 кубических сантиметра истолченного в порошок сахара. Эти три вещества надо тщательно перемешать, встряхивая, и высыпая на большой лист бумаги. Это количество надо разделить на равные порции. Каждая порция должна быть такой величины, чтобы её можно было покрыть круглое дно пробирки. Каждую порцию заверни в отдельную бумажку, как заворачивают порошки в аптеке. Из одного такого пакетика можно получить стакан освежающего лимонада.
Лимонад в кармане Углекислый газ в напитках увеличивает их освежающее действие. Ты можешь в любое время приготовить пенящийся лимон. Для этого надо в пробирке смешать 2 кубических сантиметра порошка лимонной кислоты, 2 кубических сантиметра соды и 6 кубических сантиметра истолченного в порошок сахара. Эти три вещества надо тщательно перемешать, встряхивая, и высыпая на большой лист бумаги. Это количество надо разделить на равные порции. Каждая порция должна быть такой величины, чтобы её можно было покрыть круглое дно пробирки. Каждую порцию заверни в отдельную бумажку, как заворачивают порошки в аптеке. Из одного такого пакетика можно получить стакан освежающего лимонада.
Cлайд 13
 Известняк выделяет углекислый газ Если при смачивании какого – либо вещества кислотой появляется пена, почти всегда это происходит от выделяющего углекислого газа. Именно он и образует эту пену. Смоченный известняк шипит и пенится, из него выделяется углекислый газ. Если ты не уверен в этом, сделай опыт: положи кусочек известняка в пробирку и подлей кислоты, затем закрой пробирку пробкой со стеклянной трубкой и опусти длинный конец этой трубки в известковую воду. Вода помутнеет. Существует несколько видов извести. Известняк – это углекислый кальций.
Известняк выделяет углекислый газ Если при смачивании какого – либо вещества кислотой появляется пена, почти всегда это происходит от выделяющего углекислого газа. Именно он и образует эту пену. Смоченный известняк шипит и пенится, из него выделяется углекислый газ. Если ты не уверен в этом, сделай опыт: положи кусочек известняка в пробирку и подлей кислоты, затем закрой пробирку пробкой со стеклянной трубкой и опусти длинный конец этой трубки в известковую воду. Вода помутнеет. Существует несколько видов извести. Известняк – это углекислый кальций.
Cлайд 14
 Тонущее пламя Согретый углекислый газ, или дым, легок и свободно поднимается в воздух, холодный углекислый газ тяжёл, оседает на дно сосуда и наполняет его постепенно до краёв. В углекислом газе горение невозможно, так как он сам является продуктом горения. Если ты поставишь свечу на дно какого – нибудь сосуда и некоторое время понаблюдаешь за ней, то увидишь, что пламя вскоре погаснет. Углекислый газ, преобразовавшийся при горении свечи, постепенно наполнить сосуд до краёв, и пламя «утонет» в углекислом газе.
Тонущее пламя Согретый углекислый газ, или дым, легок и свободно поднимается в воздух, холодный углекислый газ тяжёл, оседает на дно сосуда и наполняет его постепенно до краёв. В углекислом газе горение невозможно, так как он сам является продуктом горения. Если ты поставишь свечу на дно какого – нибудь сосуда и некоторое время понаблюдаешь за ней, то увидишь, что пламя вскоре погаснет. Углекислый газ, преобразовавшийся при горении свечи, постепенно наполнить сосуд до краёв, и пламя «утонет» в углекислом газе.
Cлайд 15
 Источник информации Д. Шкурко, «Забавная химия», Ленинград, «Детская литература», 1976 г. Джейм Верзейм, Крис Окслейд, «Химия. Школьный иллюстрированный справочник», «РОСМЭН», 1995 г. Ф.Г. Фельдман,Г.Е. Рудзитис, «Химия 9. Учебник для 9 класса средних общеобразовательных заведений», М. , «Просвещение», 1994 г. Источники иллюстраций http://www.tonis.ua/content/news/thumbnail/320x240/349.jpg http://img.lenta.ru/news/2006/10/27/morgan/picture.jpg http://edwinfotografeert.files.wordpress.com/2010/10/co2-brand.jpg?w=300&h=214 http://him.1september.ru/2004/36/23-1.jpg http://www.3dnews.ru/_imgdata/img/2009/11/22/150662.jpg http://img.lenta.ru/science/2004/10/11/carbon/picture.jpg http://img1.liveinternet.ru/images/attach/c/3/75/324/75324927_660779_kopiya.gif http://www.qualenergia.it/sites/default/files/articolo-img/CO2_anidride_carbonica_carbon_bomba.jpg?1297712324 http://www.blackpantera.ru/upload/iblock/9c9/9c99680c814d3904d302dd9f4d42c33b.jpg
Источник информации Д. Шкурко, «Забавная химия», Ленинград, «Детская литература», 1976 г. Джейм Верзейм, Крис Окслейд, «Химия. Школьный иллюстрированный справочник», «РОСМЭН», 1995 г. Ф.Г. Фельдман,Г.Е. Рудзитис, «Химия 9. Учебник для 9 класса средних общеобразовательных заведений», М. , «Просвещение», 1994 г. Источники иллюстраций http://www.tonis.ua/content/news/thumbnail/320x240/349.jpg http://img.lenta.ru/news/2006/10/27/morgan/picture.jpg http://edwinfotografeert.files.wordpress.com/2010/10/co2-brand.jpg?w=300&h=214 http://him.1september.ru/2004/36/23-1.jpg http://www.3dnews.ru/_imgdata/img/2009/11/22/150662.jpg http://img.lenta.ru/science/2004/10/11/carbon/picture.jpg http://img1.liveinternet.ru/images/attach/c/3/75/324/75324927_660779_kopiya.gif http://www.qualenergia.it/sites/default/files/articolo-img/CO2_anidride_carbonica_carbon_bomba.jpg?1297712324 http://www.blackpantera.ru/upload/iblock/9c9/9c99680c814d3904d302dd9f4d42c33b.jpg
ОПРЕДЕЛЕНИЕ
Углекислый газ (двуокись углерода, угольный ангидрид, диоксид углерода) – оксид углерода (IV).
Формула – СО 2 . Молярная масса – 44 г/моль.
Химические свойства углекислого газа
Углекислый газ относится к классу кислотных оксидов, т.е. при взаимодействии с водой он образует кислоту, которая называется угольная. Угольная кислота химически неустойчива и в момент образования сразу же распадается на составляющие, т.е. реакция взаимодействия углекислого газа с водой носит обратимый характер:
CO 2 + H 2 O ↔ CO 2 ×H 2 O(solution) ↔ H 2 CO 3 .
При нагревании углекислый газ распадается на угарный газ и кислород:
2CO 2 = 2CO + O 2 .
Как и для всех кислотных оксидов, для углекислого газа характерны реакции взаимодействия с основными оксидами (образованными только активными металлами) и основаниями:
CaO + CO 2 = CaCO 3 ;
Al 2 O 3 + 3CO 2 = Al 2 (CO 3) 3 ;
CO 2 + NaOH (dilute) = NaHCO 3 ;
CO 2 + 2NaOH (conc) = Na 2 CO 3 + H 2 O.
Углекислый газ не поддерживает горения, в нем горят только активные металлы:
CO 2 + 2Mg = C + 2MgO (t);
CO 2 + 2Ca = C + 2CaO (t).
Углекислый газ вступает в реакции взаимодействия с простыми веществами, такими как водород и углерод:
CO 2 + 4H 2 = CH 4 + 2H 2 O (t, kat = Cu 2 O);
CO 2 + C = 2CO (t).
При взаимодействии углекислого газа с пероксидами активных металлов образуются карбонаты и выделяется кислород:
2CO 2 + 2Na 2 O 2 = 2Na 2 CO 3 + O 2 .
Качественной реакцией на углекислый газ является реакция его взаимодействия с известковой водой (молоком), т.е. с гидроксидом кальция, в которой образуется осадок белого цвета – карбонат кальция:
CO 2 + Ca(OH) 2 = CaCO 3 ↓ + H 2 O.
Физические свойства углекислого газа
Углекислый газ – газообразное вещество без цвета и запаха. Тяжелее воздуха. Термически устойчив. При сжатии и охлаждении легко переходит в жидкое и твердое состояния. Углекислый газ в твердом агрегатном состоянии носит название «сухой лед» и легко возгоняется при комнатной температуре. Углекислый газ плохо растворим в воде, частично реагирует с ней. Плотность – 1,977 г/л.
Получение и применение углекислого газа
Выделяют промышленные и лабораторные способы получения углекислого газа. Так, в промышленности его получают обжигом известняка (1), а в лаборатории – действием сильных кислот на соли угольной кислоты (2):
CaCO 3 = CaO + CO 2 (t) (1);
CaCO 3 + 2HCl = CaCl 2 + CO 2 + H 2 O (2).
Углекислый газ используется в пищевой (газирование лимонада), химической (регулировка температур при производстве синтетических волокон), металлургической (защита окружающей среды, например, осаждение бурого газа) и других отраслях промышленности.
Примеры решения задач
ПРИМЕР 1
| Задание | Какой объем углекислого газа выделится при действии 200 г 10%-го раствора азотной кислоты на 90 г карбоната кальция, содержащего 8% примесей, нерастворимых в кислоте? |
| Решение |
Молярные массы азотной кислоты и карбоната кальция, рассчитанные с использованием таблицы химических элементов Д.И. Менделеева – 63 и 100 г/моль, соответственно.
Запишем уравнение растворения известняка в азотной кислоте: CaCO 3 + 2HNO 3 → Ca(NO 3) 2 + CO 2 + H 2 O. ω(CaCO 3) cl = 100% — ω admixture = 100% — 8% = 92% = 0,92. Тогда, масса чистого карбоната кальция: m(CaCO 3) cl = m limestone × ω(CaCO 3) cl / 100%; m(CaCO 3) cl = 90 × 92 / 100% = 82,8 г. Количество вещества карбоната кальция равно: n(CaCO 3) = m(CaCO 3) cl / M(CaCO 3); n(CaCO 3) = 82,8 / 100 = 0,83 моль. Масса азотной кислоты в растворе будет равна: m(HNO 3) = m(HNO 3) solution × ω(HNO 3) / 100%; m(HNO 3) = 200 × 10 / 100% = 20 г. Количество вещества азотной кислоты кальция равно: n(HNO 3) = m(HNO 3) / M(HNO 3); n(HNO 3) = 20 / 63 = 0,32 моль. Сравнивая количества веществ, вступивших в реакцию, определяем, что азотная кислота находится в недостатке, следовательно дальнейшие расчеты производим по азотной кислоте. Согласно уравнению реакции n(HNO 3): n(CO 2) = 2:1, следовательно n(CO 2) = 1/2×n(HNO 3) = 0,16 моль. Тогда, объем углекислого газа будет равен: V(CO 2) = n(CO 2)×V m ; V(CO 2) = 0,16×22,4 = 3,58 г. |
| Ответ | Объем углекислого газа — 3,58 г. |